
IgA肾病
IgA肾病是全球慢性肾病和肾衰竭的主要原因之一,发病人群主要为青壮年,在亚洲地区发病率远高于全球其他地区,疾病负担较重。对于存在持续较高尿蛋白水平(≥1g/天)的IgA肾病患者,将有高达30%概率在10年内进展至肾衰竭。2021年最新改善全球肾脏疾病预后组织(KDIGO)指南推荐严格控制血压、充分地抑制肾素-血管紧张素-醛固酮系统(RAAS)是IgA肾病的主要支持治疗,但仍有大量患者存在疾病进展风险,IgA肾病有巨大的未满足临床需求。
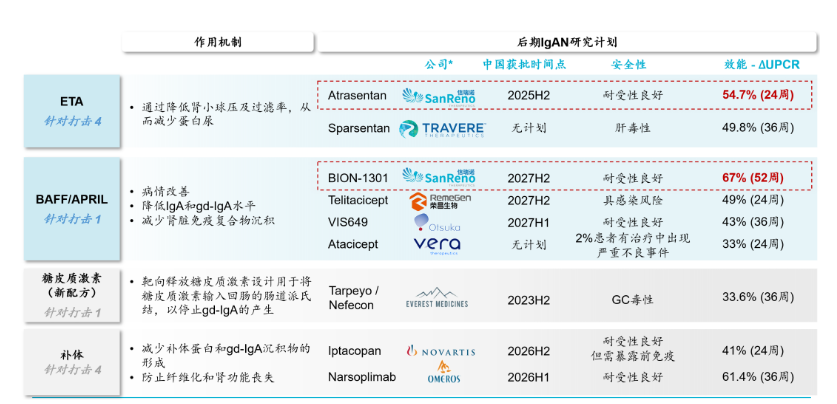
药融云数据库显示:此前信瑞诺医药(SanReno Therapeutics)拥有Therapeutics, INC("KDNY")两个核心产品,atrasentan(选择性内皮素受体拮抗剂,国际临床III期阶段)(阿曲生坦)及zigakibart (BION-1301)(抗APRIL单抗,国际临床III期阶段)的大中华区及新加坡地区权益。

截止2023年11月,信瑞诺仍然对外宣称为系一家独立运营的实体并将继续在原定的公司规划上扬帆前行,以期为中国肾病患者带来新的机遇和福音。

此前在2023年6月12日,信瑞诺产品许可方同时亦为公司主要股东的Chinook Therapeutics, INC("KDNY")宣布了一项其被诺华/Novartis收购的交易,通过可高达35亿美元(其中32亿美元为现金)的交易Novartis拥有Chinook的控制权。
药融云数据库显示:最新监测显示:2024年1月5日,信瑞诺宣布其被Novartis收购。随着收购完成,信瑞诺成为Novartis的间接全资子公司。信瑞诺的创始投资机构,包括Pivotal bioVenture Partners China(鼎丰生科资本),Frazier Life Sciences,Samsara BioCapital和Versant Ventures,向诺华出售了在信瑞诺所拥有的股权。
内皮素A(ETA)受体拮抗剂atrasentan利好数据

药融云全球药物研发数据库
Atrasentan是一种强效高选择性(Ki=0.034nM)内皮素A(ETA)受体拮抗剂,可选择性阻断ETA受体,通过阻断肾小球系膜细胞活化,直接的抗炎和抗纤维化,降低球囊内压力和肾小球滤过屏障大分子的通透性来减少 IgAN 患者的尿蛋白。本品最早由雅培制药开发,相关专利WO-09606095;后转让予Chinook;现不同地区权益归属于诺华和信瑞诺。
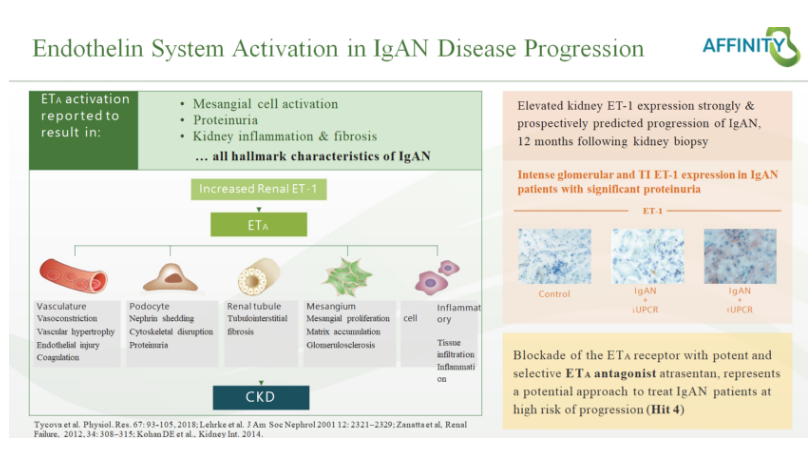
2023年10月30日,诺华/Chinook披露了atrasentan治疗IgA肾病的III期ALIGN临床研究36周期中分析取得了积极结果。

与安慰剂相比,atrasentan治疗组展现出具有临床意义和高度显著性统计学意义的蛋白尿减少,安全性与既往AFFINITY IgA肾病研究一致。基于该结果,诺华/Chinook计划与美国FDA展开讨论,以期尽快实现上市申请递交(2024年预期);ALIGN研究将继续进行,预期在2026年第一季度达到次要终点,获得确证性的136 周eGFR研究数据。
ALIGN研究(临床试验登记号:NCT04573478)是一项全球多中心、随机双盲、安慰剂对照的3期临床研究,旨在具有进行性肾功能丧失风险的成人IgA肾病患者中比较atrasentan与安慰剂的疗效和安全性。此研究共入组大约340例经肾活检证实的IgA肾病患者,这些患者既往已接受优化最大可耐受剂量的肾素-血管紧张素系统抑制剂(RASi)治疗,但其基线总蛋白尿仍超过1g/天。入组患者被随机分配至接受每日一次口服atrasentan(0.75 mg)或安慰剂治疗约2.5年(136周)。研究的主要疗效终点是通过尿蛋白/肌酐比值(UPCR)测量的蛋白尿自基线至36周的变化。
信瑞诺医药负责在中国大陆、中国港澳台及新加坡授权区域范围内的研究组织、执行工作并贡献了约1/4的研究病例。此前信瑞诺医药计划于2024年向中国NMPA递交新药上市申请(NDA)。
参考:
NMPA/CDE;
FDA/EMA/PMDA;
相关公司公开披露;
www.sanreno.com;
www.novartis.com;等等
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论