2021年8月,有媒体发文表示,近几年,不少家长对孩子的身高表现出过度的焦虑,医学上主要用于矮小症的“增高针”治疗悄然兴起,“有些家长觉得孩子个头不高,就想打增高针、用增高产品。”其实,所谓“增高针”就是注射生长激素。“有专家认为,生长激素有被滥用的苗头。”……此文一发出,便在行业内引起不少争议。文中提到的现象笔者无法做出评论,不过在医学上确有“矮小症”这一说法。除家族遗传之外,有相当一部分患者是由内分泌疾病引起,其中最常见的就是脑垂体分泌生长激素障碍,称为生长激素缺乏症(GHD),又称垂体性侏儒症,该病是一种严重的孤儿病,儿童和成人均可患病,患者特点表现为身材矮小、代谢异常、认知缺陷等。儿童患病率约为1/5000,成人患病率约为2-3/10000。针对儿童和成人内源性生长激素缺乏,常用人生长激素(hGH)进行长期治疗。
二十世纪80年代初,Genentech公司利用大肠杆菌(E.Coli)包涵体技术研制出首个重组人生长激素(r-hGH),从那时起,许多制药公司便着手开发每日注射的生长激素,并成为几十年来GHD的标准治疗方法。虽然达到了治疗效果,但是每日注射给患者与护理人员带来了负担,极大影响了患者治疗的依从性。二十世纪90年代开始,制药公司采用各种方法来开发长效生长激素产品,以减少患者每日注射的负担,并提高患者对给药方案的依从性,但由于制造、监管、功效安全性、与缓释技术相关的耐受性原因,目前尚未有长效生长激素产品取得真正意义上的商业成功。
生长激素迎来“周注射”时代

2021年8月25日,美国FDA批准了每周给药一次的注射用隆培促生长素(lonapegsomatropin-tcgd)(注射用TransConhGH,当地商品名:SKYTROFA®),用于治疗一岁以上,体重至少11.5公斤,因内源性生长激素分泌不足而导致生长障碍的儿童患者。该产品是首个美国FDA批准的通过一次注射,可于一周内持续释放,递送生长激素的产品,由丹麦生物制药公司Ascendis Pharma A/S(纳斯达克股票代码:ASND)开发,中国公司维昇药业(VISEN Pharmaceuticals)为该产品在大中华区的独家授权研发、销售及生产企业。
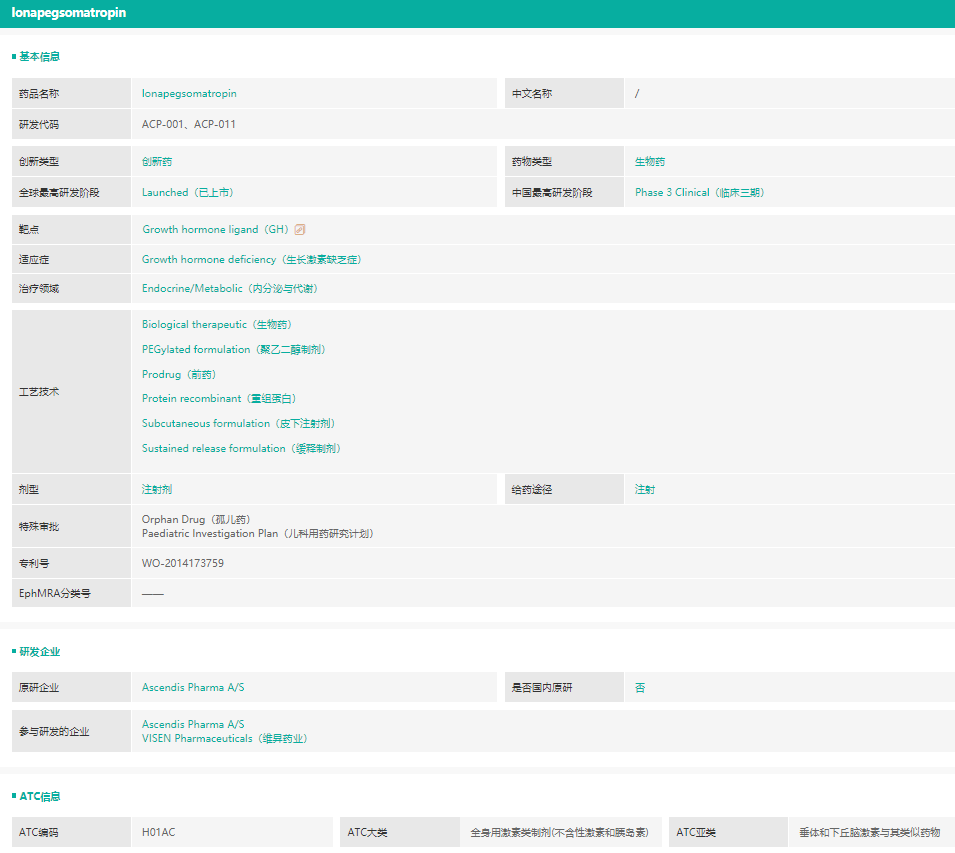
截图来源:药融云全球药物研发数据库
此次批准是基于国际III期临床试验heiGHt的结果,该试验是一项随机、开放标签、阳性对照试验,在161例生长激素缺乏症初治儿童中比较了每周一次隆培促生长素与每日一次生长激素治疗的效果。在本试验中,隆培促生长素达到了非劣效性的主要终点,并且在52周时显示了相较于每日生长激素更高的年化生长速率(隆培促生长素为11.2厘米/年,每日生长激素为10.3厘米/年,组间差异为0.9厘米/年),且安全性相似。
据药融云数据库显示,目前该药正在国内开展III期临床试验(CTR20200399)。

来源:药融圈旗下药融云数据库
此次获批的还包括隆培促生长素新的自动注射器和药筒,该装置可以使药物在首次从冰箱取出后,在室温下储存的时间长达六个月。与每天注射相比,每周注射的患者每年可减少86%的注射天数。生长激素迎来“周注射”时代。
关于Ascendis Pharma
SKYTROFA®是Ascendis Pharma公司利用其专有的长效/前药技术平台TransCon开发的首款产品。该公司于2006年9月成立,总部位于丹麦哥本哈根,2007年12月,Ascendis宣布收购了发明TransCon技术的德国生物技术公司Complex Biosystems GmbH(2002年创立,现为Ascendis Pharma GmbH,位于德国海德堡),并完成1760万欧元的A轮融资,开始正式运营。2015年1月28日,Ascendis Pharma登陆纳斯达克。

Ascendis Pharma正在应用创新的TransCon技术平台来建立一家领先的、完全集成的生物制药公司,通过将TransCon技术与临床上已验证的母体药物相结合,开发一系列创新和潜在的best-in-class候选产品,以解决未满足的医疗需求。目前,公司主要聚焦于内分泌罕见疾病以及肿瘤。
TransCon长效技术
TransCon技术平台是公司创新的强大核心,TransCon即“暂时连接(transient conjugation)”,能独特地将惰性载体(carrier)与具有已知生物学性质的原型药物(parent drug)进行临时的(短暂的)连接。该技术旨在解决目前的长效给药技术的局限性,并增加特定治疗的整体优势。许多药物药代动力学性质欠佳,在体内停留时间短,给药部位耐受性差和/或由于初始药物浓度过高而导致的全身副作用。TransCon技术结合了传统前体药物和缓释技术的优点,在疗效、安全性和给药频率方面实现了进一步优化。根据所使用的载体,TransCon前体药物可以被设计为全身作用和局部作用(例如肿瘤内),满足特定治疗目标,并可在多种治疗领域广泛应用于蛋白质、多肽以及小分子药物。
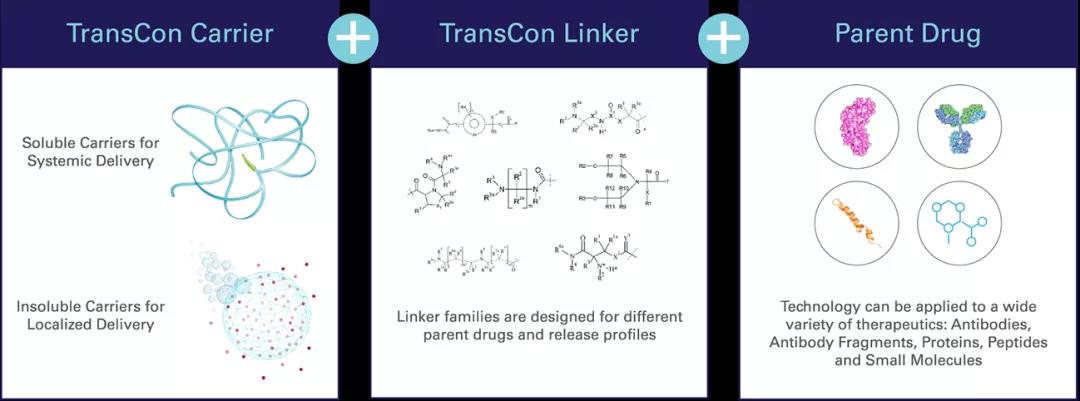
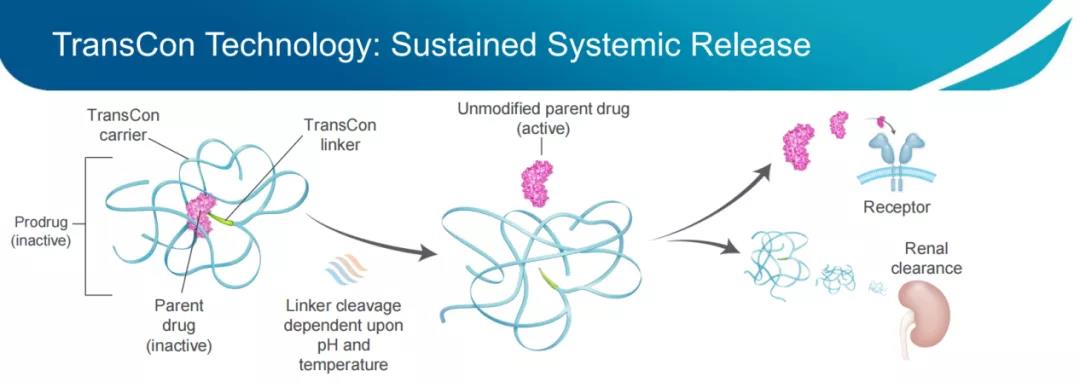
TransCon分子由3部分组成:具有已知生物学性质的未修饰原型药物、为原型药物提供保护的惰性载体,以及将两者暂时结合的连接子(Linker)。当原型药物与载体结合时,载体抑制原型药物的活性并保护其免于被机体清除;当药物注射到体内时,可根据生理pH和温度条件,使未修饰、具有活性的原型药物以预定的速率、可预测的方式进行释放。由于原型药物未经修饰,其可以原始药理机制发挥作用。此外,可根据所采用的TransCon载体类型对TransCon前体药物进行设计,在传统疗法难以治疗的部位实现全身的或局部的作用。
技术关键:
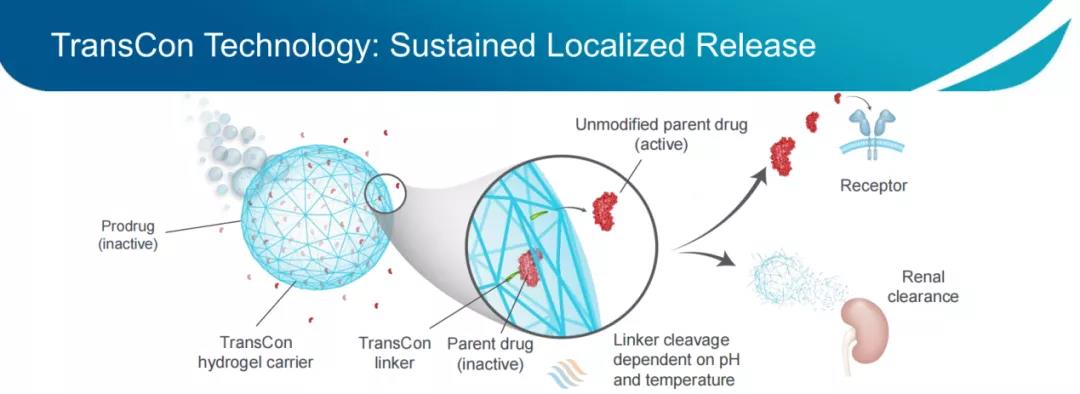
Linker部分的化学性质基于可在非酶促反应中自动水解的自切割linker,其水解反应仅由pH和温度决定,从而实现母体药物可独立于酶活性和组织条件释放,并且可以设定水解速率,以提供最佳的药代动力学性质,提高临床开发成功的可能性。利用专有的Linker文库,公司可根据不同的母体药物以及药物释放条件,来定制Linker;载体部分使用了聚乙二醇(PEG),包括线性PEG、支链PEG、多臂PEG(TransCon PEG)、或TransCon Hydrogel(一种自分解水凝胶)。传统的PEG修饰技术无法实现与TransCon技术相同的控制方式释放药物,因为常规的PEG修饰会使PEG聚合物缠绕在药物周围,形成“笼子”结构,降低药物活性,阻碍药物释放,且高分子PEG修饰使药物难以从血液循环中进入组织,从而需要提高给药浓度来达到相应的效果,这增加了发生副作用的风险,而使用TransCon技术能够有效规避这种情况。
技术优势:
在疗效方面,以可预测的方式实现药物释放,可设计每周一次、每月一次,甚至半年一次的长效制剂;实现持续的全身或局部药物暴露;降低给药频率,以提高患者依从性并改善整体治疗效果;根据所需药代动力学特征量身定制给药剂量与和释放时间,并潜在地优化母体药物的效果。
在安全性与耐受性方面,可基于原型药物的临床特性,预计TransCon前体药物的安全性和免疫原性特征;TransCon局部释放可以通过保持高局部药物浓度,最大限度地减少全身暴露来降低毒性。
在药物开发方面,利用现有研究并经临床验证的原型药物和机制,潜在地提高了药物开发成功率。同时,新的物质专利组合体现出创新性。
战略与愿景
Ascendis Pharma的愿景是开发创新型疗法,为患者生活带来有意义的改变。公司力争成为全球领先的BioPharma,并希望通过多种途径实现可持续增长。Vision 3x3愿景指出了公司的2025年目标。
- 三款内分泌罕见病产品获得监管批准:治疗儿童生长激素缺乏症的TransCon hGH、治疗成人甲状旁腺功能减退症的TransCon PTH、治疗软骨发育不全的TransCon CNP
- 进一步扩大内分泌罕见病管线:开展全球临床研究,推进9项适应症,标签优化并进行生命周期管理,开发内分泌疾病新产品
- 为内分泌罕见病领域建立全球商业存在:在北美和部分欧洲国家建立综合商业组织,在其他地区与当地具有专业知识和基础设施的合作伙伴建立全球商业存在
- 每年通过一项IND申请或类似的申请以推进一个高价值的肿瘤学管线
- 涉足第三个独立的治疗领域以建设多元化研发管线
研发进展
TransCon技术的灵活性为公司的研发工作提供重要支持,公司目前有多款疗法正在开发中,主要涉及内分泌罕见病以及肿瘤,每一款疗法都是独一无二的,且有望成为best-in-class治疗方案。

内分泌罕见病
内分泌罕见病是公司最先涉足的领域,也是TransCon技术最先发挥其潜力的领域——以可预测的方式替代缺乏的激素,同时延长作用时间以潜在地提高治疗效果。该部分管线包含三款产品:TransCon hGH、TransCon PTH和TransCon CNP。
TransCon hGH(lonapegsomatropin-tcgd,隆培促生长素)是一款每周给药一次的生长激素产品,其释放的生长激素与每日给药一次的生长激素相同,包含191个氨基酸。该产品于2021年8月25日获美国FDA批准,用于治疗一岁以上,体重至少11.5公斤,因内源性生长激素分泌不足而导致生长障碍的儿童患者,通用名:隆培促生长素(lonapegsomatropin-tcgd),当地商品名:SKYTROFA®。该产品是FDA批准的首个用于治疗儿童生长激素缺乏症(GHD)的每周一次的生长激素产品(推荐剂量0.24mg/kg),也是首个应用了TransCon技术并获FDA批准的产品,可在室温下保存长达6个月。该产品于2021年10月中旬在美国开始销售。
同时,该产品于2020年9月向欧洲药品管理局(EMA)提交上市许可申请(MAA),并在2021年11月12日获得EMA下属人用医药产品委员会(CHMP)对于TransCon hGH治疗儿童GHD的积极意见,在给出积极意见之后,CHMP预计将在67天内做出最终决定(2022年1月底)。
针对儿童GHD,TransCon hGH开展了多项3期临床试验。heiGHt试验是一项随机、开放标签、阳性对照的3期临床试验,招募了161名以前未接受过治疗的GHD儿童患者(NCT02781727)。fliGHt试验主要评估了TransCon hGH在先前接受每日生长激素治疗的患者中的影响,其中有一个亚组先前未接受过治疗(NCT03305016)。几乎所有完成heiGHt或fliGHt试验的受试者都参加了另一项开放标签研究“enliGHten试验”(NCT03344458),该研究于2017年开启,旨在提供长期安全性数据以支持TransConhGH的监管提交。同时,该产品也开启了在中国的3期试验(CTR20200399),以及在日本的3期riGHt试验(jRCT2031200340)。
针对成人GHD,TransCon hGH开展了一项名为foresiGHt的3期临床试验,该研究旨在比较每周一次Lonapegsomatropin与安慰剂和每日生长激素产品在成人GHD患者中的疗效与安全性(NCT04615273),预计主要终点完成时间为2023年12月。
据估计,2020年全球人生长激素(hGH)市场规模约40亿美元,在美国达到了13亿美元,其中儿童GHD适应症占7亿美元的份额。而这仅仅是针对当前每日一次的生长激素,随着长效生长激素的上市,患者接受治疗的比率、患者接受度、依从性增加,以及治疗时间的延长,将潜在地推动hGH市场规模进一步扩大。TransCon hGH的上市将使公司在这一市场建立重要地位。
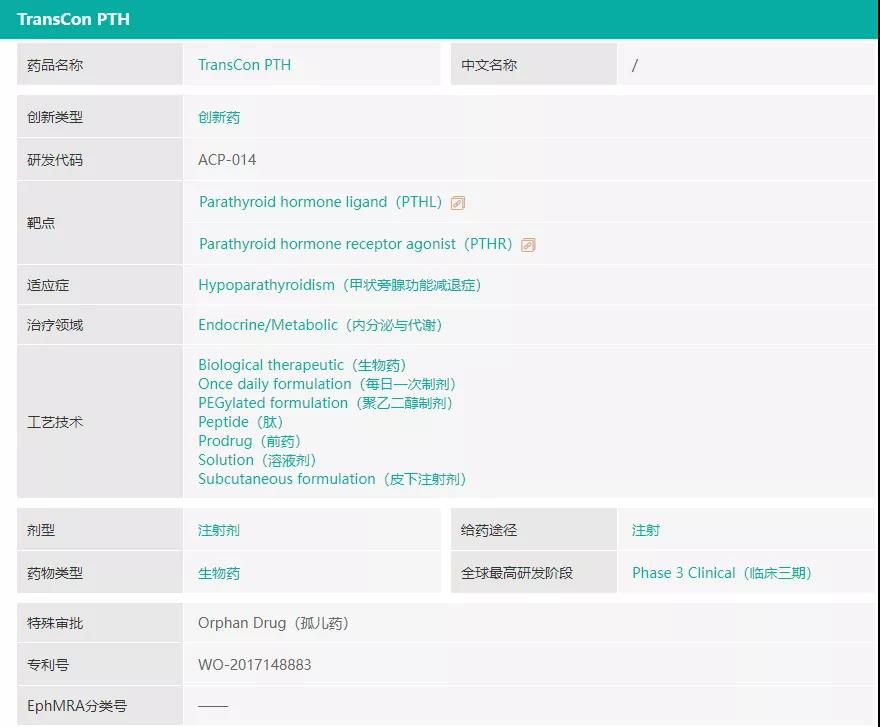
TransCon PTH(palogteriparatide)是一种在研的甲状旁腺激素(PTH)长效前药,正在被开发作为每日一次的甲状旁腺功能减退症(HP)激素替代疗法。HP是一种由于甲状旁腺素(PTH)分泌过少和(或)效应不足而引起一组临床综合征。临床特征为低钙血症、高磷血症和由此引起的神经肌肉兴奋性增高及软组织的异位钙化。据统计,在美国、欧洲、日本和韩国,该病影响了约20万名患者,其中约75%的病例是由甲状腺手术过程中甲状旁腺受损或意外切除后引起,已成为甲状腺、甲状旁腺和头颈外科手术后面临的主要临床问题之一。该病短期症状包括虚弱、严重的肌肉痉挛(手足抽搐)、异常的感觉如刺痛,灼热和麻木(感觉异常症)、记忆力减退、判断力下降和头痛;长期会增加发生重大并发症的风险,例如骨骼外钙沉积在大脑、眼睛晶状体和肾脏中(会导致肾功能受损),同时导致患者生活质量下降。迄今为止,HP仍是少数几种激素缺乏疾病中还不能通过补充缺失的激素来治疗的疾病之一。补充活性维生素D类似物和钙剂的常规治疗不能完全控制疾病,并且可能有导致罹患肾脏疾病的风险。事实上,与健康对照组相比,HP患者并发肾脏疾病风险高达4-8倍。
而TransCon PTH(palogteriparatide)旨在每天24小时提供正常生理浓度的PTH,以同时应对甲旁减的短期症状和长期并发症,有望为HP患者提供真正理想的激素替代治疗方案。该药在美国、欧洲和日本均被认定为治疗HP的孤儿药。
药融云数据www.pharnexcloud.com显示,目前该产品处于3期临床试验阶段,一项名为PaTHway的3期、多中心、随机、双盲、安慰剂对照、平行组试验(包含开放性扩展阶段)旨在研究甲状旁腺功能减退症的成人受试者每日一次皮下注射给予TransCon PTH的安全性、耐受性和疗效(NCT04701203),预计主要终点完成时间为2022年2月。在中国开展的PaTHway China试验的IND已于2021年6月获CDE批准,该试验是中国首项大规模甲旁减疾病队列研究,由维昇药业与北京大学临床研究所共同开展。
来源:药融圈旗下药融云数据库
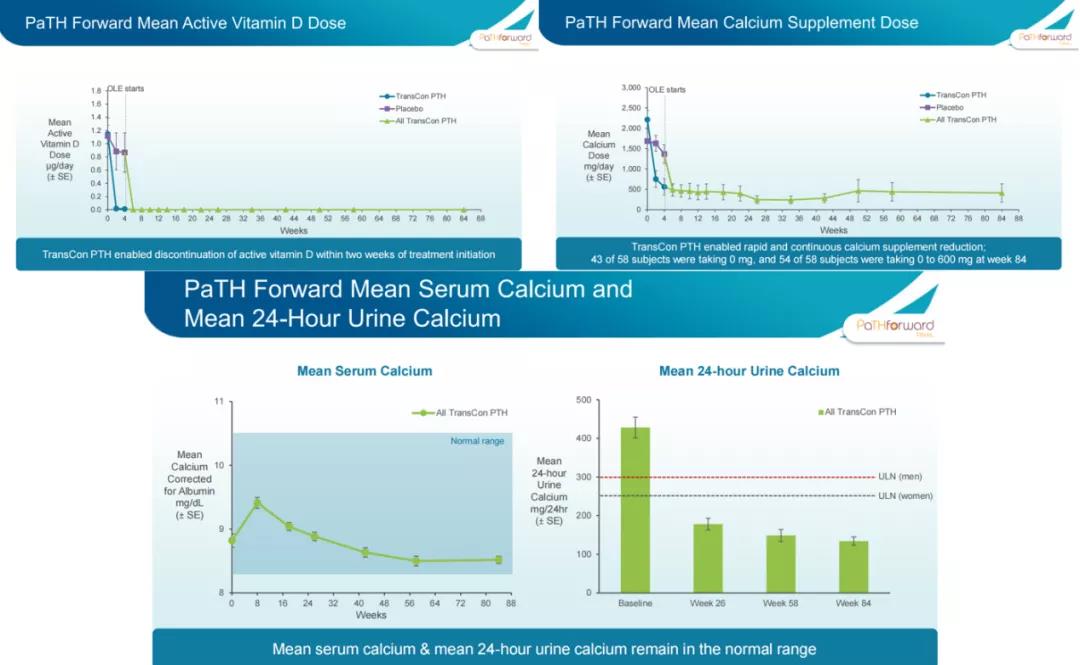
2021年11月18日,Ascendis公布了2期PaTH Forward试验的第84周顶线结果:59名患者中有58名患者继续参与该开放标签试验;患者平均血清钙水平保持稳定并在正常范围内;所有受试者在试验的最初几周内就停止补充活性维生素D,且此后一直停止服用,93%的受试者服用钙补充剂<600mg/天;平均尿钙排泄量保持稳定且在正常范围内;TransCon PTH在所有给药剂量下均显示出良好的耐受性,没有发生治疗相关的严重不良事件,也没有导致停药的治疗相关不良事件(TEAE)发生。公司预计将于2022年第一季度公布3期顶线数据,若数据积极,则计划于2022年第三季度向FDA提交NDA申请,第四季度向欧盟提交MAA申请,用于治疗成人甲状旁腺功能减退症。PaTHway Japan试验的顶线结果预计将于2022年第四季度公布。此外,公司还将在2022年第四季度启动针对小儿甲状旁腺功能减退症的研究。
TransCon CNP(TransConC型利钠肽)是一种在研用于儿童软骨发育不全(ACH)的治疗产品。软骨发育不全是一种常染色体显性遗传疾病,是最常见的侏儒症,由成纤维细胞生长因子受体3(FGFR3)的基因突变引起,导致参与调节骨骼生长的FGFR3和CNP信号通路之间不平衡,估计出生发病率约为1/10000到1/30000,全球约有25万人受到影响。软骨发育不全表现为非匀称性身材矮小合并骨骼发育畸形,婴幼儿期死亡风险高,患者在不同年龄阶段会发生多种严重的骨骼并发症和合并症。C型利钠肽(C-type natriuretic peptide,CNP)被认为是一种有希望的治疗途径,其被证明可以抵消FGFR3突变引起的生长抑制作用并刺激生长。内源性CNP的半衰期仅有2~3分钟,但只有保持长期的药物暴露才能达到理想的治疗效果,因此CNP一直以来是一个难以成药的靶点。

TransCon CNP旨在有效避免内源性CNP的快速降解,最大限度地减少CNP与NPR-C受体的结合以降低清除率,同时减少CNP与NPR-B受体的结合以避免低血压,并在体内释放未修饰的CNP以促进生长,通过一周一次用药,有望持续抑制过度激活的FGFR3受体通路,恢复软骨细胞的正常分化和增生以及全身骨骼的生长发育,同时改善和预防ACH的并发症。TransCon CNP已获FDA以及欧盟委员会的孤儿药认定,治疗软骨发育不全。公司认为TransCon CNP作为单药疗法可能有利于多种生长障碍疾病的治疗,并有潜力与TransCon hGH(lonapegsomatropin-tcgd,隆培促生长素)形成联合疗法。
2019年7月,TransCon CNP开启了一项2期ACcomplisH试验(NCT04085523),旨在评估皮下注射TransConCNP在患有软骨发育不全的儿童(2-10岁)中的安全性和有效性。该产品在国内于2021年1月获批临床,在2021年下半年启动中国II期临床试验(ACcomplisH China),与全球II期临床试验(ACcomplisH)同步进行。目前ACcomplisH试验已完成患者入组(N=57),初步PK数据表明,TransCon CNP可提供连续的药物暴露,半衰期约为110小时,与1期数据相符,耐受性良好,Cmax远低于导致低血压的浓度,随访长达65周。ACcomplisH试验初步盲法数据显示,选择50和100 µg/kg/周作为ACcomplisH China试验的剂量。公司计划在2022年第二季度提交ACcomplisH婴幼儿试验(0~2岁)的IND申请,并预计将在2022年第四季度获得ACcomplisH试验顶线非盲数据。
肿 瘤
在过去的几十年里,开创性的肿瘤学研究加速了人们对癌症生物学和疾病作用机制的理解。新型疗法不断涌现——从免疫疗法到靶向疗法,并已经改变了癌症治疗的现状。2019年1月,Ascendi将肿瘤确立为公司涉足的第二个独立治疗领域。Ascendi的目标是借助TransCon技术,将该领域进一步向前推进,开发出具有更好疗效且不会增加毒性的疗法,潜在地解决当前疗法的局限性,最终帮助改善患者的治疗效果。利用TransCon技术实现药物的全身持续释放以及局部(肿瘤内)释放,可应用于不同类型的靶点与通路,以靶向肿瘤免疫循环的不同方面。
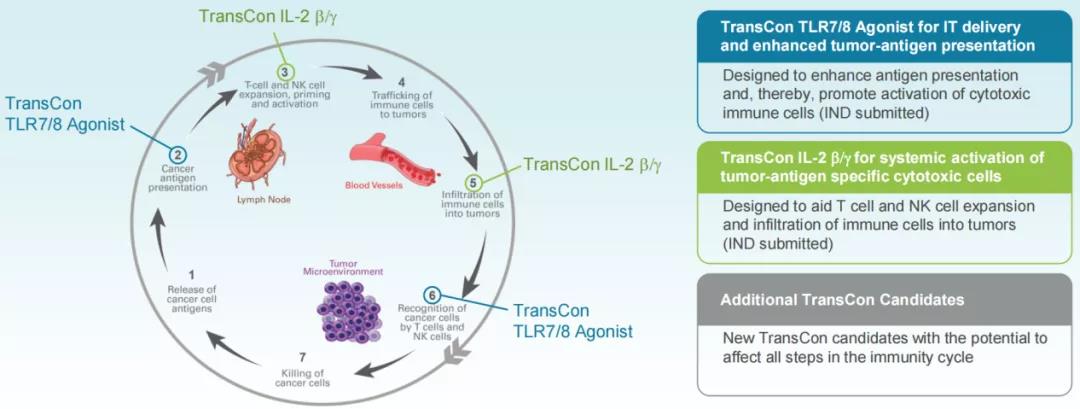
为此,公司特别开发了TransCon IT(TransCon肿瘤内)给药系统,以解决传统的肿瘤内注射问题,实现肿瘤内高药物浓度,减少药物全身暴露。目前该领域有两个候选产品正在推进中。
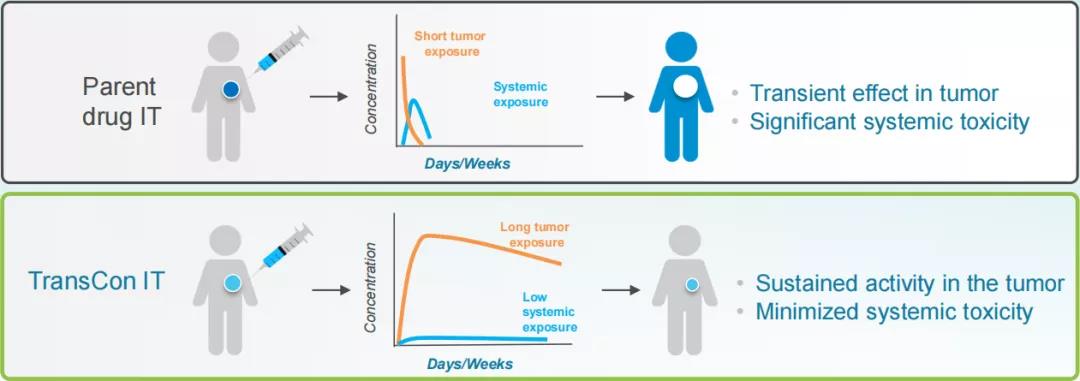
TransCon TLR7/8激动剂被设计用于持续释放Toll样受体激动剂(TLR7/8激动剂)resiquimod,该候选产品用于肿瘤内给药,有望在肿瘤和引流淋巴结中有效激活先天性免疫系统,降低全身毒性风险。药融云数据www.pharnexcloud.com显示,该产品已于2021年3月开启了一项1/2期、开放标签、剂量递增和剂量扩展研究(NCT04799054,transcendIT-101试验),旨在评估TransCon TLR7/8激动剂作为单一疗法或与Pembrolizumab(帕博利珠单抗)联合使用治疗局部晚期或转移性实体瘤的安全性和耐受性,并确定TransConTLR7/8激动剂单独或与帕博利珠单抗联合使用的最大耐受剂量(MTD)和II期临床试验推荐剂量(RP2D)。据披露,该试验将HPV相关肿瘤作为第一适应症。早期试验数据表明,该药在3例疗效可评估的患者中均观察到早期的抗肿瘤活性,PK数据显示活性药物的持续释放,半衰期约为7天,全身暴露量低,安全系数大;在给药后至少7天内观察到肿瘤组织中一致且强大的免疫激活;在目前观察到的安全性可评估人群(n=8)中,TransCon TLR7/8激动剂显示出良好的耐受性。transcendIT-101剂量扩展试验预计将于2022年第二季度开始患者入组。
TransConIL-2 β/γ被设计利用与TransCon hGH相同的linker与载体,持续、高效地释放IL-2变体,该变体可选择性激活IL-2(白细胞介素-2)受体β/γ(IL-2Rβ/γ),与IL-2Rα亲和力较低,可提供有效的抗肿瘤作用,同时降低毒性风险。2021年第三季度,Ascendis已提交TransConIL-2 β/γ的IND申请,计划开展一项1/2期、开放标签、剂量递增和剂量扩展试验(NCT05081609、ILBelieve试验),旨在评估TransConIL-2 β/γ作为单一疗法或与帕博利珠单抗联合使用治疗局部晚期或转移性实体瘤的安全性和耐受性,并确定MTD和RP2D。
财务状况
2021年3月10日,Ascendis公布2020年财务状况,公司2020年净亏损4.19亿欧元,薄摊后每股净亏损8.28欧元,全年总收入695.3万欧元,研发支出为2.609亿欧元,销售、一般及行政开支为7666.9万欧元。截至2020年12月31日,公司的现金、现金等价物和有价证券总计8.341亿欧元,而年初时为5.981亿欧元。

图源:Ascendis Pharma财报
2021年11月10日,Ascendis公布2021年前三季度财务状况,公司2021财年前三季度净亏损1.2176亿欧元,薄摊后每股净亏损5.13欧元,前三季度共收入288.1万欧元,研发支出为2.302亿欧元,销售、一般及行政开支为1.119亿欧元。截至2020年9月30日,公司的现金、现金等价物和有价证券总计9.299亿欧元。
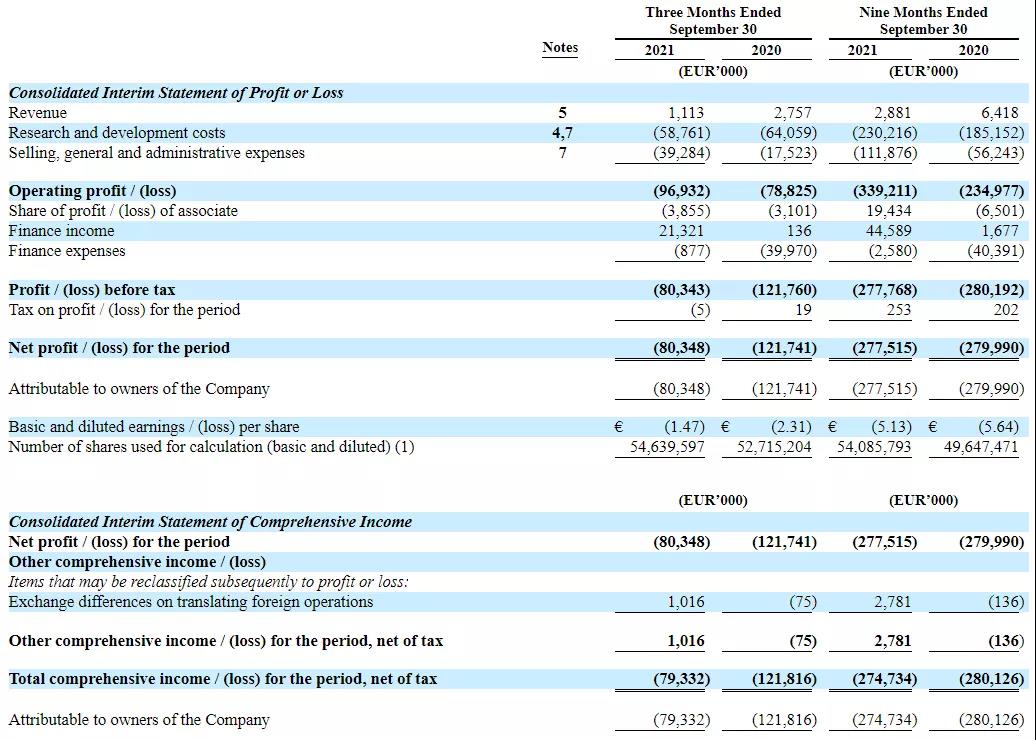
图源:Ascendis Pharma财报
关于维昇药业
2018年,Ascendis Pharma A/S与维梧资本(Vivo Capital)共同创立维昇药业(VISEN Pharmaceuticals),Sofinnova Ventures参与首轮投资。维昇药业获得Ascendis独家授权,将Ascendis旗下的内分泌治疗方案在大中华区开发并推广,授权覆盖中国大陆及港澳台地区。公司CEO为前武田大中华区负责人卢安邦先生。2021年1月,维昇药业完成由红杉中国基金领投,奥博资本、夏尔巴投资、Cormorant、HBM Healthcare Investments、鼎丰生科资本、Logos Capital、晨岭资本跟投的B轮融资。在此之后,Ascendis Pharma持有维昇药业约44%已发行与流通股。

2021年5月,维昇药业宣布与苏州工业园区签署合作备忘录,维昇药业大中华区研发制造基地将落户苏州工业园区,这标志着维昇药业生物新药从临床开发到本地商业化生产落下关键一子,亦将进一步为提高患者对于内分泌药物的可及性提供新动能。
结 语
在许多用药领域,科学家正不断寻求新的长效缓释给药手段,以提高患者依从性与治疗效果。尤其是在儿科用药领域,其中儿童生长激素缺乏症(GHD)的治疗往往需要数年的持续给药。隆培促生长素的获批上市,大大减轻了患者的治疗负担,为GHD患儿及其家庭带来了全新的治疗选择,生长激素行业市场格局或将迎来重排。这也显示出,TransCon技术平台颇具潜力,难怪在Ascendis成立早期,基因泰克、赛诺菲这类巨头就已经与其建立了合作。期待Ascendis后续研发进展,解决更多临床未满足需求。
参考资料:
NMPA/CDE;
药融云数据,www.pharnexcloud.com;
FDA/EMA/PMDA;
相关公司公开披露;
身高焦虑就打“增高针”?危险!丨新华社“新华视点”;
https://ascendispharma.com/;
http://www.visenpharma.com/;
Ranke M B , Wit J M . Growth hormone — past,present and future[J]. Nature Reviews Endocrinology, 2018, 14(5).;
中华医学会骨质疏松和骨矿盐疾病分会,中华医学会内分泌分会代谢性骨病学组.甲状旁腺功能减退症临床诊疗指南[J].中华骨质疏松和骨矿盐疾病杂志.2018; 11(4): 323–37.;
https://investors.ascendispharma.com/news-releases/news-release-details/ascendis-pharma-announces-us-food-and-drug-administration;
https://www.biospace.com/article/releases/ascendis-pharma-a-s-completes-17-6-million-series-a-financing-/;
https://www.gesundheitsindustrie-bw.de/en/article/news/Ascendis-pharma-transient-drug-conjugates;等等。
<END>



















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论