
2025年诺贝尔生理学或医学奖授予了美国科学家玛丽·E·布伦科(Mary E. Brunkow)、弗雷德·拉姆斯德尔(Fred Ramsdell)和日本科学家坂口志文(Shimon Sakaguchi),以表彰他们在调节性T(Treg)细胞发现及其维持外周免疫耐受机制方面的开创性贡献。Treg细胞是免疫系统中的关键调节细胞,通过抑制过度免疫反应维持免疫稳态。在自身免疫病中,Treg细胞数量减少或功能异常会导致免疫耐受破坏,引发炎症;在肿瘤中,Treg细胞常被肿瘤微环境招募,抑制抗肿瘤免疫,促进肿瘤进展。近年来,针对Treg细胞的药物研发成为治疗自身免疫病和肿瘤的重要方向,本文将探讨其研发进展与应用前景。
一、Treg细胞在疾病治疗中的原理
1.1 Treg细胞在自身免疫病治疗中的原理
- 免疫抑制与免疫耐受的维持
Treg细胞通过多种机制抑制自身免疫反应,包括分泌抗炎细胞因子(如IL-10、TGF-β)、消耗IL-2、表达抑制性受体(如CTLA-4)以及直接抑制效应T细胞的激活和增殖。在自身免疫病中,Treg细胞数量减少或功能缺陷会导致免疫耐受破坏,引发炎症和组织损伤。因此,增强Treg细胞的功能或数量可恢复免疫平衡,减轻自身免疫症状。
- 过继性Treg细胞疗法
将体外扩增的Treg细胞回输至患者体内,可直接补充免疫抑制细胞,调节异常的免疫反应。例如,在1型糖尿病、类风湿关节炎等疾病的临床试验中,Treg细胞过继转移显示出一定的疗效,能够降低炎症指标、改善患者症状。
- 低剂量IL-2治疗
IL-2是Treg细胞增殖和存活的关键因子,低剂量IL-2可选择性地扩增Treg细胞,而不激活效应T细胞。通过调节IL-2的剂量和给药方式,可增强Treg细胞的功能,抑制自身免疫反应。
1.2 Treg细胞在肿瘤治疗中的原理
- 肿瘤免疫逃逸的机制
Treg细胞在肿瘤微环境中大量聚集,通过分泌抑制性细胞因子、消耗IL-2、表达CTLA-4等机制,抑制抗肿瘤免疫反应,促进肿瘤细胞的生长和转移。肿瘤细胞可通过分泌趋化因子吸引Treg细胞,或诱导周围免疫细胞转化为Treg细胞,形成免疫抑制微环境。
- 靶向Treg细胞的治疗策略
抑制Treg细胞功能:使用抗CTLA-4抗体、抗PD-1抗体等免疫检查点抑制剂,阻断Treg细胞的抑制信号,恢复抗肿瘤免疫反应。
清除Treg细胞:利用抗体依赖的细胞介导的细胞毒作用(ADCC)或CAR-T技术,特异性清除肿瘤微环境中的Treg细胞,减少免疫抑制。
改造Treg细胞:通过基因编辑技术,将CAR或TCR转导至Treg细胞,使其特异性靶向肿瘤细胞,同时保留免疫抑制功能,实现精准治疗。
二、Treg与IL-2:免疫平衡的“双面调控密码”
免疫系统如同人体的“防御军团”,而调节性T细胞(Treg)和白细胞介素-2(IL-2)则是其中的关键“指挥官”与“信号兵”,它们通过精准调控免疫信号,维持着免疫平衡。以下是关于Treg与IL-2在免疫信号精准调控中的核心要点:
2.1 Treg:免疫系统的“刹车手”
Treg细胞是免疫系统中的“和平使者”,负责抑制过度的免疫反应,防止免疫系统攻击自身组织。它们通过分泌抑制性细胞因子(如IL-10、TGF-β)或直接接触效应T细胞,抑制其增殖和活性。在自身免疫性疾病(如类风湿关节炎、系统性红斑狼疮)中,Treg功能异常会导致免疫耐受破坏,引发炎症。
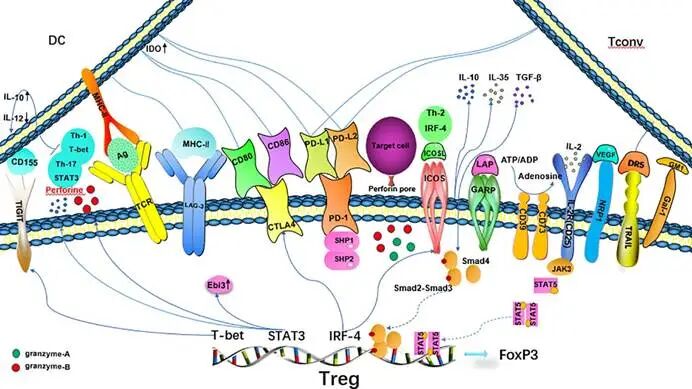
图1. Treg在风湿关节炎中的抑制机制分子示意图
2.2 IL-2:免疫信号的“双面调控者”
IL-2是一种由活化T细胞分泌的细胞因子,具有双重活性。它既能促进效应T细胞和自然杀伤细胞(NK细胞)的增殖与活化,增强抗肿瘤和抗感染免疫;又能通过高亲和力受体(IL-2Rαβγ)选择性激活Treg细胞,维持免疫耐受。IL-2受体的复杂结构(由α、β、γ链组成)决定了其与不同细胞的亲和力差异,为精准调控提供了基础。
2.3 IL-2对Treg的精准激活
低剂量IL-2可优先结合Treg细胞表面的高亲和力IL-2Rαβγ受体,促进Treg的增殖和功能。这一特性使其成为治疗自身免疫性疾病的重要策略。例如,北大人民医院团队证实低剂量IL-2对系统性红斑狼疮患者安全有效,能改善临床症状和免疫指标。
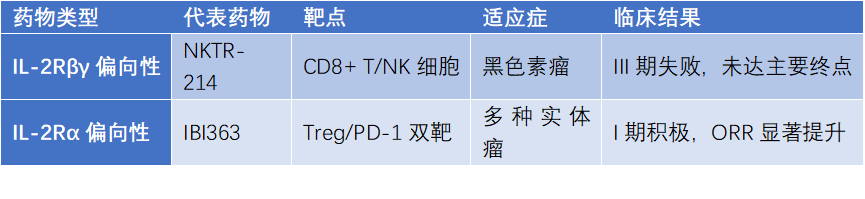
2.4 偏向性IL-2药物的研发
为减少IL-2的全身毒性,科学家开发了偏向性IL-2药物。如IL-2Rα偏向性药物,通过降低对IL-2Rβγ的亲和力,增强对Treg的选择性激活;IL-2Rβγ偏向性药物则侧重于激活效应T细胞和NK细胞,用于肿瘤治疗。但临床试验显示,部分偏向性药物效果未达预期,提示精准调控仍面临挑战。
表1. IL-2偏向性药物对比
2.5 Treg与IL-2在肿瘤免疫中的“双重角色”
在肿瘤微环境中,Treg细胞常被肿瘤细胞招募,抑制抗肿瘤免疫反应。因此,清除Treg(如通过靶向CCR8、CTLA-4等)或抑制其功能,可增强免疫治疗效果。然而,Treg在维持免疫稳态中不可或缺,过度清除可能导致免疫紊乱。因此,精准调控Treg与IL-2信号,需在抗肿瘤与免疫耐受之间寻找平衡。
三、破局irAE:新一代CTLA-4抗体如何实现肿瘤Treg的精准靶向?
近年来,免疫治疗领域迎来重大突破,CTLA-4抗体的研发从最初的“广谱抑制”迈向“精准清除”,为肿瘤治疗带来新希望。
3.1 CTLA-4抗体的早期挑战
CTLA-4抗体作为肿瘤免疫治疗的先驱,以伊匹木单抗为代表,虽能激活T细胞抗肿瘤,但因无法区分肿瘤微环境与正常组织中的Treg细胞,导致严重免疫相关不良事件(irAE),限制了其应用。
3.2 精准清除Treg细胞的新策略
新一代CTLA-4抗体通过技术革新实现精准清除肿瘤微环境中的Treg细胞。例如,和铂医药的 HBM4003 通过修饰Fc段增强ADCC活性,特异性剔除高表达CTLA-4的Treg细胞;清华大学团队研发的ProCTLA-4前药抗体,利用肿瘤微环境中的蛋白酶切割激活,降低外周毒性,增强瘤内Treg清除能力。
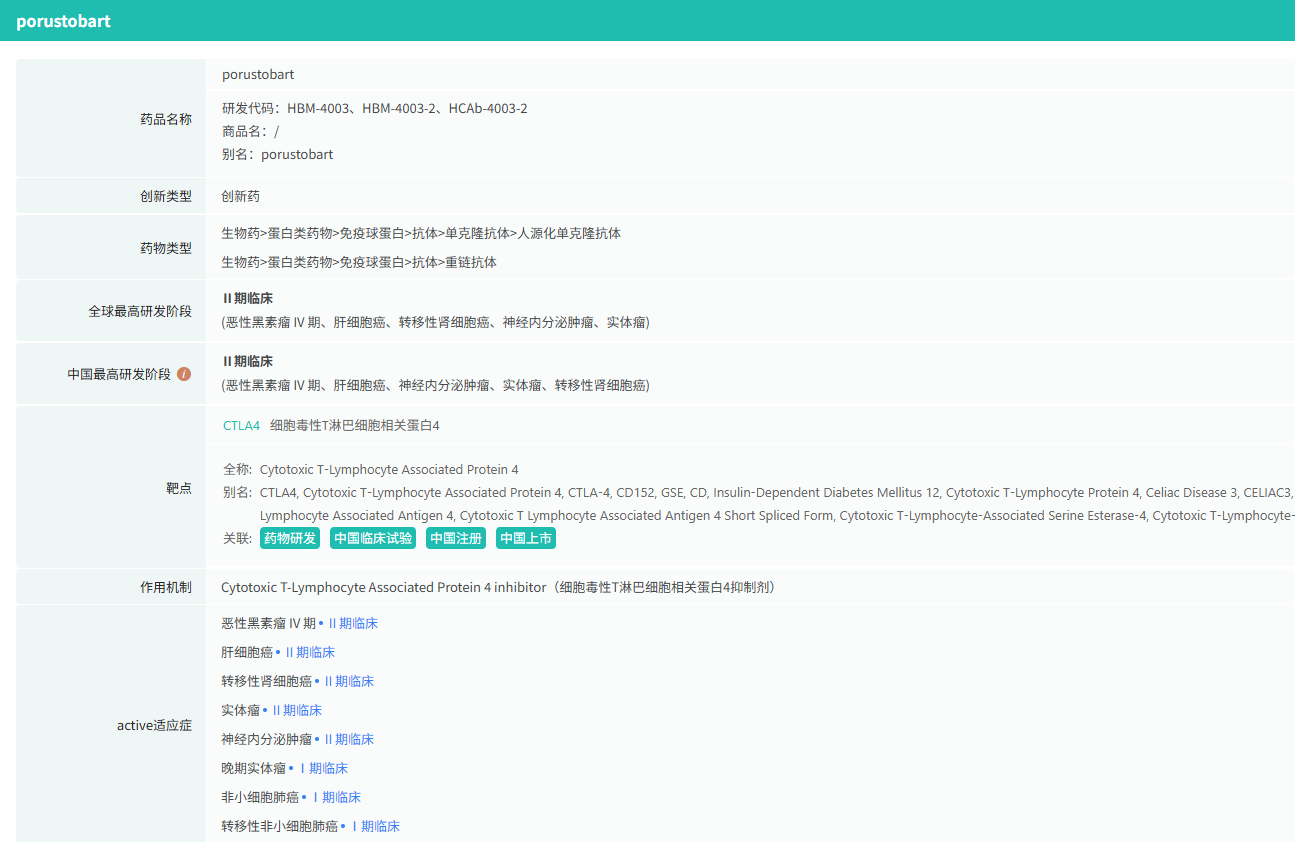
截图来源:摩熵医药数据库-全球药物研发数据库
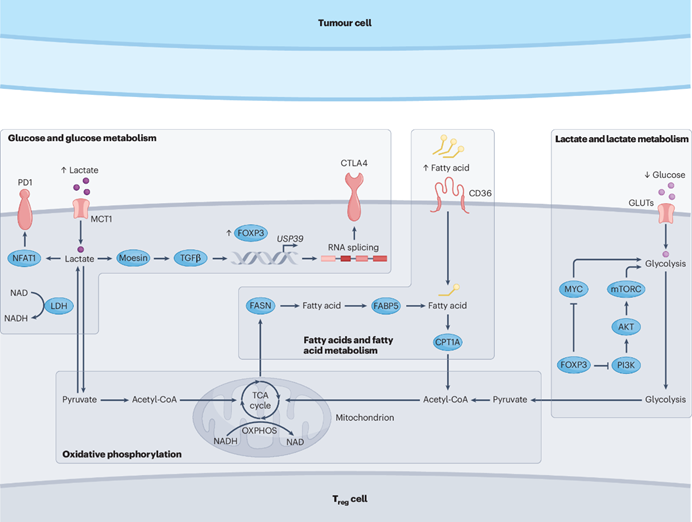
图2. 肿瘤浸润调节性T细胞的代谢重编程与适应性调控
3.3 靶向Treg细胞的协同效应
部分药物如Onc-392,通过pH敏感设计,避免CTLA-4在溶酶体降解,减少自免反应,同时增强ADCC效应清除肿瘤Treg细胞。临床数据显示,这类药物在黑色素瘤、肺癌等实体瘤中展现显著疗效,且安全性优于传统CTLA-4抗体。
表2. CTLA-4抗体迭代对比

四、靶向CCR8:从特异性标记到精准清除肿瘤Treg的临床新策略
CCR8是肿瘤浸润Treg细胞的高度特异性标志物,与配体CCL1相互作用参与Treg细胞招募和转化,标识具有强抑制功能的活化Treg细胞亚群,表明其可作为治疗靶点。近年来,肿瘤免疫治疗领域不断探索新的靶点和策略,CCR8作为一种新兴的肿瘤相关Treg细胞特异性标记物,正受到广泛关注。
4.1 Treg细胞在肿瘤中的作用
Treg细胞是肿瘤微环境中抑制抗肿瘤免疫、促进肿瘤进展的关键免疫细胞。它们通过多种机制抑制效应T细胞的功能,导致免疫逃逸和肿瘤生长。然而,传统靶向Treg细胞的治疗方法往往存在脱靶毒性,限制了临床应用。
4.2 CCR8:肿瘤Treg细胞的特异性标记
CCR8是一种趋化因子受体,在肿瘤浸润的Treg细胞中高度表达,而在外周血和正常组织中的Treg细胞中表达较低。研究表明,CCR8主要富集于效应Treg细胞(ETreg),这些细胞具有更强的免疫抑制功能。例如,在乳腺癌、结直肠癌、非小细胞肺癌等多种癌症中,高达80%的肿瘤浸润CD4+Foxp3+T细胞表达CCR8。
4.3 CCR8的功能与调控
CCR8与其配体(如CCL1)相互作用,参与Treg细胞的迁移、存活和功能调节。CCL1-CCR8信号通路可诱导Treg细胞分泌免疫抑制分子(如IL-10、CD39),增强其免疫抑制能力。此外,CCR8的表达受转录因子(如GATA3、IRF4)和细胞因子(如TNF-α)的调控。
4.4 CCR8作为治疗靶点的潜力
靶向CCR8的药物(如抗CCR8单克隆抗体、CCR8拮抗剂)可选择性清除肿瘤浸润的CCR8+Treg细胞,同时对正常组织中的Treg细胞影响较小。临床前研究表明,抗CCR8药物能缓解CD8+T细胞耗竭、促进肿瘤特异性记忆T细胞产生,并与抗PD-1等免疫检查点疗法具有协同作用。目前,多种抗CCR8药物已进入临床试验阶段,初步结果显示其安全性和抗肿瘤活性良好。
尽管CCR8靶向治疗展现出巨大潜力,但仍需进一步研究其在不同癌症类型中的特异性、长期疗效和安全性。此外,联合治疗策略(如CCR8抑制剂与化疗、PARP抑制剂等)可能进一步提高治疗效果。
五、从自身免疫到器官移植:工程化Treg如何重塑免疫治疗新格局?
当前,免疫系统失衡是许多疾病的根源,而Treg作为免疫系统的“刹车”,在维持免疫稳态中起着关键作用。近年来,工程化Treg疗法成为免疫治疗领域的热点,为多种疾病带来了新的希望。
5.1 工程化Treg的核心策略
抗原特异性改造:通过嵌合抗原受体(CAR)或T细胞受体(TCR)工程化,使Treg能精准识别特定抗原,如移植器官的HLA抗原或肿瘤相关抗原,实现靶向调控。例如,CAR-Treg可定向迁移至病变组织,抑制局部免疫反应。
细胞因子工程:增强Treg分泌抗炎细胞因子(如IL-10、TGF-β)的能力,或使其表达显性负性受体,中和促炎因子,强化抗炎与组织修复功能。
稳定性优化:通过过表达Foxp3、调控代谢通路或整合安全开关,确保工程化Treg在体内长期稳定发挥功能,避免分化或失活。
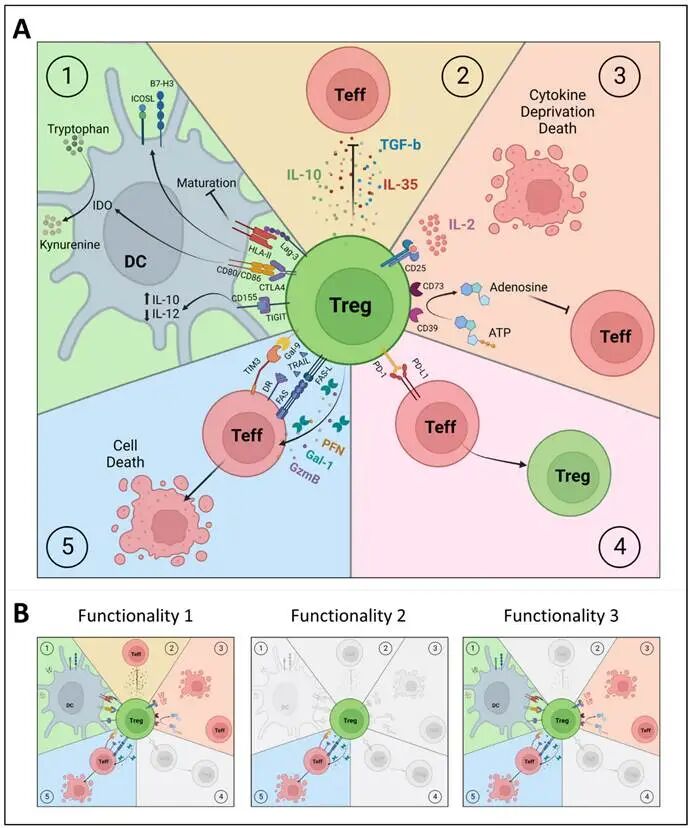
图3. 多克隆与克隆性Treg亚群的功能分析
5.2 临床应用方向
自身免疫病:在1型糖尿病、类风湿关节炎、系统性红斑狼疮等疾病中,工程化Treg可补充或激活体内功能缺陷的Treg,重建免疫耐受,保护自身组织免受免疫攻击。例如,低剂量IL-2联合Treg疗法已在部分自身免疫病中显示出疗效。
器官移植:供体特异性Treg(DS-Treg)或通用型Treg产品,可抑制移植排斥反应,减少免疫抑制剂使用,提高移植成功率。CAR-Treg技术还能实现对移植器官的精准免疫调控。
肿瘤治疗:一方面,通过清除肿瘤微环境中的Treg,解除免疫抑制,增强免疫检查点抑制剂的疗效;另一方面,工程化Treg可被设计为“肿瘤靶向型免疫调节剂”,在抑制肿瘤的同时避免全身免疫毒性。
5.3 未来挑战与展望
技术优化:需进一步提高工程化Treg的生产效率、稳定性和安全性,解决细胞归巢、持久性等问题。
个体化治疗:结合单细胞测序、空间组学等技术,实现对患者免疫状态的精准评估,制定个性化的Treg疗法。
监管与转化:建立标准化的非临床研究体系和监管路径,加速工程化Treg疗法从临床试验向广泛应用的转化。
总结
总的来说,Treg细胞靶向治疗正引领免疫疾病与肿瘤治疗的范式变革。从低剂量IL-2的精准调控、CTLA-4抗体的迭代升级,到CCR8特异性靶点的发现及工程化Treg疗法的突破,研究实现了从“广谱抑制”到“靶向清除/修复”的跨越。这些策略在自身免疫病中重建免疫耐受,在肿瘤中逆转免疫逃逸,显著提升疗效与安全性。未来,随着技术优化与联合治疗的深化,Treg细胞调控有望成为平衡免疫稳态的核心支点,为患者带来更精准、高效的治疗选择,重塑疾病治疗版图。
参考文献:
[1] Imianowski CJ, Chen Q, Workman CJ, Vignali DAA. Regulatory T cells in the tumour microenvironment. Nat Rev Cancer. 2025 Sep;25(9):703-722. doi: 10.1038/s41568-025-00832-9.
[2] Jiang Q, Yang G, Liu Q, Wang S, Cui D. Function and Role of Regulatory T Cells in Rheumatoid Arthritis. Front Immunol. 2021 Apr 1;12:626193. doi: 10.3389/fimmu.2021.626193.
[3] Gootjes C, Zwaginga JJ, Roep BO, Nikolic T. Defining Human Regulatory T Cells beyond FOXP3: The Need to Combine Phenotype with Function. Cells. 2024 May 30;13(11):941. doi: 10.3390/cells13110941.
扩展阅读:
1. 亏损5600万美元!再生元Treg细胞疗法投资将影响Q1利润
2. Treg细胞免疫治疗新锐A轮融资3500万英镑 主攻免疫疾病领域
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论