
2025年7月1日,Oncternal Therapeutics宣布将其zilovertamab和ONCT-808 项目出售给Ho'ola Therapeutics,这标志着该公司发展轨迹的重大转变。虽然该协议包括潜在高达6500万美元的里程碑付款,但将解散专家Craig Jalbert过渡为唯一执行官和董事会成员清楚地表明这是一个清算过程,而不是战略支点。

一、交易明细
该交易包括300万美元的预付款,其中225万美元立即支付,其余75万美元需待第三方债务解决后支付。与典型的生物技术收购相比,这笔预付款明显较少,这表明这些临床阶段资产的感知价值或谈判筹码有限。
该协议还包含高达6500万美元的潜在里程碑付款,其中:500万美元用于开发里程碑付款;4000万美元用于监管审批;以及2000万美元的销售里程碑付款(达到特定净销售额门槛后)。这些里程碑付款与美国、英国、德国、西班牙、法国、意大利和日本等主要市场的业绩挂钩。
然而这一切都取决于Ho'ola是否愿意在主要市场推进这些项目。对于股东而言,未来价值完全取决于Ho'ola的开发决策、监管结果和商业成功—无法保证任何里程碑一定会实现。
资产出售于2025年6月27日完成后,Oncternal宣布任命Craig R. Jalbert为总裁、首席执行官、财务主管、秘书及唯一董事会成员,其他所有董事和员工均已辞职。Jalbert将负责监督公司的清盘运作,并管理剩余现金的未来分配和里程碑付款。
二、三大核心项目全数折戟
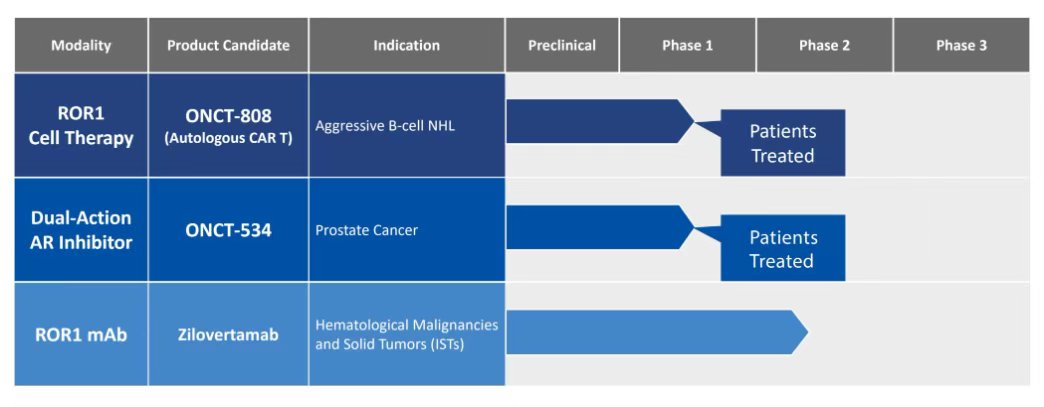
Zilovertamab (曾用名UC-961 或 cirmtuzumab) 是 Oncternal Therapeutics 研发的一种人源化单克隆抗体(mAb),对 ROR1 的细胞外表位具有高亲和力和特异性,设计目的是抑制 ROR1 的功能。
该药物已进入3期临床试验,但由于商业格局发生变化,2023年4月,Oncternal取消了Zilovertamab的优先级,关闭两项评估其单抗zilovertamab与伊布替尼联合使用的研究:包括一项旨在治疗复发或难治性套细胞淋巴瘤(MCL)的全球III期试验,以及一项针对MCL、慢性淋巴细胞白血病(CLL)或边缘区淋巴瘤患者的I/II期试验。从而将预期的现金跑道延长至2025年。预计的现金通道将支持ONCT-808和ONCT-534的临床进展。
自此,Oncternal也正式踏上通往生物科技“坟墓”的列车。
Oncternal公司的ONCT-808曾是首个公布临床数据的ROR1 CAR-T,也是全球进度最快的ROR1 CAR-T项目之一。被开发用于治疗复发/难治性(R/R)侵袭性B细胞恶性肿瘤。2023年12月,Oncternal报告了ONCT-808临床发生死亡案例,并且还预期ONCT-808治疗会发生不良事件,公司停止了ONCT-808的临床开发。
与此同时,Ho'ola Therapeutics似乎对接手Oncternal的第三个临床项目ONCT-534不感兴趣。该药物在针对转移性去势抵抗性前列腺癌(mCRPC)的I期临床试验(NCT05917470)中失败,1期试验中期数据显示,20名患者中未观察到显著疗效,最高剂量组更出现剂量限制性毒性(3例中2例发生严重不良反应),迫使公司于2024年9月终止该管线研发。
至此,Oncternal的三大核心项目全数折戟。该公司已于2024年9月关闭所有临床试验,并裁员37%。当时,公司股价暴跌60%,并于2025年3月自愿从纳斯达克退市。
总结
目前,从ROR1靶点全球研发进度来看,默沙东通过27.5亿美元收购VelosBio获得的Zilovertamab Vedotin目前进展最快,处于III期临床(NCT05809266),针对DLBCL一线治疗,II期数据显示1.75 mg/kg剂量组CR率达100%。
基石药业与韩国LegoChem合作开发的ROR1 ADC药物CS5001处于全球前二的位置,ASH数据显示,它在霍奇金淋巴瘤(HL)以及非霍奇金淋巴瘤(NHL)中,甚至在某些惰性的B细胞NHL中(MZL、FL等), 均展现出“搅局”的能力:治疗潜力突出,且安全性良好。
石药集团的SYS6005是首个授权出海的国产ROR1 ADC,2025年2月,石药以12.4亿美元将其欧美权益授权给Radiance Biopharma。目前SYS6005处于I期临床,针对血液瘤和实体瘤的疗效数据尚未公布,其市场潜力被广泛看好。
华东医药的HDM2005中国和美国的临床试验于2024年6月分别获得国家药品监督管理局和美国FDA批准,适应症为晚期恶性肿瘤。中国临床试验首例受试者入组于2024年8月完成,Ⅰ期爬坡实验预计2025年Q3完成。这是其首款自主研发的ROR1 ADC,采用专有的连接子和毒素设计,临床前数据显示其在多种实体瘤和血液瘤模型中具有良好抗肿瘤活性和安全性。
2025年3月,博锐生物申报的“注射用BR111”获批临床试验默示许可,拟用于治疗晚期恶性肿瘤。BR111是其在研的一款靶向ROR1双表位的ADC药物,临床前研究中,。BR111在多种动物模型中展示出优异的体内抗肿瘤药效,并具有更好的安全性。
同月,正大天晴TQB2101首次获得国家药品监督管理局(NMPA)的临床试验默示许可,拟用于治疗晚期恶性肿瘤。临床前研究数据显示,TQB2101在多种ROR1阳性肿瘤模型中展现出抗肿瘤活性,且具有良好的安全性特征。此次获批的I期临床试验将重点评估其在人体内的安全性、耐受性、药代动力学特性及初步疗效。
想要解锁更多药企信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论