
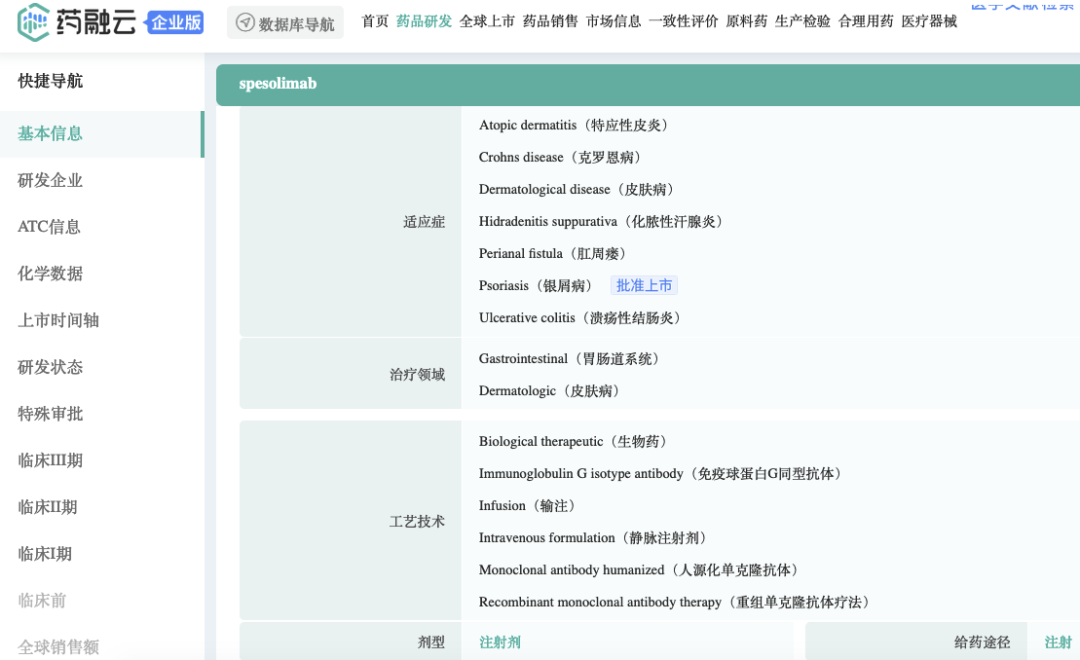
关于泛发性脓疱型银屑病 (GPP)
GPP是一种罕见的、异质性的、可危及生命的嗜中性粒细胞性皮肤病,临床上与斑块状银屑病不同。GPP是由中性粒细胞(一种白细胞)在皮肤中积聚引起的,会在全身广泛爆发疼痛性的无菌性脓疱。GPP患者的临床病程各不相同,有些患者的疾病复发并伴有反复发作,而另一些患者的疾病持续存在且间歇性发作。虽然GPP发作的严重程度各不相同,但若不及时治疗,会出现败血症和多系统器官衰竭等并发症,可能会危及生命。这种慢性全身性疾病会对患者的生活质量产生重大影响,并增加医疗负担。对于能够快速解决GPP发作症状并能预防复发,且具有可接受的安全性的疗法存在着高度未满足的需求。
GPP的发作可导致住院并可能发生严重并发症,包括心力衰竭、肾衰竭和败血症,而疾病发作的不可预测性和严重程度极大地影响了患者的生活质量。
据统计,在中国每100,000人中仅有1~2人患GPP。在国内,也有相关组织“GPP信息平台”成立,致力于该罕见疾病的相关科普等。
关于佩索利单抗
佩索利单抗(Spesolimab)是一款新型人源化选择性抗体,可阻断白介素 -36 受体 (IL-36R) 的激活。IL-36通路是免疫系统内的一种信号通路,已被证明与GPP等多种自身炎症性疾病的发病机制有关。
佩索利单抗是首个专门靶向IL-36抗体,治疗GPP发作的在研疗法,已在一项随机、安慰剂对照试验中获得了具有统计学意义的结果。目前,佩索利单抗还在被开发用于预防GPP发作以及治疗其他嗜中性粒细胞性皮肤病。
据药融云数据库查询显示,Spesolimab由勃林格殷格翰(BI,Boehringer Ingelheim)开发,相关专利:WO-2013074569。
截图来源:药融云全球药物研发数据库
值得一提的是,佩索利单抗获得中国国家药品监督管理局突破性治疗药物认定和优先审评审批资格,且与全球同步研发、同步注册、同步获批(仅晚于美国获批三个月)。
该IL-36抗体的获批是基于其全球关键性EffisayilTM 1 II期临床研究。该研究是全球首项针对GPP发作患者进行的国际多中心、双盲、随机对照研究,覆盖了全球12个国家/地区,包括中国。研究表明:54.3%的患者经佩索利单抗治疗1周便达到皮肤无可见脓疱;42.9%的患者佩索利单抗治疗1周可达到皮肤症状清除或几乎清除。同时在整个研究中,佩索利单抗的安全性数据是可接受的,患者常见的不良事件包括发热和轻度至中度感染。
关于IL-36抗体
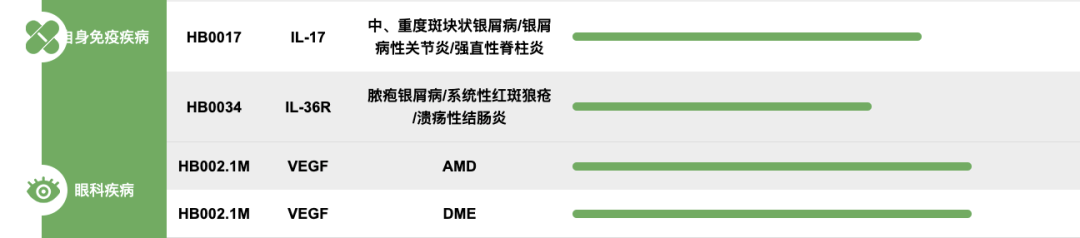
药融云数据,vip.pharnexcloud.com/?zmt-mhwz显示:全球布局IL-36抗体并不多,除了勃林格殷格翰的Spesolimab外,就属AnaptysBio Inc.的Imsidolimab进展最快,全球最高状态处于临床三期,在中国已申请临床:2022年6月22日,我国CDE/药审中心承办了AnaptysBio Inc.1类生物制品Imsidolimab注射液的临床试验申请。9月获准开展临床试验。

国内在开发IL-36抗体靠前的企业有,华海药业/华奥泰/华博生物的HB0034,相关专利WO-2022127842。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据:vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露;
www.boehringer-ingelheim.com;
Bachelez H et al. Trial of Spesolimab for Generalized Pustular Psoriasis. NEJM. 2021;385:2431-40;
AnaptysBio;
https://www.huaota.com/;
《我国泛发性脓疱型银屑病的患病率和疾病负担调查:一项基于全国2012-2016年城镇医疗保险数据的估算》,中华医学会第二十七次全国皮肤性病学学术年会,2021年6月;等等。
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论