
·原料药生产有哪些特点?
同制剂生产纯粹的物理过程,无“内置净化”不同,清洁后残留保存在设备表面,在下一个生产循环中,最差情况是这些残留100%的被带入下一产品的第一个批次中。
原料药生产存在“内置净化”步骤,通常包含多步化学合成、发酵、提取、纯化(如结晶、蒸馏、色谱分离)等步骤。清洁后设备表面的残留物,在下一产品生产时,会进入一个复杂的化学反应体系或生化纯化体系中,除最后阶段,用于干燥、混合、粉碎、包装等纯物理操作的设备(例如干燥器、混合机、粉碎机)外,几乎不可能100%被带入下一产品的第一个批次中。
净化机制通常包括:
稀释与转化
残留物在大量的溶剂和原料中被高度稀释,并可能参与后续的化学反应而被转化或降解。
物理去除
在纯化步骤(如结晶、过滤)中,残留物很可能因其物理化学性质(如溶解度)与目标产品不同,而被作为杂质有选择性地去除,不会进入最终的精制API中。
正如APIC-《原料药工厂中清洁验证指南》所言,“残留在设备里的东西,在下一生产循环中,会被带入溶剂和原料所组成的混合反应液中。在大多数情况下,所有溶液中的残留都会与溶剂一起被从工艺中去除,不溶性残留会被物理分离工艺(例如过滤)减少,因此,可能被带到最终产品中的残留会很低。”
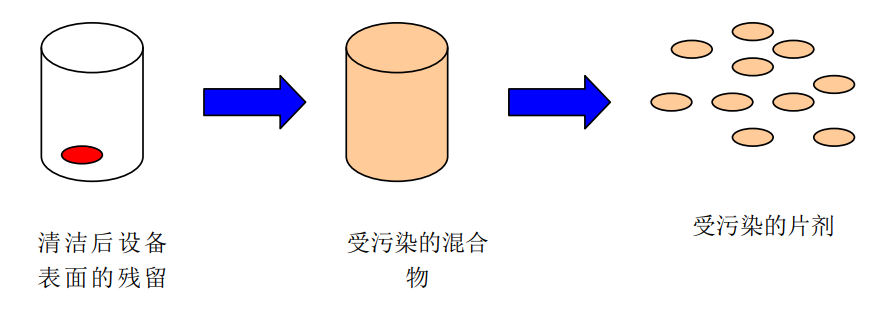
图1 制剂生产过程残留物转移示意图
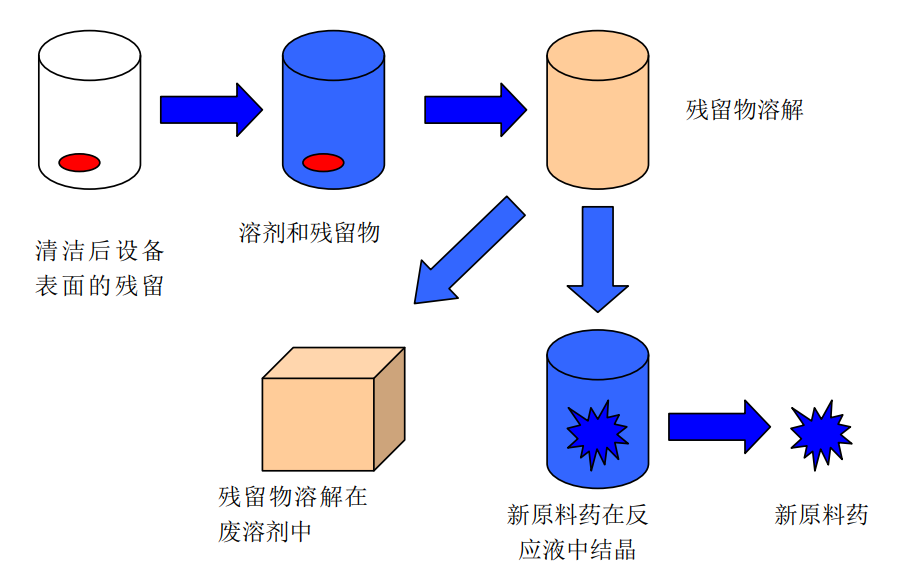
图1 原料药理化生产过程残留物转移示意图
·原料药与制剂生产设备清洁风险的异同
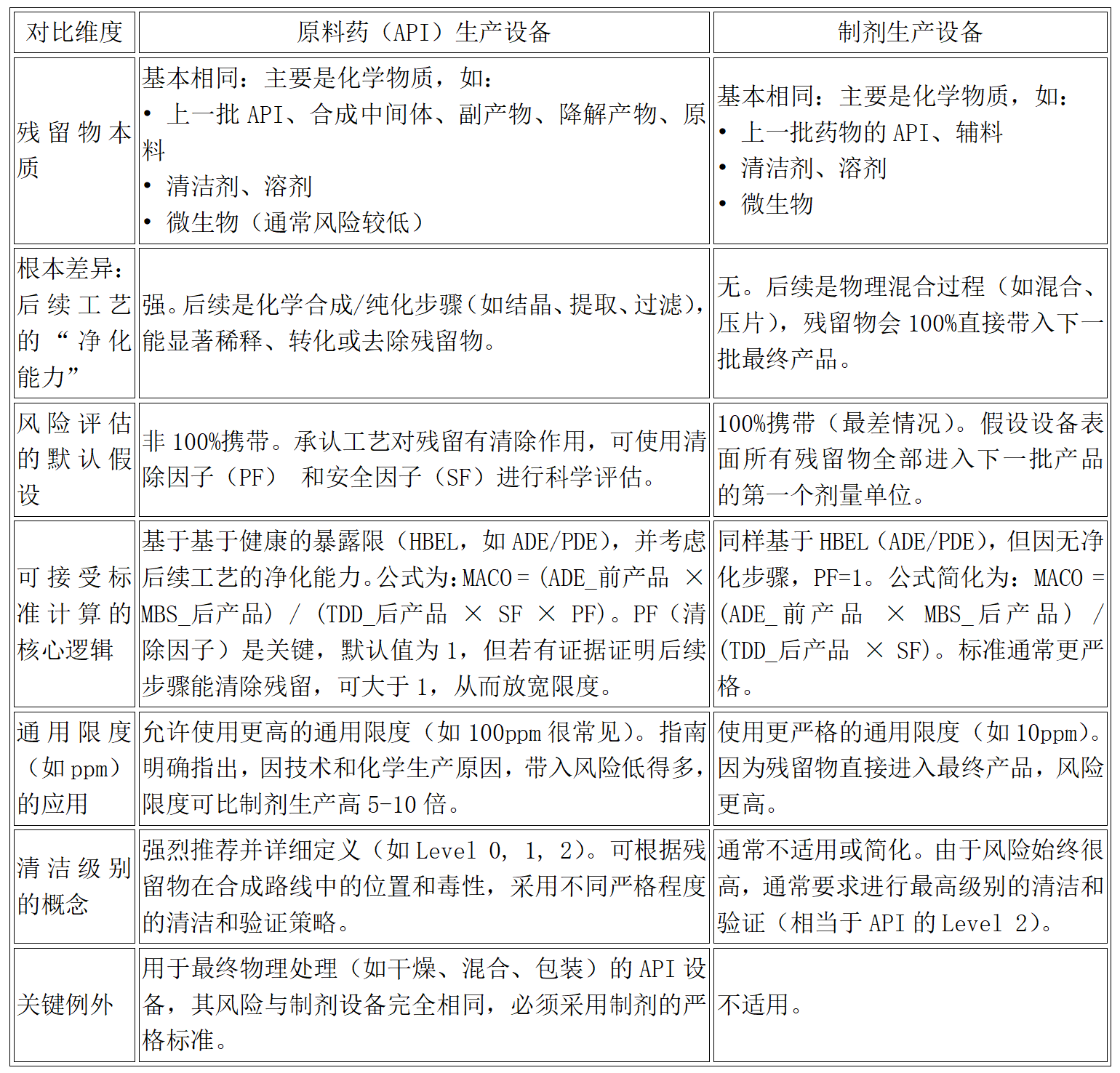
鉴于原料药生产特点,其设备清洁风险的评估、可接受标准的设定方法以及验证策略与制剂明显不同。
表1原料药与制剂生产设备清洁残留风险异同
·原料药生产,哪些设备不用清洁验证?
APIC-《原料药工厂中清洁验证指南》推荐将清洁验证风险级别至少分为3个清洁水平,如下:

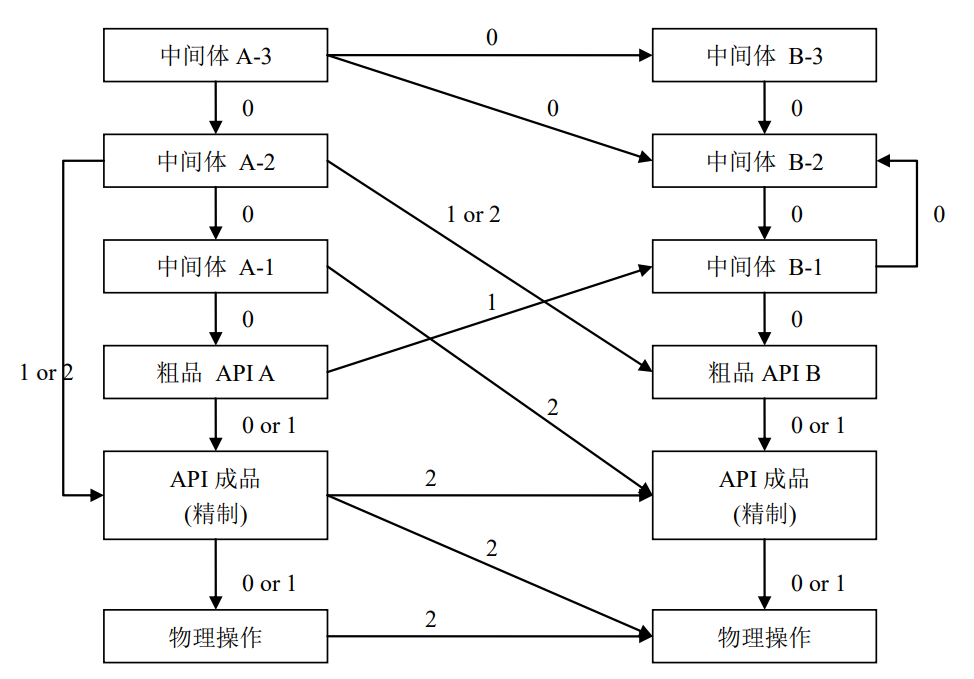
其中,下一产品是合成链中的下一步骤,因为上一产品是后续生产步骤的起始物料,后续产品所使用的分析方法一般适用于检测上一产品,上一产品实际上包括在杂质谱中,并设定了限度,通常将级别设置为0。
同一合成链不同步骤之间,如果序列中的后续产品接近于原料药成品步骤,则对原料药产生的潜在污染水平会比较高。因此,从合成路线中较早步骤到较后步骤,其预期水平如图3所示。在例中,生产完“A-2”后,再生产“原料药成品A”,如果“A-2”在“原料药成品A”质量标准中并未作为杂质列明,或者“A-2”为毒性物质,则可以选择水平为2级。如果“A-2”作为杂质列明,或在工艺中被清除,或该物质对人体无害,则选择水平为1级。
不同产品线批间清洁,所要求的清洁水平取决于生产的步骤。如果后续产品在原料药工艺路线中为较早的步骤,一般来说相对于中间或最终步骤来说其要求水平更低。风险评估应说明以下情况:
- 清洁难易程度
- 上一产品的毒性/药物活性,其副产物和降解产物
- 下一产品的最大日剂量
- 微生物滋长
- 下一产品的批量
- 溶解度、经验、上一产品清除难度
- 化学相互反应
- 生产周期的长度
图3 典型的更换品种清洁级别分类
·总结
原料药生产设备清洁验证核心原则包括:
风险导向:是否验证取决于风险评估,需考虑残留物的毒性、溶解度、后续工艺的去除能力等因素。
清洁级别划分:根据产品更换场景选择清洁级别(Level 0/1/2),仅Level 2强制要求验证,Level 1推荐验证,Level 0无需验证。
原料药生化生产过程“内置净化”功能,设备清洁残留风险通常较低。设备清洁验证主要关注多用途设备和高风险清洁级别(Level 2)对应的设备,如物理操作设备(如干燥、混合)。
专用设备通常无需清洁验证,但需通过风险评估确认无降解或微生物污染风险。
低风险清洁级别(Level 0)对应的设备通常仅需“粗清洁”,目视检查即可,无需分析验证。
文章来源:蒲公英Ouryao






















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论