2015年12月1日,正式实施了《中国药典》2015年版。这个版本的药典对药品品种的收载和修订进行了进一步扩大,共收录了5608种品种。其中,一部收录了2598种品种,二部收录了2603种品种,三部收录了137种品种。此外,该版本还首次将2010版药典的附录整合为通则,并将药用辅料单独成卷作为四部。《中国药典》2015年版的实施标志着我国用药、制药以及监管水平的全面提升,将推动药品质量的整体提高,对于保障公众用药的安全和有效性具有重要意义。
在化药研发工作中,各个部门如分析、制剂、合成、项目管理、注册、临床、QC、QA等都经常使用《中国药典》。其中,二部和四部是化学药研发中使用最频繁的部分。为了有效地利用这两部药典,作者结合实际工作经验和文献报道,选取了具有代表性的题目,对于在化药研发中如何有效使用这两部药典进行了分析和讨论。

【凡例】
正确理解和使用凡例对于正确进行《中国药典》药品质量检定是非常重要的。凡例是对《中国药典》正文、通则以及与质量检定相关的共性问题进行统一规定的基本原则。
根据第二条规定,本版药典二部收载的凡例与四部收载的通则具有同等效力,适用于那些未被收录在2015年版《中国药典》中但由国务院药品监管部门颁布的其他化学药品标准。这一规定强调了凡例和通则的重要性,要求其他品种的质量标准也需要相应提升。
根据第九条规定,原料药和制剂中已知杂质的名称、结构式等信息一般会在原料药正文中列出,并且相应的制剂正文会直接引用。对于复方制剂中活性成分相互作用产生的杂质,一般会列在该品种正文项下。这一规定说明,在制定质量标准时,如果同时申报原料药和制剂,已知杂质的信息通常会列在原料药质量标准中,并且可以参考药典中已有的格式。对于只申报制剂的品种,可以在制剂质量标准中明确列出已知杂质的信息。这一规定表明我国药品质量标准在与欧洲药典(EP)的形式接近。
第十七条进行了三个方面的修订。首先,新增了对于生产过程中引入的有机溶剂的规定。在研发工作中,如果有足够的证据证明生产过程中并未使用药典标准中规定的残留溶剂,就无需进行检查。不必对那些根本没有使用到的溶剂进行药典检查。对于制剂生产过程中使用的溶剂,如乙醇等,应进行考察,证明其在限度范围内。其次,新增了对于采用色谱法检测有关物质时的规定,指出杂质峰(或斑点)不包括溶剂、辅料或原料药的非活性部分等产生的色谱峰(或斑点),必要时可以采用适宜的方法对这些非杂质峰进行确认。这为处理某些品种中的类似问题提供了思路。第三,新增了对于处方中含有抑菌剂的注射剂和眼用制剂的规定,要求建立适宜的检测方法对抑菌剂的含量进行控制。已明确列出需要进行抑菌剂检查的品种必须依法对产品中使用的抑菌剂进行检查,并符合相应的限度规定。这一规定严格控制了已上市产品中防腐剂滥用的现象。根据上述思路和要求,在研发中应根据药典和相关指导原则的要求对防腐剂、抑菌剂以及某些品种中处方中的抗氧剂进行研究和控制,以确保药品的安全、有效和质量可控。
第二十二条新增了“采用本版药典规定的方法进行检验时,应对方法的适用性进行确认”的规定。这意味着,在使用药典方法时,标准使用者应首先确认自己的产品和条件(包括试验条件和软硬件条件等)是否适用该方法,只有确认后才能使用药典方法。在研发中,经常涉及方法验证、方法转移和方法确认这三个概念。对于药典方法或法定方法而言,方法确认是进行检验时不可或缺的环节。只有经过适当的方法确认,才能证明检验人员或检测实验室具备操作药典方法或法定方法的能力,并证明该方法适用于特定品种。《分析方法确认内容介绍》一文中,中检院的许明哲等详细介绍了方法确认的概念,并提供了不同类型方法确认所需进行的具体内容,为检验工作提供了有益的参考。
第二十六条规定了标准品和对照品应按照其标签所示的内容进行贮藏和使用。这句话包含两个重要的含义。首先,贮藏条件必须按照说明书规定的条件进行,如果偏离条件,可能会导致量值的变化,从而对检测结果产生影响。其次,标准品和对照品都有其适用范围,必须按照使用说明书进行使用,不能随意扩大使用范围。例如,定性用的对照品严格来讲不能用于定量分析,否则可能引起误差。在实际使用中,还应观察和记录中检院提供的对照品的性状、包装、贮藏条件等信息。有时,企业通过某种途径获得的同一批对照品可能会出现性状上的不同。同一种对照品的不同批号在包装和贮藏条件上也可能完全不同。对于执行非药典标准的某些品种,如果可以在中检院网站上找到相应的杂质对照品,那么就不必购买国外药典的对照品了。
【中文通用名称】
药典委员会的名词与术语专业委员会负责制修订药品通用名称的原则,包括世界卫生组织(WHO)的国际非专利药(INN)中文名称的命名以及中国上市药品的命名工作。为了与国际接轨,化学药品活性成分的通用名称通常按照INN中文名称进行命名。在2015年版《中国药典》的两个部分中,对一些药品名称进行了修订。例如,将"埃索美拉唑钠"修订为"艾司奥美拉唑钠",将"还原型谷胱甘肽"修订为"谷胱甘肽"。制剂的命名一般遵循"活性成分+给药途径+剂型"的原则。例如,将"丙酸倍氯米松气雾剂"更名为"丙酸倍氯米松吸入气雾剂",将"硫酸特布他林气雾剂"修订为"硫酸特布他林吸入气雾剂"。
根据上述修订,可以看出,仿制药必须按照新版《中国药典》的命名进行,不能再使用之前的名称。对于某些特殊制剂,也需要按照上述原则进行命名。新版《中国药品通用名称》由国家药典委员会编写,于2014年11月1日发布,收录了近万个药品的中文通用名称、INN名称、化学结构式、分子式、分子量、化学名称、CAS号和药效分类。该书是目前我国收录药品最全、编写单位最权威的药品工具书,在研发工作中应该密切关注其内容。
在药品研发过程中,一个重要的讨论议题是申请药品的通用名称。2012年9月18日,药典会发布了《申请中国药品通用名称命名报送材料要求》的公告,要求申请单位提交正式的申请函,并提供原料药和制剂项目的相关内容。按照规定,申请单位需要准备好所有的资料,并将其寄送给药典会,然后按照流程进行缴费、提交和审核等手续。
为了进一步确保药品命名的科学准确性和严谨性,药典会于2013年6月17日发布了《关于对化学药品、生物制品通用名命名相关要求的通知》。根据该通知,化学药品通用名的申请原则上应在完成药品注册要求的临床试验后提交申请。在提交化学药品通用名申请时,还需要同时提交完成临床试验的相关说明,以便进行科学准确的命名。因此,新药在完成药品注册要求的临床试验后,企业可以自行向药典委员会申请通用名称,并按照《申请中国药品通用名称命名报送材料要求》提交相应的资料。对于第三类药物,如果验证性临床批件中包含了需要与药典委员会商定通用名称的建议,企业应尽早申请,以免影响审评和上市时间。如果批件中没有这样的建议,企业也应尽早评估或与中国药监局药品注册管理中心(CDE)进行沟通,以确定通用名称是否准确。
【性状】
根据2015年版《中国药典》二部的修订,对于大部分品种(主要是原料药),删除了性状中的"味"相关描述。因此,在研发过程中,一些原料药在进行质量标准修订时可以删除与"味"相关的描述。
【熔点】
2015年版《中国药典》收录了三种方法来测定熔点,包括传温液法、熔点自动测定仪法和热分析法。其中,熔点自动测定仪法是首次被收录的方法。江苏省食品药品监督检验研究院的黄朝瑜等人使用熔点自动测定仪法结合传统的传温液法和热分析法,对熔点标准品和复杂代表性药品的熔点进行了测定。他们的研究发现,传温液法和熔点自动测定仪法在重复性和中间精密度方面表现良好,适用于测定熔点均匀且物化性质稳定的样品;而热分析法适用于难以直观判断终点的熔融同时分解样品以及多晶型样品的熔点测定。这些结果为根据样品特性选择合适的方法在研发过程中提供了参考。
【鉴别】
在药典中,对于氯化物的化学鉴别有两种写法。对于液体制剂或液体原料,写法为:本品显氯化物鉴别(1)的反应(通则0301);对于固体原料药,写法为:本品的水溶液显氯化物鉴别(1)的反应(通则0301)或本品显氯化物的鉴别反应(通则0301)。
在红外光谱鉴别中,最常见的问题是没有参考《药品红外光谱集》进行标准起草或修订。目前,《药品红外光谱集》已经发布了五卷(1995、2000、2005、2010、2015)。第一卷收录了0001-0685号图谱,第二卷收录了0686-0893号图谱,第三卷收录了0894-1103号图谱,第四卷收录了1104-1228号图谱,第五卷收录了1229-1322号图谱。在《中国药典》和国家药品标准中收录了红外鉴别或检查的品种,在光谱集中都有相应的记录,供进行比对。在研发过程中,应了解第五卷中新增的品种。
【有关物质】
由于现在的液相色谱工作站可以自由缩放,因此关于记录仪灵敏度的要求已经在品种正文中删除,不再具体要求调节检测灵敏度使样品色谱峰的峰高为满量程的10%-20%。
根据凡例规定,制剂的所有已知杂质应在原料药标准中列出,但要注意杂质序号的变化,同序号的杂质应确认是否相同。在引用制剂项下的已知杂质时,采用"原料药名称+杂质名称"的形式,例如"阿卡波糖杂质I"。复方制剂的主成分以及主药与辅料相互作用产物也列在各品种项下,例如异福片中利福平与异烟肼的结合产物为利福霉素异烟腙(HYD),地塞米松磷酸钠注射液中地塞米松磷酸钠与抗氧剂亚硫酸氢钠的作用产物为16α-甲基-11β,17α,21-三羟基-9α-氟-1β-磺酸基孕甾-4-烯-3,20-二酮-21-磷酸酯二钠盐。
原料药质量标准中的杂质信息包括已知杂质的结构式、化学名以及分子式和分子量,这些信息以附录的形式附在标准后面。当杂质采用相对保留时间进行定位时,质量标准中应规定详细的色谱条件,如色谱柱厂家、规格、流速和柱温,并规定主峰的保留时间。如果方法采用梯度洗脱,应有明确有效的分离度要求,理论板数的要求可以删除。
2015年版《中国药典》对方法的系统适用性要求更高。目前,增加了对分离度的要求,包括杂质对照品法、混合对照品法、化学破坏法和相对保留时间法等。通过配制灵敏度溶液,增加了对方法灵敏度和报告限的要求,并规范了部分积分参数的合理设置。在限度方面,对原料药和制剂都要求控制工艺杂质和降解杂质,并设定了已知杂质、特定杂质、未知杂质和总杂质的限度控制。
2015年版《中国药典》对涉及到安全性的项目进行了增修订。例如,在雷米普利的标准中采用原子吸收分光光度法对催化剂钯进行控制;肝素钠标准中增加了对蛋白质和多硫酸软骨素的控制;盐酸利多卡因注射液由于椎管给药方式的存在,标准中增加了渗透压的控制,并且限度要求更加严格;手性固定相的高效液相色谱和手性添加剂的毛细管电泳在光学异构体杂质的控制中得到应用。在伏立康唑标准中,右旋异构体采用了大赛璐公司(Daicel)的Chiralpak AS-H手性柱,而佐米曲普坦标准中R-异构体的测定采用了毛细管电泳法。毛细管电泳法在药典中的应用越来越多,常用于解决异构体拆分和无机离子检测等问题,市场上的仪器如安捷伦公司的Agilent 7100 CE可以进行多种方式的分离和检测。
【残留溶剂】
在书写方面,对于只有一种方法的情况,仅列出"残留溶剂",而在限度中写明应符合规定的具体残留溶剂名称的残留量。对于两种以上方法测量不同溶剂的情况,首先列出"残留溶剂",然后使用宋体列出具体溶剂名称的小标题。在执行药典标准进行检验时,由于凡例已经增加了"对生产过程中引入"的规定,这意味着如果生产企业有足够的证据证明在生产过程中未使用标准中规定的残留溶剂,就可以不对标准中规定的相关残留溶剂进行检查。
【溶出度与释放度】
引用的附录名称已经更改为"0931溶出度与释放度检查法"。释放介质统一改为溶出介质,释放量统一为溶出量。原来的释放度第三法现在改为溶出度第四法,并且对贴剂和透皮贴剂需要特别关注。2015年版《中国药典》的第四法分为方法1(大碟法)和方法2(小碟法),其中小碟法是新增的方法。生产企业应根据自己产品的特点选择适合的方法。例如,对于原药典中的品种"雌二醇缓释贴片",规格为"2.5mg(4.0cm×2.6cm)",只能使用大碟法。
随着仿制药一致性评价工作的深入进行,对溶出曲线和溶出现象的要求越来越高。市场上出现了一些具有特点的溶出仪器,例如岛津公司的SNTR系列溶出度仪(SNTR-6400A、SNTR-8400A和SNTR-8400AT)。这些仪器通过灵活丰富的配置方案,可以与分析仪器如UV-1800进行联用,方便样品收集和数据分析。同时,它们还可以连接视频记录系统,实时监控和记录每个溶出杯中样品的状态和释放过程,便于追溯和查找异常数据产生的原因。
【水分】
2015年版《中国药典》对于水分检查法的相关通则进行了修订,将原来的第一法A改为第一法1,将原来的第一法B改为第一法2。因此,在相关文献中需要进行相应的替换。
【含量测定】
当使用色谱方法进行鉴别时,供试品溶液的书写方式应为“……,作为供试品溶液”。仅当活性部分出现峰时,应明确该峰的确切成分是什么(除了有机酸成酯)。例如,盐酸麻黄碱出现的峰应标记为麻黄碱峰,醋酸地塞米松出现的峰应标记为醋酸地塞米松峰。
【规格】
根据2015年版《中国药典》的规定(总局2015年第105号文),多规格药品应按照(分子式)的计算方式列出具体规格之前。例如,盐酸美他环素胶囊应写作:“按C22H22N2O8计(1)0.1g,(2)0.2g”。而对于单一规格的药品,则在具体规格之后列出(按分子式计算)。例如,盐酸舍曲林胶囊应写作:“50mg(按C17H17Cl2N计)”。
由于药典中无法收录所有已上市的产品规格,根据《中国药典》2015年版的实施公告,企业应根据其产品规格,对标准中规格影响操作的项目进行必要的规范,并执行药典标准。
【晶型】
当化学药品存在多晶型现象且不同晶型状态可能对药品的安全性或有效性产生影响时,应对其晶型进行研究,并在必要时在标准中对其有效晶型进行控制。《中国药典》2015年版已规定了多种用于晶型研究的方法,包括毛细管熔点法、差示扫描量热法、红外光谱法和X射线衍射法等。
在2015年版《中国药典》中,那格列奈和阿立哌唑的晶型控制采用了粉末X射线衍射法。蒙脱石和蒙脱石散的有效性和安全性与其晶型直接相关,因此在2015年版《中国药典》中采用了粉末X射线衍射法进行主成分鉴别和杂质检查。
在制定粉末X射线衍射法控制晶型的方法参数中,根据药典中的案例,可能需要包括以下内容:光源、光管电压、光管电流、发射狭缝、散射狭缝、接受狭缝、扫描的衍射角范围,以及供试品或对照品的特征峰(如2θ,精确到小数点后一位)。
【粒度】
蒙脱石在《中国药典》中规定了粒度检查,采用照粒度和粒度分布测定法(通则0982第三法)进行测定。在该方法中,推荐使用Malvern Mastersizer 2000仪器,并采用湿法进行检测。方法中规定了样品量、加水量、检测器遮光率范围、转速、搅拌时间、超声参数(超声功率、振幅)、连续测量次数等具体要求。
该方法对于制定粒度分布测试方法的参数考察、方法学验证指标以及规范起草标准提供了有益的参考。
【离子色谱与蒸发光检测器】
《中国药典》中对于离子色谱法和蒸发光检测器的应用并不是很多,但有一些代表性的例子。例如,阿仑膦酸钠的有关物质检查和含量测定采用离子色谱法,规定使用阴离子交换色谱柱Dionex RFIC IonPac AS11和保护柱Dionex IonPac AG11。硫酸依替米星的含量测定和有关物质检查在原有蒸发光检测器的基础上增加了新型电化学检测器作为第一法。
在离子色谱分析领域中,戴安离子色谱仪是广泛应用的仪器,具有较高的知名度。而蒸发光散射检测器是一种通用型检测器,可用于检测没有紫外吸收的有机物质。奥泰蒸发光散射检测器是一种常用的仪器,可与任何HPLC系统连接,并可与LC-ELSD-UV-MS系统相连,提供丰富的信息。
【药典通则】
2015年版《中国药典》在四个主要特点之一是进一步加强药品质控。完善的检验方法是提高药品安全性和有效性的基础。该版本药典在完善检验方法的同时,重点加强了药品安全性和有效性方面的检验方法建立和质控要求制定。
在安全性控制方面,药典涉及了粉末X射线衍射法、澄清度检查法(仪器法)、国家药品标准物质通则等方法。在有效性控制方面,涉及了溶出度与释放度测定法(桨碟法、转筒法)、电感耦合等离子体质谱法、拉曼光谱法、药品晶型研究及晶型质量控制指导原则等方法。在质量控制方面,包括吸入制剂微细离子空气动力学特性测定法(安德森撞击器、新一代撞击器)、生物样品定量分析方法验证指导原则、药用辅料功能性指标研究指导原则、药包材通用要求指导原则、药用玻璃材料和容器指导原则、国家药品标准物质制备指导原则等。
可以看出,2015年版《中国药典》进一步强化了药品质量全过程控制理念,加强了对药品生产源头和工艺过程控制的重视。通过完善相关技术指南,加强对药品的研发、生产、质控环境、药用辅材和药用包材等各环节的全过程控制要求。
在药品上市前阶段,影响药品质量差异的要素主要包括药品研发和生产环节。在研发阶段,需要遵循GLP(良好实验室规范)、GCP(良好临床实践)和QbD(质量源于设计)等原则,包括制剂处方工艺、原辅材料选择和包装设计等。在生产阶段,需要遵循GMP(良好生产规范)、质量体系建设和维护、人力资源、硬件投入、生产运营以及环保健康安全管理体系(EHS)等。
在质量研究中,需要采用对比和类比的思维方式。例如,对比研究可以从以下两个方面考虑:一是药品质量标准的比对,包括各国药典中收录的情况、原研药和其他仿制药的标准情况(包括原料药、单方制剂和复方制剂)、质量指标范围的大小和宽严程度、检验方法的专属性、先进性和可重复性等。二是对药品标准执行情况进行评估,包括数据的准确性、数据的精密度、重现性和耐用性,图谱或曲线与标准图谱或标准曲线的拟合度,以及不同规模的多批次产品的批间差和批间一致性等。
【拉曼光谱】
拉曼光谱法具有其独特的特点。本文将以药典通则中的拉曼光谱法在研发中的应用为例进行介绍。在《拉曼技术在药物逆向工程中的应用》一文中,田芳等人提到,在某些情况下,当其他常用的固态分析技术如X射线粉末衍射、差示扫描量热法等不适用时,可以使用拉曼光谱法对原研制剂中药物活性成分(API)的晶型进行鉴定。该文通过展示在某些特定条件下应用拉曼光谱法的具体案例,展示了分子振动相关光谱分析方法在药物逆向分析工程中的应用前景。
其中一个例子是:已知某制剂中的API存在两种固态形式,即无定形和半水合物。为了确定由两个不同厂家生产的片剂(药片A、B)中API的晶型是否一致,首先需要应用X射线粉末衍射对药片A和B中的API晶型进行鉴定。通过比较药片A、B与API的X射线粉末衍射图谱,可以观察到药片A的X射线粉末衍射图谱与API半水合物的特征峰在整个图谱上高度吻合(见图1a和1d)。由于该API只能以无定形和半水合物形式存在,因此可以基本确认药片A中含有的API为半水合物。然而,当比较药片B的X射线粉末衍射图谱(见图1b)与API半水合物时,很难确定药片B中的API是否也为半水合物。由于药片B中同时含有晶体辅料(如乳糖)和其他无定形辅料,无法通过X射线粉末衍射来确定药片B中API的晶型。
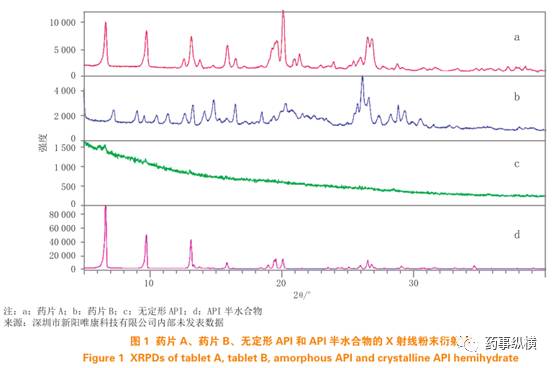
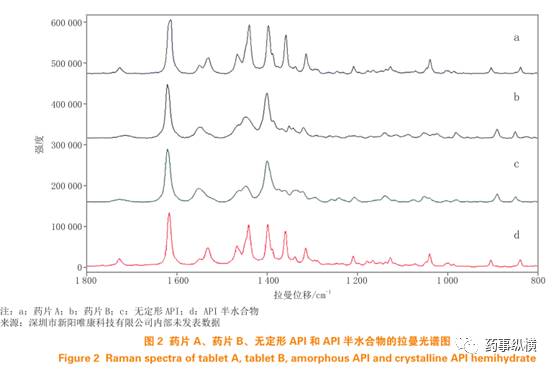
通过应用拉曼光谱技术,可以比对图2中药片A、B与API的拉曼光谱图。观察到药片A的拉曼光谱与API半水合物的图谱基本一致(见图2a和2d)。同时,药片B的拉曼光谱与无定形API的图谱基本一致(见图2b和2c)。因此,在这种情况下,拉曼光谱可以有效解决制剂中无定形API的鉴定问题。通常情况下,不同固态形式的API具有不同的拉曼光谱特征。与结晶形API相比,无定形API的拉曼光谱表现出更宽的峰形,并且存在波数偏移。通过将实测样品的拉曼光谱与不同晶型API的参考拉曼光谱进行比对,可以确定制剂中API的晶型。
【辅料质控】
2015年版《中国药典》对药用辅料的鉴别、有关物质、杂质和残留溶剂等控制要求进行了加强。修订内容包括药用辅料功能性指标研究指导原则的增订,更加注重对辅料功能性的控制。例如,增加了对多孔性、粉末细度、粉末流动性、比表面积和黏度等检查项目的要求。根据辅料的功能性指标的不同,还形成了系列化和规格化的要求,以满足制剂生产的需求。随着辅料检测项目的增加,企业的质量控制(QC)人员面临着更大的检测任务。为了满足检测要求,必须增加硬件设备。对于没有检测条件的情况,可能需要进行委外检测。
【对照品】
根据《药品注册管理办法》中的化学药品注册资料及申报要求,申报资料项目11要求提供药品标准及起草说明,并提供标准品或对照品。所提供的标准品或对照品应附带相关资料,包括其来源、理化常数、纯度、含量测定方法和数据等说明。然而,在新药研究中(如化学药品注册分类为1类和3类),往往没有现有的对照品可供使用,即使能够从国外相关机构购得,价格昂贵且数量不足以满足整个新药开发过程的需求。在这种情况下,研发单位需要自行研究和标定对照品。然而,在化学药品审评中,对这一部分内容往往没有得到足够的重视,研究可能不够全面,甚至被忽视,研究水平也参差不齐。2015年版《中国药典》的国家药品标准物质制备指导原则对对照品的来源、制备、标定和稳定性考察等方面进行了详细规定,这对药品研发工作具有借鉴意义。
此外,中国药品检验研究院编写了我国第一套化学药品对照品图谱集,并已出版。该图谱集整理了近600种常用化学药品的各类谱学数据,并对700多种化学对照品进行了红外、拉曼、紫外特征等方面的研究分析,还从核磁共振和动态水分吸附等方面对多种化学对照品进行了研究。这套图谱集共分为6册,包括《总谱》、《质谱》、《红外、拉曼、紫外光谱》等。该图谱集对于化学对照品的研制工作具有重要的参考和指导意义。
《中国药典》中对于化学原料药及相关制剂质量的检测(定性、定量分析)明确了前处理方法和检测方法,但未列出可供分析工作者参考的分析结果和相关分析图谱。为了进一步提供指导,增加药品检测操作的准确性,在结合药典方法的基础上,中检院和安捷伦科技有限公司的专家共同完成了《2010年版中国药典化学药品标准物质分析方法及应用图谱(精)》的编写工作。该图谱集为化学对照品、化学原料药及相关制剂的检测分析(定量、定性分析)提供了参考。通过查阅该图谱集,分析人员可以获得相关的思路和指导,从而更加直观地进行分析,提高准确性。
【实施药典中需要开展的工作】
根据CFDA发布的关于实施《中华人民共和国药典》2015年版的公告(2015年第105号),对于需要进行补充申请以符合2015年版药典的情况,应在2015年12月1日之前进行申报。对于未能按时提交相应补充申请的情况,国家药典委员会在2015年12月7日发布的《关于《中国药典》2015年版实施公告有关问题的解读》中明确表示:“对于2015年版药典发布前已上市的药品,生产企业应在2015年12月1日之前完成原标准与新版药典相关要求的研究和比对,并按照公告要求进行相应的备案或补充申报。在2015年12月1日之后仍可以提交相应的补充申请。”
在实际工作中,对于属于《中国药典》2015年版收录的品种,但其药品注册标准与药典要求不同的情况,有以下处理方式:(1)对于收录检验项目多于药典规定或质量指标严于药典要求的情况,应在执行药典要求的基础上,同时执行原注册标准的相应项目和指标。在这种情况下,需要向省级食药监管部门(进口药品需报国家食药监管总局)备案。(2)对于药品注册标准收录检验项目少于药典规定或质量指标低于药典要求的情况,应执行药典规定。在执行药典标准之前,企业也应进行相应的方法适用性研究。如果适用,应采用药典标准进行检验。如果检验方法不适用,则应建立新的方法并进行相应的方法学研究,并提交补充申请。对于现有条件下生产的产品质量指标无法达到药典标准的情况,应进行处方工艺、原辅料等方面的优化和变更,并提交补充申请。所采用的质量标准不得低于药典标准。
在研发中,技术审评部门要求按照新版药典的凡例、通则、制剂通则以及通用性检验方法的相关要求开展研究,并提交相应的申报资料,对于新提交的药品注册申请。因此,在研发过程中,例如各种检验方法、方法学验证、稳定性考察等方面,首先要考虑参考《中国药典》进行研究。
【药典与技术指导原则】
药品的技术指导原则是对新药研发研究、药品生产、质量控制、上市监管等方面的重要指导文件,是药品研发者、生产者和监管者共同遵守的统一原则。《中国药典》是药品研制、生产、经营、使用和监督管理等方面应遵循的法定依据。然而,这两个指导原则体系之间存在一些差异。姜典卓在《关于我国化学药品技术指导原则体系有关问题的探讨》一文中提到了这些差异。国家药监总局新发布的稳定性技术指导原则与药典收录的稳定性技术指导原则在内容上存在差异。

根据表3的数据,更新后的技术指导原则整体上比药典收录的指导原则更为严格和详尽。许多企业在研发过程中也遵循国际药典委员会(ICH)的要求。然而,仍有一些企业一直沿用原来的指导原则。为了引导企业按照新的指导原则进行研究,应协调药典收录的指导原则进行实时更新。
2015年版《中国药典》中的9101药品质量标准分析方法验证指导原则新增了准确度要求、样品中待测成分含量和回收率限度要求表格,以及关于精密度的样品中待测定成分含量和精密度RSD可接受范围表格。然而,这些规定在欧美药典、技术指导原则以及ICH中并没有统一的规定。因此,是否能够接受这些规定还值得探讨。
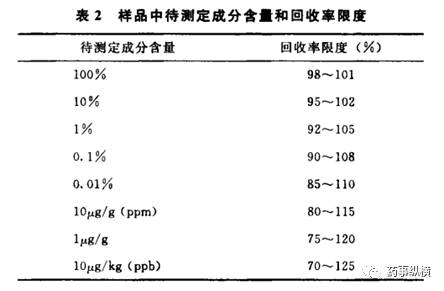
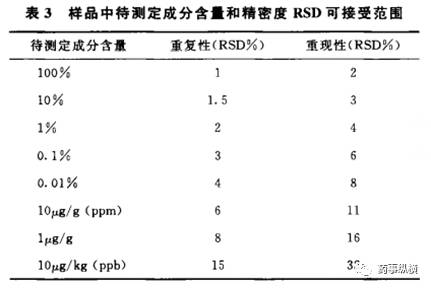
校正因子或响应因子的规定方面存在差异。根据我国药典的规定,校正因子在0.9~1.1之间可视为1,而美国药典(USP)和英国药典(BP)均规定响应因子在0.8~1.2之间可视为1。换算成校正因子后,大致也在0.8~1.2之间。这种差异导致当我们参考USP和BP中的同一品种标准时,在涉及已知杂质的物质检查方面可能会出现偏差。
在溶解度检测方面,默认温度的规定也存在差异。中国药典规定的方法默认温度为(25±2)℃,而日本药局方第16版(JP16)和英国药典(BP)均规定为15~25℃。
【总结】
2015年版《中国药典》的修订对药品研发将产生重大影响。在进行药品研发工作时,我们应当综合考虑《中国药典》的各项规定以及国际和国内最新的政策、法规、指导原则和行业认知。只有这样,我们才能在研究和科学决策中更加高效地运用《中国药典》。
参考文献
李慧义,姜典卓,王志军等.2015年版《中国药典》二部主要增修订内容介绍[J].中国药学杂志.2015, 50(20):1757-1760
姜典卓.2015年版《中国药典》二部品种标准执行注意事项概述[J].中国药学杂志.2015, 50(20):1761-1763
黄朝瑜,陈民辉,蔡美明等.《中国药典》2015年版收载的三种熔点测定方法的对比[J].中国药品标准 2015, 16(6): 412-416
许明哲,黄宝斌,杨青云等.分析方法确认内容介绍[J].药物分析杂志.2015,35(1) 183-189
洪小栩,许华玉,尚悦等.2015年版《中国药典》四部增修订概况[J].中国药学杂志.2015, 50( 20):1782-1786
张伟.试论药品标准与药品质量[J].中国药品标准. 2016,17( 1):3-9
田芳,Zimmermann Anne, McgoverinCushla等.拉曼技术在药物逆向工程中的应用[J].药学进展.2016,40 (12):897-905
田晓娟,周立新,张苏等.实施《中国药典》2015年版工作中需要开展的研究验证工作[J].首都食品与医药.2016.1-2
姜典卓.关于我国化学药品技术指导原则体系有关问题的探讨[J].中国新药杂志.2016,25(13):1456-1460





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论