
最近在期刊网搜索的时候猛然发现了如下解读。

从作者组成来说,这个解读是非常权威的。对于理解9213指导原则具有重要作用。看完整篇文章,对于我个人来说有几点印象特别深刻的地方。
1. 突破
国内外药品监管机构如FDA、EMEA、ICH、WHO、各国药典等已发布的关于分析方法验证、转移、确认的相关法规和标准,都仅适用于理化分析方法。9213指导原则是一种创新突破。
同时,正是由于这种突破也造成了9213与其他微生物通则和指导原则的关系容易混淆。
2. 关系
突破造成的关系混淆可以通过下图来梳理(图中有小错误,不过不影响阅读理解)。之前关于9213与9201之间的误解,都可以通过此图解释。9213的范围也远比我原来理解的要大。
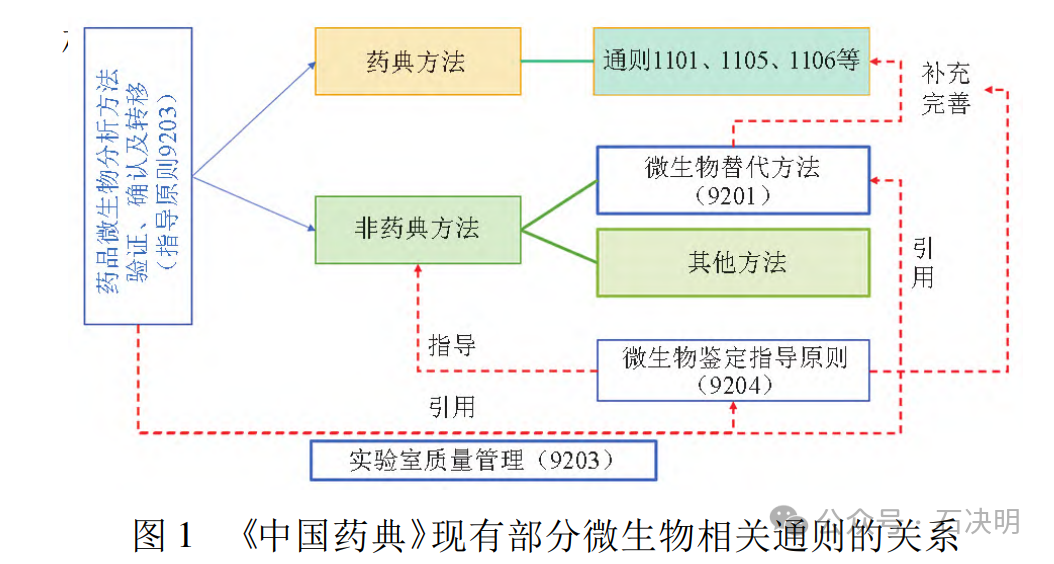
3. 不复杂
文章中明确提出:方法适用性是方法确认的一种形式。
对已长期开展无菌或微生物限度检查的实验室,仍可按药典通则 1101、通则1105等中的方法适用性试验对具体品种进行无菌或微生物限度检查方法的确认。
回到方法确认来说,一方面是实验室的能力(具体可以参考9203指导原则去评估,个人觉得还得补充实验室的历史表现数据),这一点对于长期开展微生物相关检查的实验室是可以跳过的。另一方面是被检验样品的适用性开发,开发之前就必须收集样品抑菌成分的含量波动及溶解度情况。
文章来源:蒲公英Ouryao、石决明
原文链接:https://mp.weixin.qq.com/s/W6CSUHZXpz5YRXKiWhFPoA
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论