
2023年1月16日,中国国家药品监督管理局(NMPA)批准百奥泰生物制药股份有限公司申报的托珠单抗生物类似药BAT1806(托珠单抗注射液,tocilizumab,商品名:施瑞立)上市。施瑞立是中国国内首个也是全球任何其他监管机构首个批准的托珠单抗生物类似药(biosimilar),适应症为类风湿关节炎(RA)、全身型幼年特发性关节炎(sJIA)和细胞因子释放综合征(CRS);相关专利WO-2019105450。据药融云统计,百奥泰生物递交的该款托珠单抗生物类似药自获CDE承办到此次获批新药上市,总共用时435天。
百奥泰生物BAT1806托珠单抗注射液审评时间轴(部分)
截图来源:药融云中国药品审评数据库
药融云数据库,www.pharnexcloud.com显示:2023年1月28日,国家药品监督管理局批准百奥泰生物施瑞立®(托珠单抗注射液)[规格:80mg/4mL]上市。目前首个[规格:400mg/20mL]已经成功纳入国家医保目录。在海外亦在上市申请审评中。需要注意的是,biosimilar通过全面的质量相似性研究、临床前研究、临床药物药代比对研究以及临床有效性和安全性比对研究,证明与原研药在质量、安全性和有效性上高度相似。


丽珠生物的托珠单抗生物类似药——LZM-008(商品名:安维泰)[规格:80mg/4mL]于2023年1月18日,按照国家药品监督管理局药品审批程序批准上市,并正式纳入国家医保目录。药融圈获悉:在本款托珠单抗生物类似药,公司累计直接投入的研发费用约1.78亿人民币。丽珠生物是由健康元和丽珠集团发起成立的专注于全球领先大分子创新药开发的高科技企业,主营业务为生物药自主创新研究开发及产业化,包括创新型单抗、单抗类似药、双特异性抗体、抗体偶联药物、CAR-T细胞治疗等,产品覆盖肿瘤、自身免疫性疾病等领域。
规格:80mg/4mL的托珠单抗价格为830元人民币
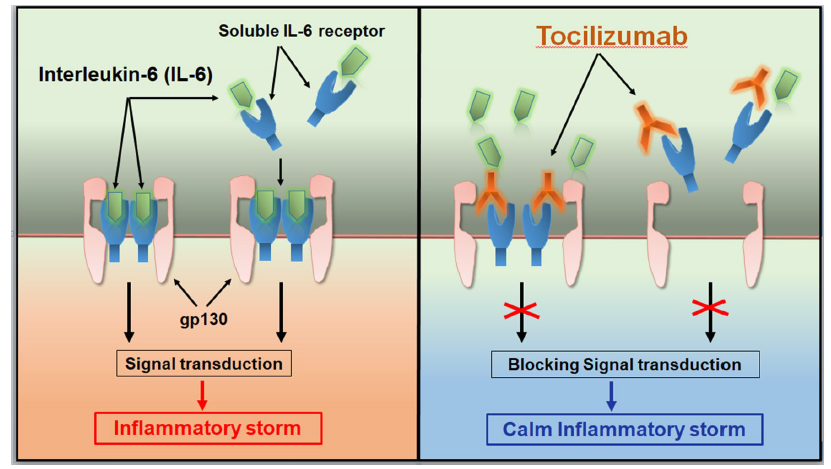
托珠单抗(tocilizumab)是一种免疫球蛋白IgG1亚型的重组人源化抗人IL-6受体单克隆抗体,可特异性地结合可溶性和膜结合性IL-6受体,并抑制由IL-6受体介导的信号转导。原研Actemra®/雅美罗是罗氏子公司日本中外制药(Chugai Pharmaceutical)。托珠单抗于2008 年 4 月、2009 年1 月和 2010 年 1 月先后在日本、欧洲和美国获准用于治疗类风湿性关节炎,此后获准多项适应症。目前有静脉输注(IV)和皮下注射(SC)2种方式给药剂型。据药融云统计,原研托珠单抗2021年在全球的销售额达44亿美元。
托珠单抗全球销售情况
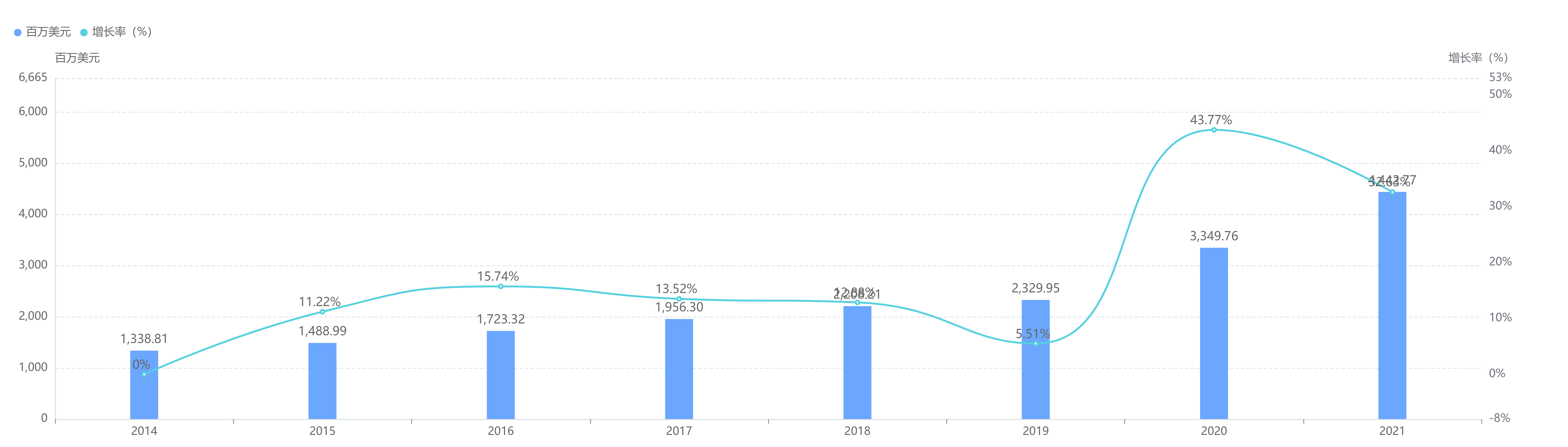
截图来源:药融云全球药物研发数据库
在中国,托珠单抗近年在全国院内的销售额出现激增,于2021年首次突破亿元大关,同比增长53.4%,达到1.2亿人民币。2022年前三季度的销售额已于2021全年比肩,预计全年将超1.5亿。
托珠单抗院内销售情况
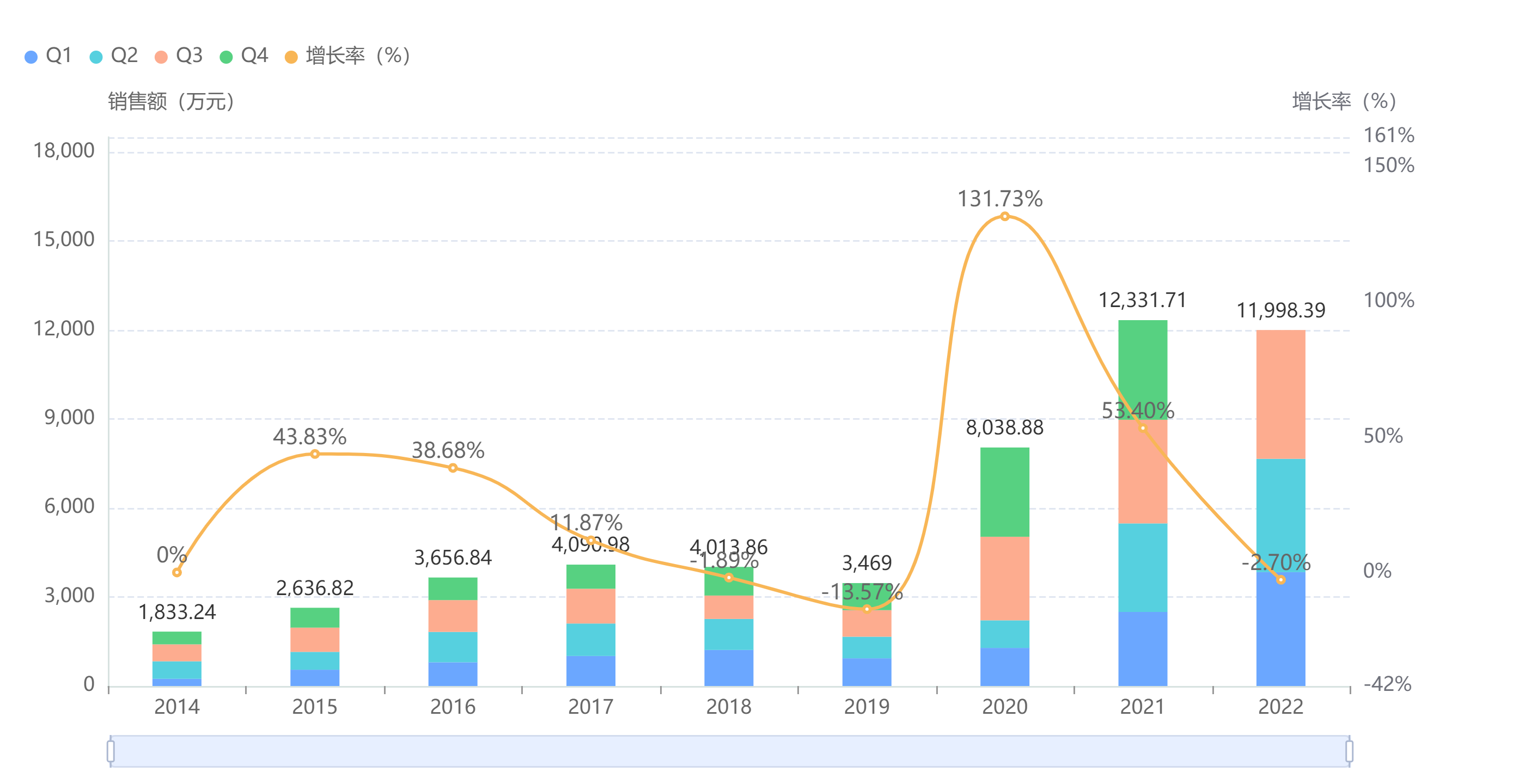
截图来源:药融云全国医院销售数据库
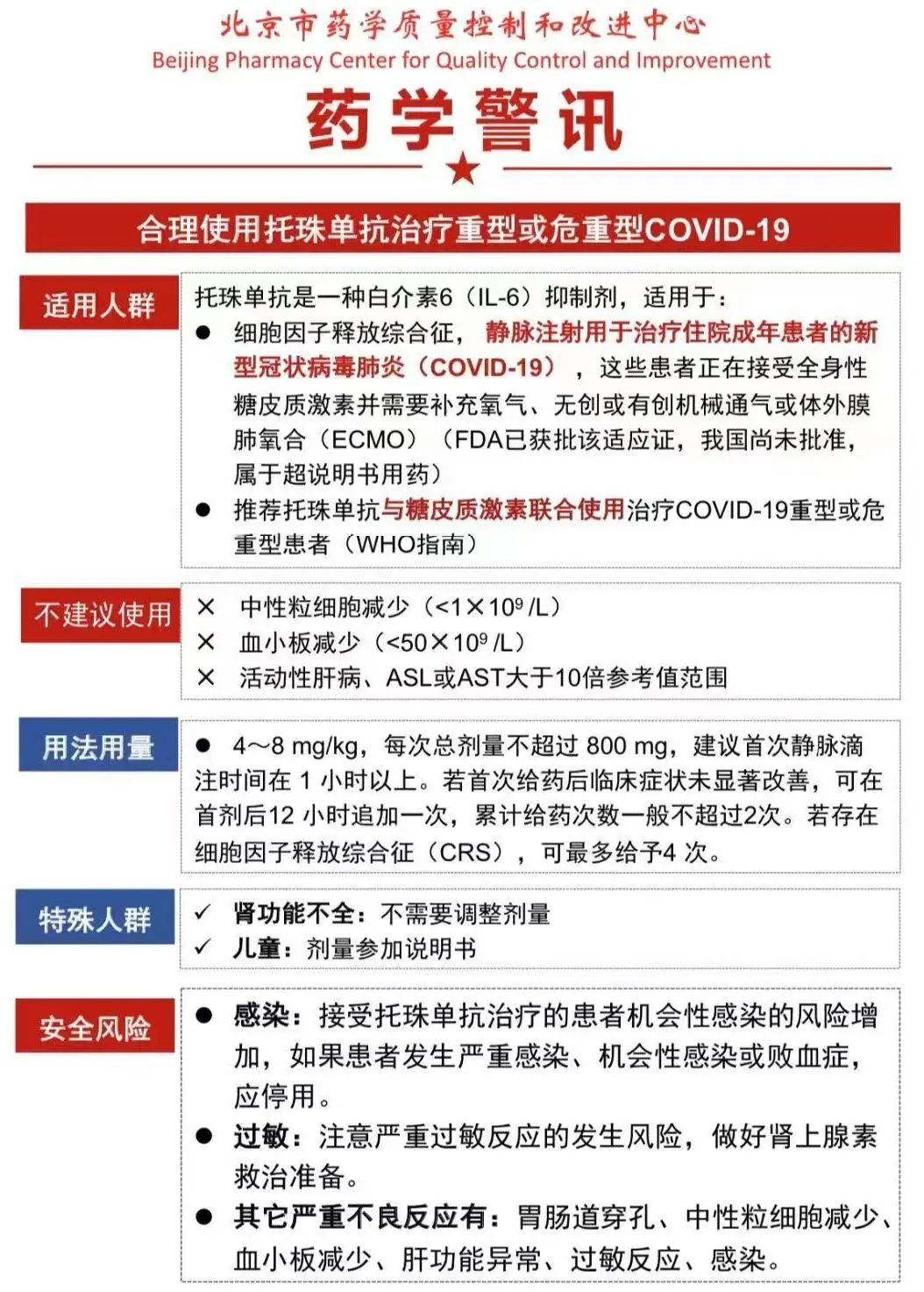
目前,托珠单抗注射液已被纳入《新型冠状病毒感染诊疗方案(试行第十版)》和《新型冠状病毒感染重症病例诊疗方案(试行第四版)》,对于重症病例且实验室检测 IL-6水平明显升高者可试用。
- 2021年6月
美国FDA批准托珠单抗作为紧急治疗授权(Emergency Use Authorization)用于重症新冠病毒肺炎患者的治疗;
- 2022年4月
美国FDA授予托珠单抗原研药优先审评资格;
- 2022年12月
美国FDA正式批准托珠单抗原研药Actemra®用于住院的成人新型冠状病毒感染者,成为第一个获得FDA正式批准的治疗新冠的单抗类药物;
- 2023年1月5日
我国国家卫健委发布的《新型冠状病毒感染诊疗方案(试行第十版)》再次推荐托珠单抗用于重型、危重型患者;对于儿童特殊情况的处理中提到,儿童发生脑炎、脑病等神经系统并发症可酌情选用;儿童发生多系统炎症综合征(MIS-C)若接受治疗后无好转或加重,可使用托珠单抗。
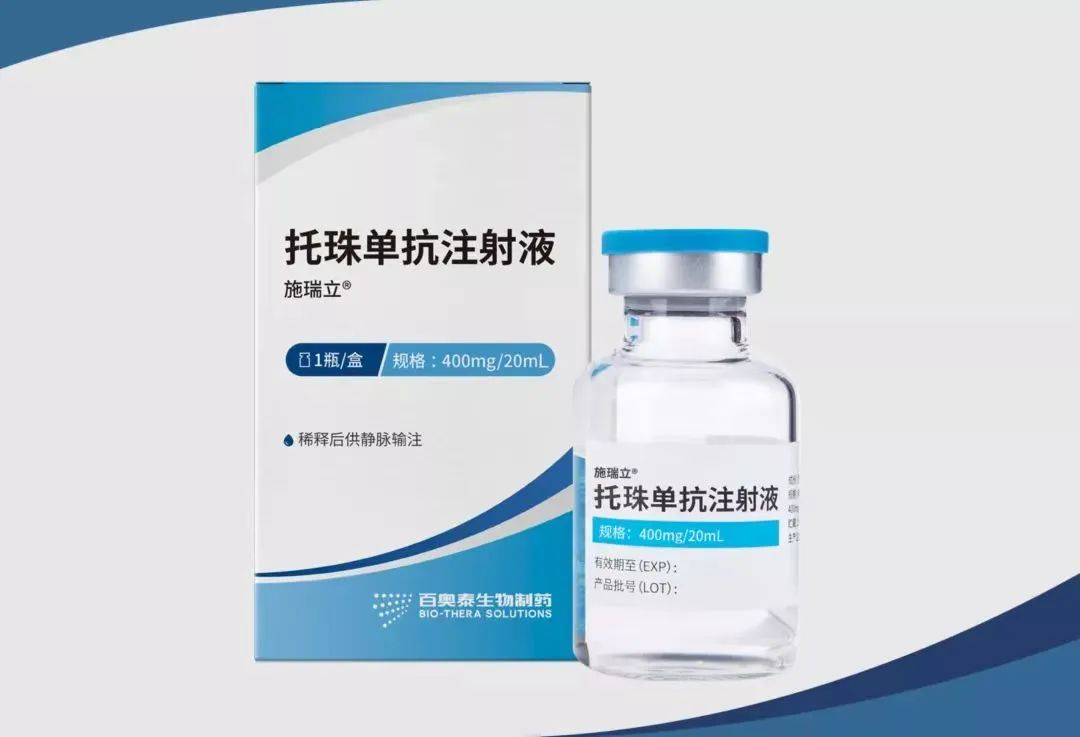
【通用名】:托珠单抗注射液
【商品名】:施瑞立®
【规 格】:400mg/20ml
【药融圈监测价格】:2680元人民币
【适应症】:用于类风湿关节炎,全身型幼年特发性关节炎,细胞因子释放综合征。
药融云数据库显示:此前金宇博沃润泽生物/泰州迈博太科药业提交了托珠单抗生物类似药上市申请,还有一些处于临床试验阶段(海正药业、江苏荃信生物等)。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据库,vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露;
https://www.bio-thera.com/;
托珠单抗注射液说明书,https://www.bio-thera.com/uploads/soft/230117/3-23011G61148.pdf;
https://www.nmpa.gov.cn/yaowen/ypjgyw/20230116165502155.html;
《新型冠状病毒肺炎诊疗方案》(第十版),国家卫健委;
https://www.globenewswire.com/en/news-release/2022/12/21/2578198/0/en/FDA-approves-Roche-s-Actemra-for-the-treatment-of-COVID-19-in-hospitalised-adults.html;
等等。
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论