《中国药典》2015年版的实施,标志着我国用药、制药以及监管水平的全面提升,促进了药品质量的整体提高。在研发中,如果结合药典相关内容进行反复研究就会发现里面有很多值得借鉴和思考的问题。作者结合实际工作体会及文献报道,选取部分具有代表性的话题进行分析和讨论,为质量研究人员提供参考。
一、【质量标准制定的工具书】
从事研发的人员经常会接触到《国家药品标准工作手册》一书,该书于1988、1992、1999、2013年共出版了四版,目前最新版本为第四版。该手册对实现国家标准的科学化、规范化发挥了重要作用,深受制药人的欢迎和喜爱。
《国家药品标准工作手册》(第四版)由国家药典委员会编写,是在第三版的基础上修订而来,主要收载了以下内容:
国家药品标准研究制定与应用的技术要求、指导原则;
标准正文各论编写细则;
起草说明编写细则以及《中国药典注释》编写原则;
《临床用药须知》编写原则和细则;
《中国药典》英文版编译细则;
中国药品通用名称命名原则;
国家药品标准起草复核工作规范和技术要求等标准相关工作规范

其中,化学药品标准部分包括如下内容:
国家药品标准(化学药品)主要检测方法应用指导原则
国家(化学药品)有关物质检测指导细则
国家药品标准(化学药品)正文各论编写细则
第一部分总要求
第二部分原料药编写细则
第三部分制剂标准编写细则
国家药品标准(化学药品)起草说明编写细则
《中国药典注释》(二部)编写细则
《中国药典》(二部)英文版编译细则
《国家药品标准工作手册》(第四版)作为工具书,特别适合从事原料药或制剂质量研究及质量标准制定工作的人员使用。笔者认为,如果将其与2015版《中国药典》相结合效果会很好,在此重点推荐。
二、【质量标准起草和使用细节】
《中国药典》2015年版二部正文品种项下,根据品种或剂型的不同,基本按顺序列有如下内容:
药品名称:中文名、汉语拼音、英文名
有机药物的结构式
分子式与分子量
来源或有机药物的化学名称,以及含量或效价的限度规定
处方
制法
性状
鉴别
检查
含量或效价测定
类别
规格
贮藏
制剂
在起草和制定药品标准时可以参考相近品种的质量标准及格式进行,以免出现遗漏或格式不准确的情况。比如:结构式画法不正确、分子量小数点位数不正确、检查项下顺序不合理、规格中漏写分子式、规格写法不合理等。如果起草前不注意与药典格式进行比较,那么进行申报和电子提交后将会出现错误。
质量研究中还应注意细节问题,列举部分如下:
所建立的检测方法所用的试剂应该容易获得;
避免使用有毒试剂或环境污染试剂,如醋酸汞、醋酐、苯等;
如配制溶液时所用试剂与药典附录收载的试药不同,可以使用药典试药进行折算;
在所建立的方法中,如果对仪器设备有特殊要求,应该详细列明,有时甚至需要用附图加以说明和解释(这在有复杂样品前处理和、衍生化、特殊分离程序的标准中需要注意)
在片剂性状进行描述时,《中国药典》2015版四部制剂通则中“片剂外观应完整光洁,色泽均匀,有适宜的硬度和耐磨性”,说明仅有概念性的描述并没有明确的判定细则。在起草标准时尽管可以按照药典格式进行简单描述。但是在实际检查中有时可能发现各种异常(如:杂点、色点、麻面、缺角、破碎、花斑、特殊异物、特殊味道等)这些通常在中间产品或内控时进行研究,但在稳定性考察、药品实际流通中也应该进行关注(比如色点),要研究清楚是辅料中存在的还是主药降解产生的或者其他来源。
药品质量标准的书写语言应用词准确、简练、逻辑严谨,避免产生误解或歧义。举例如下:

《中国药典》2015 年版二部氨茶碱缓释片溶出度检查规定的溶出介质为:“稀盐酸溶液(24→1000)1000 mL”。这种描述就不够严谨,易产生歧义,制备时可能存在两种理解:
介质(1):取浓盐酸24mL,加水稀释至1000mL。采用该介质,照标准操作,取样后,加入的氢氧化钠量不足以中和酸,所得供试品溶液仍显酸性。
介质(2): 取稀盐酸(234mL浓盐酸→1000mL)24mL,加水稀释至1000mL。采用该介质进行试验,所得供试品溶液中的盐酸已经被完全中和。
其中,介质(2)与胃液的pH值环境相似,有很多品种采用该介质进行溶出度试验,如《中国药典》2015年版二部乙酰螺旋霉素片/胶囊等,这些标准对介质的制备方法描述比较清晰,如“以盐酸溶液(稀盐酸24mL→1000 mL)为溶出介质”。因此,认为应采用(2)法制备介质。
为验证上述推测,对这两种介质均进行了试验,由两个实验人员采用两台不同的仪器分别进行,结果如下:
介质(1):最大吸收波长均为 271 nm,不是标准规定的275nm,释放度结果均不符合规定;
介质(2):吸收波长与标准规定一致,三个时间点释放量均符合标准规定。
进一步研究认为,溶出介质对试验结果影响较大,氨茶碱在碱性介质中才会充分游离成茶碱并可以进行测定,介质(1)酸度过大,加入标准规定量的氢氧化钠溶液不能中和至碱性,从而导致吸收波长存在差异,并且茶碱也不能充分游离出来,导致结果偏低。
在研发中经常会遇到一些敏感药物,这些药物的溶解性差以及稳定性差等,如果发现不了关键因素就会出现问题。
以复方利血平片含量测定为例:

在复方利血平片含量测定时,发现其中硫酸双肼屈嗪的含量偏低,而且数次试验结果平行性较差。经考察样品提取时间,发现供试品溶液中的硫酸双肼屈嗪不稳定,随超声时间延长而降解,但对照品溶液中的硫酸双肼屈嗪较稳定。研究表明,影响硫酸双肼屈嗪溶液稳定性的关键因素是溶液的pH值,此外,供试品溶液须临用新制、供试品溶解采用振摇方式、溶剂加入体积量越大越好。
根据上述案例可见,仿制药研发中在进行标准对比、筛选方法的时候往往不能根据常规经验来建立方法,比如将标准中的方法改成超声,看似节约了时间但可能会引起不稳定药物含量的降低。因此在对已有标准进行研究时,一定要结合产品对已有标准中的操作进行详细研究和分析。
三、【已知杂质计算方法的启示】
在研发中,经常会遇到同一品种HPLC法测定有关物质中已知杂质的测定方法有很多种 ,计算方法也相应很多种的情况。虽然某一药品中某一杂质的实际含量是一定的,但不同的计算方法会得出不同的结果。每种计算方法都有不同的意义及其优缺点。

表1-各种计算方法的计算公式及其重要优缺点
采用HPLC法测定药品中有关物质时,现行版 《中国药典 》二部品种有关物质检查项下,仍然较多的是对未知杂质的检查和限定,这也从一个侧面反映了我们在药品研发和质量标准制订中相比于 《美国药典 》、《欧洲药典》和 《英国药典 》还有许多需要完善和提高的地方。
以抗高血压药马来酸依那普利片中有关物质的计算方法为例:

由于不同计算方法所表示的意义不同,所以得出的结果也不相同,如某企业的马来酸依那普利片,按上述不同计算方法得出的杂质的含量结果。
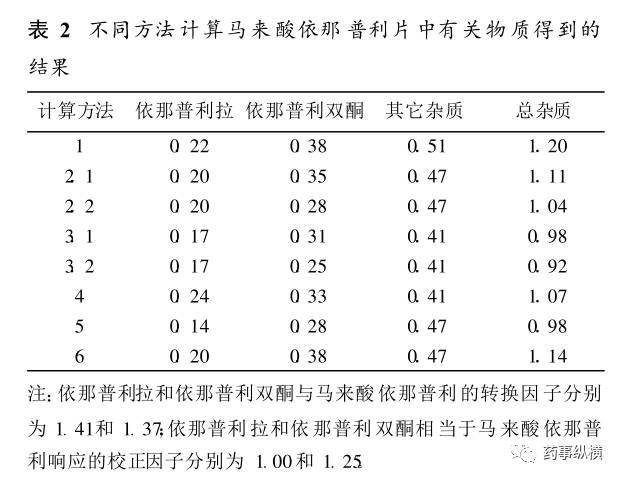
表2-不同方法计算马来酸依那普利片的结果
由上表可知,不同的计算方法得出有关物质中已知杂质和总杂质的含量不尽相同,如果采用统一的限度,就会出现同一杂质采用不同的计算方法,结果在有些情况下符合规定,而有些情况下不符合规定的现象,这种情况下只能根据不同的计算方法和有关要求制订合理的限度。
理论上讲,只要制定合理的限度,无论采用哪种计算方法,都同样可以有效控制杂质的含量,因此,根据测定和计算方法的选择确定合理的杂质限度才是最关键的。但理想的杂质定量方法为已知杂质对照品法与未知杂质不加校正因子的主成分自身对照法两者的结合。不过对于已知杂质,加校正因子的主成分自身对照法和加校正因子的主成分对照品外标法也是可以优先考虑的,研究人员可根据实际情况选用合适的定量方法。
为了避免各种定量结果产生的差异,目前在研发中杂质对照品外标法依然是测定已知杂质的最好的选择,当选择其他方法计算时需要谨慎考虑;同时也要认识到不同计算方法时可能出现的差异,在进行已知杂质量对比时需要综合考虑多种因素;有关物质检查时一定要注意国内外各种药典方法的对比,包括原料药、制剂、以及其他剂型的制剂。
四、 【色谱柱的特性与确认】
HPLC法最常用的是反相色谱法,首选十八烷基键合硅胶色谱柱,但这类色谱柱的类型很多,不同基质、不同载碳量、不同封端处理方式、不同纯度、不同粒径、孔径、柱长等,都将影响分离效能;另外根据主成分和有关物质的性质,也可以选择辛烷基键合硅胶色谱柱、苯基键合硅胶色谱柱、氰基键合硅胶色谱柱,极性较大的化合物如多糖类药物也可选择氨基键合硅胶色谱柱。
如果工艺杂质与主成分为同系物、异构体等结构相似的化合物,应尽可能选择分离效能合适的色谱柱。降解杂质多为极性较大的小分子,应选择极性大、含碳量较低的色谱柱。分离碱性化合物,建议选择端基封闭或碱去活性的色谱柱等。
2015版《中国药典》中有些标准项下就规定了某厂家的色谱柱,如硝酸甘油溶液和硝酸甘油溶液气雾剂项下就规定采用天津博纳艾杰尔公司的Venusil MP C18色谱柱,并规定了规格。

实际工作中会发现,同样是C18色谱柱,但由于不同载碳量、不同封端处理方式、不同孔径等差异,往往会有不同的分离效果。上述三种因素需要在色谱柱选择时重点考虑。

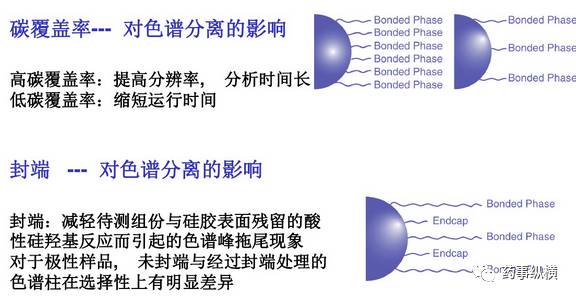
此外,在色谱方法开发过程中还要考虑,化合物的pKa、色谱柱pH耐用范围等,如Agilent公司的一系列色谱柱为方法开发提供的解决方案。从事方法开发的人员必须要了解各个公司色谱柱的最新进展和特点,只有这样才能快速解决问题。
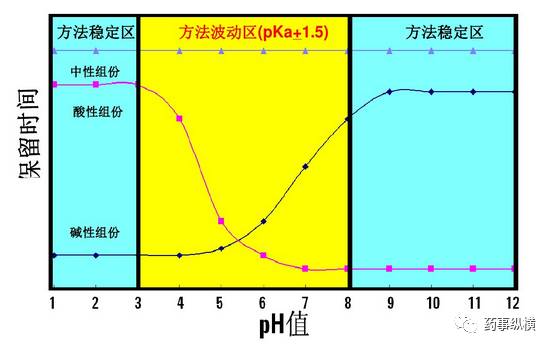
2015版《中国药典》标准中一般不指定色谱柱品牌,但是在质量标准制定中如有特殊要求(如梯度洗脱或采用相对保留时间对杂质进行定位)或方法对色谱柱的选择性比较强时,可列出推荐的色谱柱(包括品牌、型号、柱长、内径、粒径等信息),同时注明“或效能相当”或对色谱柱填料信息进行描述,否则后期检验时可能会出现异常问题。在参考药典方法进行检验时,一定首先做好方法的确认,并找到合适的色谱柱。
以下为安捷伦、艾杰尔公司的色谱柱特性介绍:
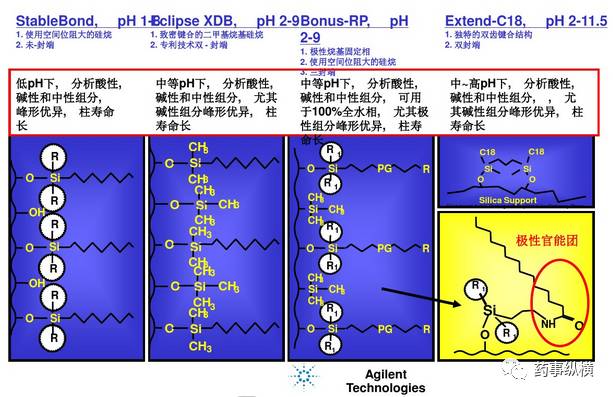
Agilent公司色谱柱特性介绍
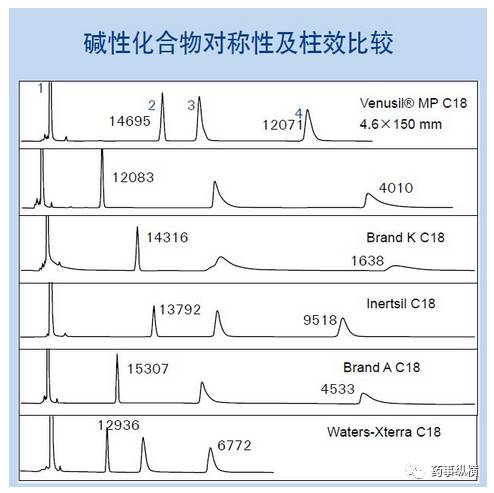
艾杰尔公司Venusil MP C18色谱柱介绍
五、【色谱方法中的重要参数】
●检测器
通常普通紫外检测器灵敏度比二极管阵列检测器高0.5~2个数量级,常规检验时可使用普通紫外检测器,建立方法考察专属性时可采用二极管阵列检测器。
紫外检测器长时间使用后,由于光学表面的污染、光电二极管或光电倍增管老化,将导致灵敏度下降,而用于有关物质检查的紫外检测器应确保灵敏度符合要求,所以质量标准中有时配制灵敏度试验溶液,测试紫外检测灵敏度。
●检测波长
采用紫外检测器时,选择合适的波长十分重要。
供试品主成分最大吸收波长适用于检测与主成分结构相近、有相同或相近最大吸收波长的杂质,如母体相近的合成前体、异构体、同系物等。采用杂质的最大吸收波长适用于检测已知杂质。末端吸收波长适用于大多没有紫外最大吸收波长杂质的测定。
如难以兼顾各杂质的最大吸收波长和检测灵敏度,则可选择多波长分别检测不同的杂质。对于未知非特定杂质,检测波长的选择以尽可能检测出所分离出的杂质为原则。在建立方法时检测波长需要重点考虑并应合理。
●流动相
水相最好使用新鲜的超纯水或二重以上蒸馏水配制。为保证色谱系统的分离性能,有时需要在流动相中使用离子对。如分离的主成分为碱基时,使用烷基硫酸盐或磺酸盐;分离的主成分为酸根时,使用烷基季胺盐等。
常用离子对浓度为 0.005~0.02mol/L。流动相水相应当是缓冲液,以保证pH的稳定;使用梯度洗脱时,流动相 A与流动相B中的离子对浓度应尽可能一致,以避免洗脱过程中离子对浓度的变化。
使用离子对时应注意分析前色谱系统的平衡。在使用梯度洗脱时,由于检测池内光的折射效应,特别是使用末端吸收波长检测时,当梯度变化剧烈时,可能出现鬼峰(也称“虚峰”或“伪峰”)。为避免出现鬼峰,可以将水相与有机相以不同比例混合成流动相A与B,再作梯度;或者避免梯度的剧烈变化。
这些细节在建立方法的时候同样需要考虑。有时在进样器前使用杂质捕集柱也可以解决鬼峰的问题,如月旭科技Ghost-Buster Column流动相杂质捕集小柱安装在梯度混合器和进样器之间,不仅能够去除流动相中的杂质,还可以有效去除管路和混合器中的杂质。
下图为不加 Ghost-Buster流动相杂质捕集柱(a)和加Ghost-Buster流动相杂质捕集柱(b)对比色谱图。
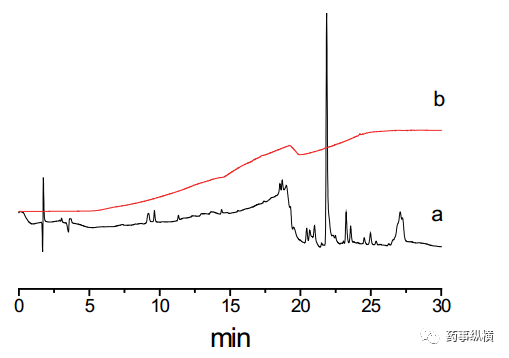
月旭 Ghost-Buster Column杂质捕集小柱
●系统适用性
样品中具有共存的特定杂质,但如无法长期获得该杂质对照品时,采用相对保留时间定位,可设置杂质峰和主成分峰间的分离度;但需要特别注意色谱条件的耐用性考察。
在梯度洗脱的色谱系统中为保证方法的重现性,应对主峰的出峰时间进行规定(保证在梯度程序结束前主峰具有适当的保留时间)。药典正文中有很多类似品种进行了主峰保留时间的规定。在起草质量标准的时候,应该参考《中国药典》有关品种进行规定。
●对照溶液
自身对照法的对照溶液通常用供试品溶液按一定比例稀释来配制,而不采用精确稀释成 xx µg/ml浓度的方法。对照溶液浓度一般使对照溶液主峰的峰面积与所关注主要杂质的量接近限度时的峰面积相当或略低。大于对照限度的,可采用对照溶液主峰面积的整数倍,一般应避免使用主峰面积的几分之一的办法。
●干扰峰
HPLC 法测定有关物质,色谱峰的干扰是主要干扰因素,应当注意排除。常见的峰有溶剂峰、辅料峰、系统杂质峰和鬼峰等。
溶剂峰、辅料峰在短波长检测时多见,可以通过进样溶剂和辅料溶液来确证排除。如果在辅料或溶剂峰中发现有杂质峰的存在,则应优化方法使杂质峰与辅料峰分开,或采用其他色谱系统或其他测定方法分别测定。
系统杂质峰有两种情况,一是重复出现的干扰峰,二是偶而出现的干扰峰。系统杂质峰通常是由进样器污染引起。前者可通过零体积进样或流动相进样来确定,后者的排除较为困难,可以清洗进样器和管路,必要时可在不接色谱柱的情况下,用稀硝酸清冼进样器和管路。
六、【小结】
2015年版《中国药典》对药品研发工作有重要借鉴意义,在研究中应不断思考,不断总结,借鉴有关学者和专家的研究成果,结合具体品种进行分析,在思想中坚持“最严谨的标准”思路,这样才能越做越好。
参考文献
[1] 李婕,袁松,张红,黄海伟,林兰.药品质量标准执行过程中的几个关注点[J].中国药事.2017,31(2):170-173
[2] 余振喜,庾莉菊,黄海伟,张启明.浅谈HPLC法测定有关物质时已知杂质的计算方法[J].中国药品标准. 2010,11(4):278-282
[3] 姜雄平,李慧义,陈桂良,魏立平. 药品标准中有关物质HPLC测定的几点意见[J].中国药品标准.2013, 14(3): 163-167






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论