同年,诺西那生钠注射液被列入第61批参比目录,截至目前,共有3家国内企业仿制,按时间顺序分别是重庆药友、齐鲁制药、成都国为。
这个药的首仿争夺备受行业关注,患者也期待仿制药上市能进一步拉低价格。可惜重庆药友作为最早提交上市的企业,历经三百多天评审,最终于11月17日被下发通知件,没给发补机会。
罕见病药物通常研发技术难度都比较高,据业内人士分析,诺西那生钠采用的是较为前沿的工艺生产,原料药结构复杂、杂质种类繁多且难以控制,且药物用于鞘内注射,对pH、渗透压、内毒素等有严格要求,因此监管机构审评会更谨慎。
首家申报的重庆药友已经失败,目前仍有齐鲁和成都国为在审,希望能有好结果。
02
相比之下,另一款罕见病特效药,尼替西农的情况则更为严峻。
该药用于酪氨酸血症Ⅰ型,这个药同样也是一个很有代表性的品种,这个品种被列入2019年国家卫健委《第一批鼓励仿制药品目录》的首位。
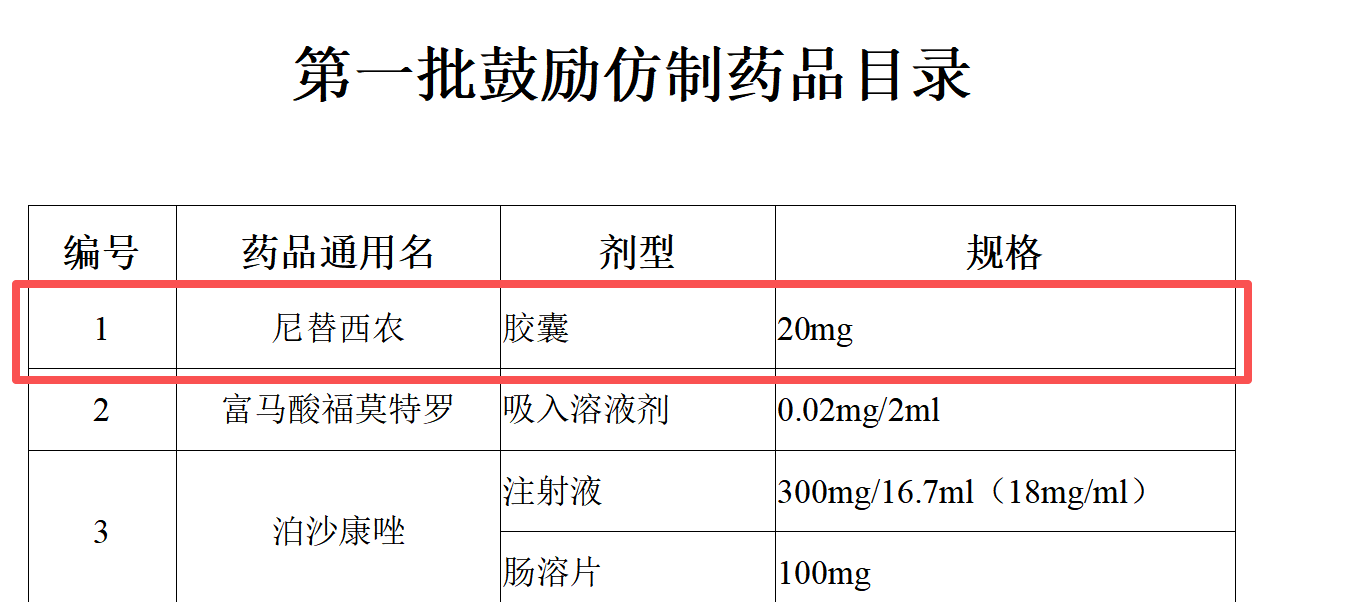
然而至今仍无国内无企业仿制,仅两家境外药企在中国获批。
加拿大Mendelikabs于2021年上市,瑞典原研企业于2023年获批,但却并未上市销售。目前国内患者主要依赖加拿大药企提供的药物。
该企业产品于2024年起进入医保,两年不到就于近期被曝全国断供。

据悉,此次断药,是由于境外生产该药的加拿大药企停产所致。而停产的主要原因,是因为市场销售额未达预期,加之原材料未通过FDA认证。
早在10月份,该企业的境内代理便开始向患儿家属透露,国内所剩库存已经不多,每位患儿仅能获得2瓶,后续无新增供应计划。
据患者家属透露,目前已有至少8名患儿面临断药,其中最小的仅6个月。缺药导致很多患儿被迫减少药量,还有一些此前药物控制不错的患儿,被迫选择了肝移植(此前只有尼替西农用药无效的情况下才会选择肝移植)。
当然从数量上看,这个病无法同上文的SMA相比,虽然同属罕见病,但发病率却相差极大,SMA被成为“不罕见的罕见病”,而酪氨酸血症Ⅰ型则是“超罕见的罕见病”,该病中国发病率约为1/60000~1/50000,国内有用药需求的酪氨酸血症Ⅰ型仅不到十位,且零星分布在全国各地。
因此销售额很低,年销售额才不足十万,也因此境外企业不愿继续生产。
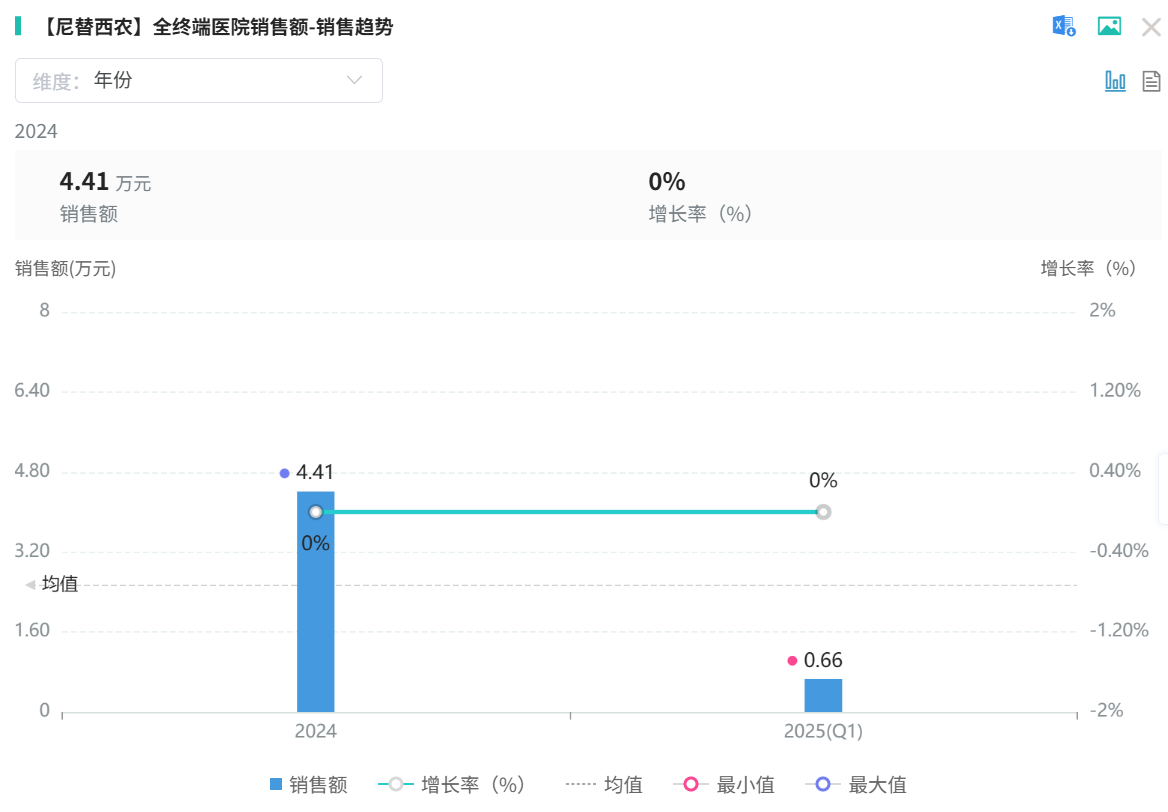
截图来源:摩熵医药数据库
虽然现实,但国内罕见病药物的现状便是如此:高价值药能做,但难;而低需求药市场太小,基本无人问津。
行业与政策面临的挑战依旧存在,如何让更多罕见病患者获得稳定、可负担的用药,仍是悬而未决的难题。
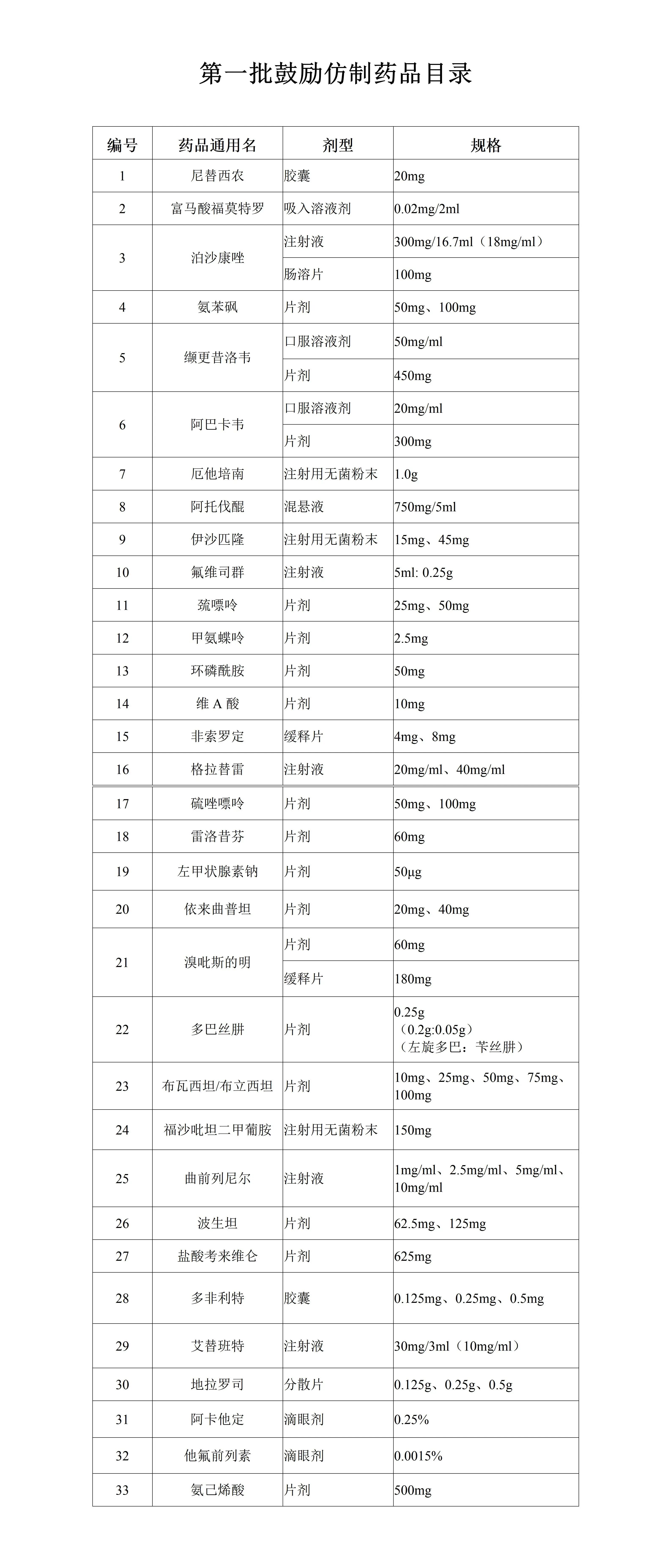
附:第一批鼓励仿制药品目录
参考来源:
[1] NMPA/CDE官网
[2] 摩熵医药(原药融云)数据库
扩展阅读:
1. Aristea 完成 6300 万美元 B 轮融资,开发罕见病免疫新药
2. 一文知悉罕见病巨头Ultragenyx管线进展与布局
3. 财政部:罕见病药品依照3%征收率计算缴纳增值税
想要解锁更多药品信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论