药品注册过程中决定申请能否被批准很重要的一部分内容就是杂质研究,申报者(MAH)会对药品活性原料的合成路径、制剂的工艺、药品的降解以及相容性等方面进行研究,对关键批次进行杂质检验以及对实际存在和潜在的杂质的安全性进行毒理研究,最后制定杂质的质量标准以保证药品的安全性。那么药品企业如何在药品批准上市之后,尤其是涉及到药品质量的变更发生时保证药品杂质始终处于可控状态?最关键也是最直接的一步就是通过杂质检验的色谱图,识别色谱图中的未知色谱峰并对其进行调查研究。建议操作步骤如下:
1、识别未知色谱峰
查看每一个批次产品色谱图,将每一张样品色谱图放大到基线进行检查,确保小的色谱峰能够被发现。进样稀释液或空白溶液其色谱图与样品色谱图进行对比排除溶剂峰。色谱柱空体积后出现的任何非典型色谱图中的色谱峰,都认为是潜在的未知色谱峰。
2、评估未知色谱峰
当未知色谱峰低于检验方法的检测限(信噪比≥3),无需进一步调查此未知峰,当未知峰高于检验方法的检测限,计算未知峰的含量,未知色谱峰应根据检验方法或质量标准进行计算。对于单一活性成分的产品,活性原料主峰在检测器响应范围内的,可用未知色谱峰的响应值除以活性原料峰的响应值(峰高或峰面积,取决于检验方法),并以百分数进行报告;对于多个活性成分的产品,可用未知色谱峰的响应值除以最小主峰的响应值,并以百分数进行报告;当色谱图中主峰超过检测器响应值或者没有主峰时,应配制与调查阈值相当的对照品溶液进行计算未知色谱峰的大小,可以用对照品内标法或小浓度对照品外标法进行定量。尽量采用活性原料对照品溶液进行配制,如果不能实现时,可以选择与活性原料结构相似或者响应值相似的物质配制对照品溶液(例如,降解产物或工艺杂质);对于残留溶剂,利用和未知色谱峰最近分离出特定溶剂的响应因子与活性成分样品量进行计算,得出未知色谱峰的含量。
计算未知色谱峰的结果应该精确到调查阈值所要求的精确度,再与调查阈值比较,按照 ICH的标准(Q3A和Q3B)执行调查阈值。如果产品中含有多个有效成分,调查阈值的确定应使用最高日摄入量的活性原料,再进行比较。未知色谱峰的含量未超出调查阈值时,不需要发起实验室调查,实验结果记录未知色谱峰的含量。未知色谱峰的含量超出调查阈值时,则将其色谱图与技术文件中色谱图对比,将含有未知色谱峰的色谱图与检验方法、已发实验室调查、注册文件或其他技术文件中色谱图进行对比,如果发现的未知色谱峰为可查明的杂质,且其含量未超过文件记录的可接受标准,无需进行调查,根据检验方法和相关的文件报告该色谱峰。但需注意技术文件应有充分的数据证明此未知色谱峰的安全性。
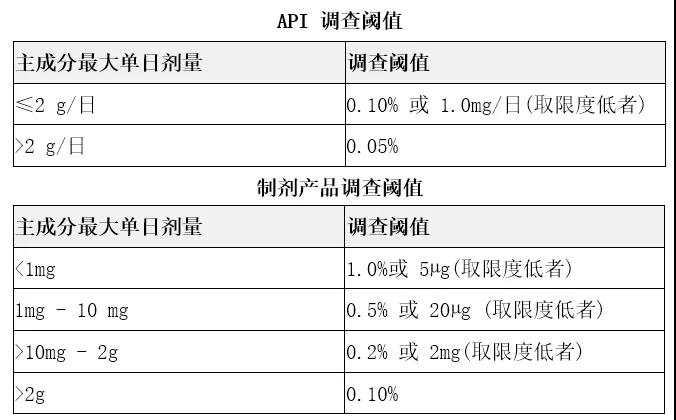
3、发起实验室调查制剂产品调查阈值
当未知色谱峰首次出现且超出调查阈值,或其含量超过已有文件记录的可接受标准,需发起实验室调查。实验室调查需排除色谱峰是否为人为引入的非药品本身含有的色谱峰。
人为引入的色谱峰一般产生的原因如下:
空白稀释液
进样稀释空白溶液,确定未知色谱峰是否为稀释空白溶液引入。查看色谱图信息确认未知峰是否在任一空白稀释液的谱图中出现。如果在进样样品稀释液色谱图中出现了未知峰,则可以得出结论,未知峰为人造峰。
样品溶液
如果不是稀释溶液引起的,则需重新进样原始样品溶液,重新进样的原始样品溶液发现未知色谱峰需确认相对保留时间与每个出现未知峰的色谱图中是否一致。
色谱系统引入
确认未知色谱峰不是由前一针样品残留或对照品残留。确认整个液相系统和所使用的色谱柱未受到污染。如果样品溶液每次重进样均未发现该色谱峰,且该峰在之前的进样中未重复出现,则表明该未知峰可能是色谱系统引入的色谱峰。
样品制备过程
重新按照之前的方法制备两份样品进样,如果在新制备的两份样品中至少一针未发现未知色谱峰,则归因于色谱系统或样品制备过程导致。
如果实验室调查无法确认未知峰为人造峰,实验室调查总结将未知峰报告为未查明色谱峰。
4、偏差调查
经过实验室调查,未查明色谱峰非实验室原因导致,应发起偏差调查,需要发起偏差调查的情况包括:新的未查明色谱峰;以往出现的未查明色谱峰,且含量高于历史数据标准;以往出现的未查明色谱峰,含量未超过历史数据标准,但该标准未被文件记录为可接受的标准。
对未知色谱峰进行结构鉴定,同时确定未知杂质的来源。推荐确定原因之后,通过相应措施将未知杂质降低到阈值以下。如无法将其降低,需对杂质的毒理进行研究确定其可接受标准并将其写入质量标准中。
注:如果在稳定性加速实验中发现未查明色谱峰,则应该与标签注明的储存条件的样品进行比较,以决定是否需要下一步的行动。
如果是因为变更而产生的未知色谱峰,建议即使含量未超过阈值也应对其进行调查,确定是否为基因毒性杂质。
5、未查明色谱峰的检验方法更新
未知色谱峰调查完成后,需将色谱峰更新至检验方法等相关文件中,更新检验方法时,应考虑更新未查明色谱峰的来源和结构确认的信息,加入已经鉴别的未查明色谱峰的代表性图谱,并加入未查明色谱峰的结构信息,规定未查明色谱峰的限度,规定色谱峰的定量方式。
6、未知色谱峰调查流程图
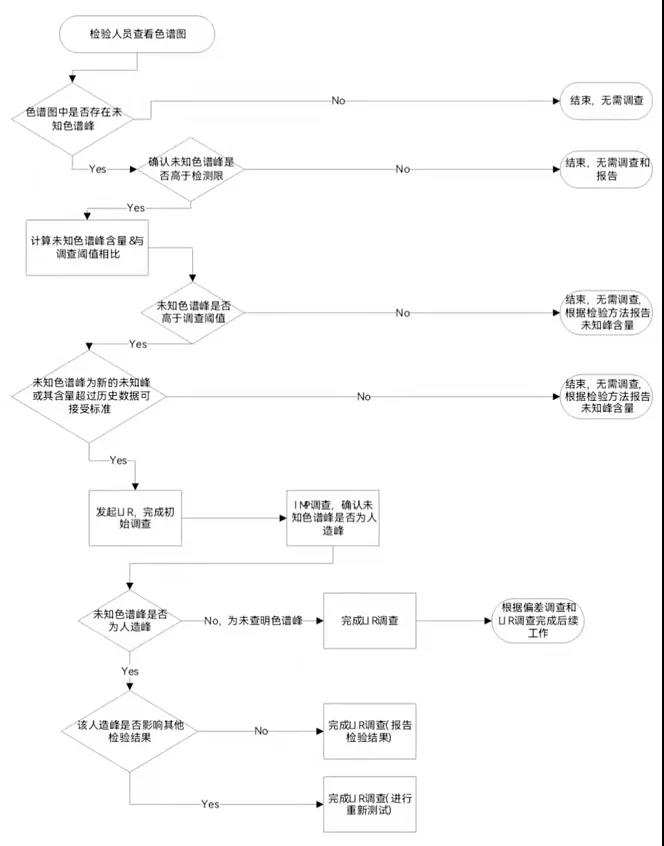
<END>





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论