黄斑区位于视网膜中央,是视网膜上最薄、视觉最敏锐的一块区域,虽然只占视网膜区域的2.1%,但几乎一半的视觉皮层都用于处理黄斑区的信息,负责视觉和色觉的视锥细胞就分布于该区域。年龄相关性黄斑变性(AMD)是一种眼部疾病,可导致中心视力下降或中心视力丧失。AMD早期通常没有症状,但随着时间的推移,视力会逐步恶化。中心视力丧失,会使患者难以辨认面孔、驾驶、阅读或进行其他日常活动,甚至产生幻觉。

正常视野(左) AMD患者的视野(右)
图源:National Eye Institute of the NIH
AMD患者多为50岁以上,患病率随年龄的增大而增加,该病是发达国家老年人致盲的最主要原因。截至2020年,AMD影响了全球超过1.9亿人,随着老年人口比例的增加,预计到2040年,患病人数将增加到2.88亿。尽管科学家针对该病已经提出了一些理论,如氧化应激、线粒体功能障碍和炎症过程,但该病的确切病因仍未明确,可能与遗传因素、环境影响、视网膜慢性损伤、营养失调、代谢障碍等有关。
根据是否有异常新生血管的存在,临床上将AMD分为干性AMD(萎缩型,dry-AMD)和湿性AMD(新生血管型,wet-AMD)两种。其中,虽然干性AMD约占AMD病例的80%~90%,疾病进展相对缓慢,但目前治疗方法匮乏,只有维生素等极少数药物在一些小范围的临床试验中被证明有效。近年来,学术界和医药界对于开发补体抑制剂来治疗眼部炎症越来越感兴趣,但对于干性AMD尚未有突破性的治疗进展。
湿性AMD以脉络膜新生血管(CNV)形成为主要特点,由于血管内皮生长因子(VEGF)是新血管生成的关键因素,因此随着各种VEGF抑制剂的问世,湿性AMD的治疗方案不断取得进展,通过玻璃体内注射抗VEGF药物,疗效显著,已获批上市的主要有罗氏的Lucentis(雷珠单抗,Ranibizumab)、再生元的Eylea(阿柏西普,Aflibercept)和诺华的Beovu(Brolucizumab)等。但是目前的玻璃体内抗VEGF药物需要频繁的眼部注射才能达到最佳的临床效果,极大影响患者的依从性,真实世界数据表明,大多数患者并未按照推荐的时间间隔接受抗VEGF药物治疗。因此,在目前还无法改变给药方式的情况下,降低给药频率有助于提高患者依从性,减轻治疗负担。
KSI-301是一种新型抗VEGF生物制剂,由美国生物制药公司Kodiak Sciences开发,该药物有望将注射间隔延长至3~5个月(目前最长间隔已达6个月),而现有疗法的注射间隔为1~3个月。其本质是一种抗体-生物聚合物偶联物(ABC),依托Kodiak专有技术平台,通过将抗VEGF单克隆抗体与一种光学透明的高分子磷脂酰胆碱生物聚合物相偶联,极大延长药物眼内半衰期,降低给药频率,或将成为针对视网膜血管性疾病的高度差异化的一线治疗方案。
KSI-301结构
图源:Kodiak Sciences招股书
关于Kodiak Sciences
Kodiak Sciences Inc.(纳斯达克:KOD)是一家临床阶段的生物制药公司,总部位于美国加州Palo Alto。2009年以Oligasis LLC的名义成立为有限责任公司,2015年更名并在特拉华州注册成立公司。Kodiak关注高度流行的视网膜疾病,致力于在全球范围内研究、开发变革性视网膜药物,并进行商业化。视网膜疾病是全球范围内导致失明的重要原因,Kodiak专注于为下一代视网膜药物的开发与制造带来新的科学突破。
ABC技术平台 & 主要候选产品

Kodiak Sciences的ABC技术平台(Antibody Biopolymer Conjugate Platform)利用分子工程,融合了抗体和化学疗法,是Kodiak研发的核心引擎。近年来,将抗体与其他分子偶联形成新型药物作用形式层出不穷,抗体-生物聚合物偶联物(ABC)就是其中一种。该公司专有的ABC技术通过将单克隆抗体与光学透明的高分子磷脂酰胆碱生物聚合物相偶联,增加注射用水溶性视网膜药物的持久性,并提高生物相容性和生物利用度。公司表示该技术将被用于开发更多的候选药物,以满足视网膜和眼科疾病中尚未满足的临床需求。
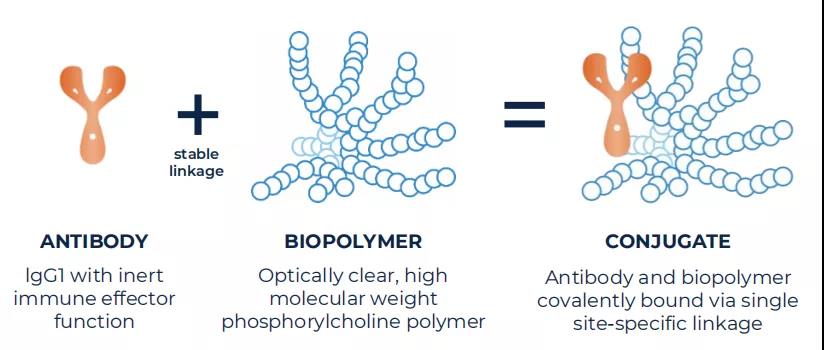
ABC PlatformTM
图源:Kodiak Sciences

Kodiak Sciences研发管线概览
Kodiak Sciences的领头候选产品就是前文提到的KSI-301,是一种靶向VEGF的抗体-生物聚合物偶联物(ABC),由全人源VEGF单克隆抗体以及光学透明且具有分枝的磷脂酰胆碱生物聚合物,通过稳定且位点特异的化学键1:1偶联而成。KSI-301分子量约为950kDa,其中抗体约150kDa,磷脂酰胆碱生物聚合物约为800kDa。因此与现有的VEGF抑制剂[单克隆抗体片段Lucentis(雷珠单抗,Ranibizumab)、重组融合蛋白Eylea(阿柏西普,Aflibercept)、单克隆抗体Avastin(贝伐珠单抗,Bevacizumab)]相比,分子量更大的KSI-301将大大延长药物在玻璃体内的存留时间,药代性质明显改善,公司称其为第二代VEGF抑制剂。

KSI-301: an Anti-VEGF ABC
图源:Kodiak Sciences
目前,该药物正在被研究用于治疗湿性年龄相关性黄斑变性(wAMD)、糖尿病性黄斑水肿(DME)、视网膜静脉阻塞(RVO)、糖尿病视网膜病变(DR)。
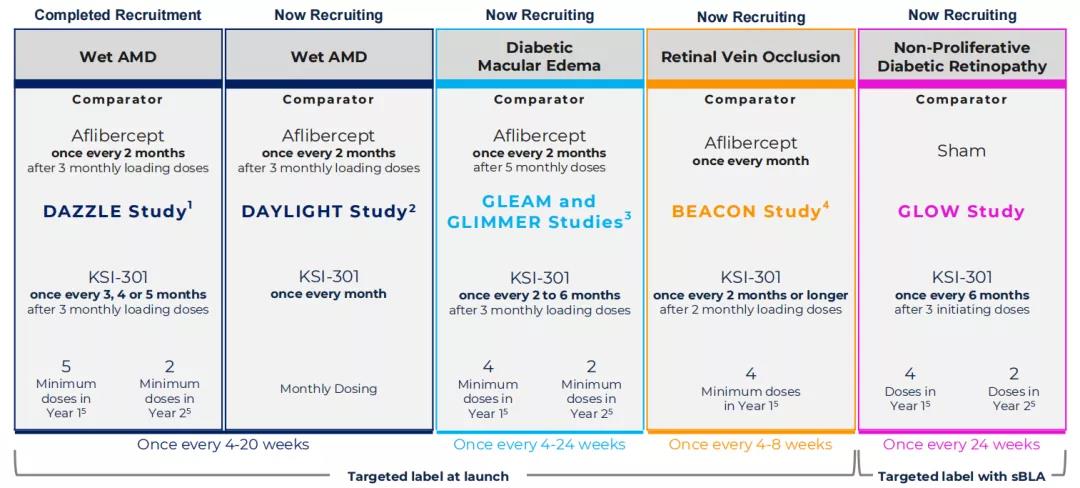
图源:Kodiak Sciences
药融云数据www.pharnexcloud.com显示,该公司正在开展一项名为DAZZLE的前瞻性、多中心、随机、双盲、非劣效性2b/3期临床试验(NCT04049266. 2),旨在比较三个月的负荷剂量后每三、四、五个月注射一次KSI-301与三个月的负荷剂量后每两个月注射一次Aflibercept(阿柏西普)治疗湿性年龄相关性黄斑变性(wAMD)的安全性与疗效。预计主要终点完成时间为2021年11月,并计划于2022年第一季度公布顶线数据。

来源:药融圈旗下药融云数据库
2021年6月15日,该公司还开启了一项名为DAYLIGHT的前瞻性、多中心、随机、双盲、非劣效性3期临床试验(NCT04964089. 3),旨在比较每月注射一次KSI-301与三个月的负荷剂量后每两个月注射一次Aflibercept(阿柏西普)治疗湿性年龄相关性黄斑变性(wAMD)的安全性与疗效。预计主要终点完成时间为2023年3月。
针对糖尿病性黄斑水肿(DME),公司开展了名为GLEAM以及GLIMMER的前瞻性、多中心、随机、双盲、非劣效性3期临床试验(NCT04611152 & NCT04603937),旨在比较三个月负荷剂量后每二至六个月注射一次KSI-301与五个月负荷剂量后每两个月注射一次Aflibercept(阿柏西普)治疗DME的安全性与疗效。预计主要终点完成时间为2022年10月。中国3期临床正在火热开展中。
针对视网膜静脉阻塞(RVO),该公司开展了一项名为BEACON的前瞻性、多中心、随机、双盲3期临床试验(NCT04592419),旨在比较两个月负荷剂量后每两个月及以上注射一次KSI-301与每月注射一次Aflibercept(阿柏西普)治疗RVO的安全性与疗效。预计主要终点完成时间为2022年4月。中国3期临床正在火热开展中。
此外,针对糖尿病视网膜病变(DR),公司于2021年8月30日开启了一项名为GLOW的前瞻性、多中心、随机、双盲3期临床试验(NCT05066230),以评估三次负荷剂量后每六个月注射一次KSI-301治疗中重度至重度非增殖性糖尿病视网膜病变(NPDR)的安全性与疗效。预计主要终点完成时间为2023年11月。
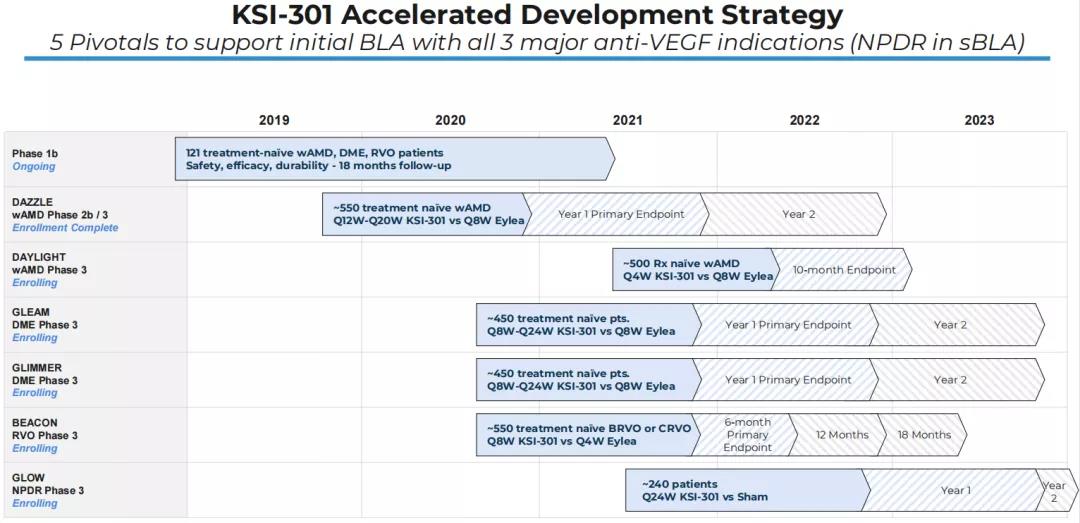
KSI-301开发计划
图源:Kodiak Sciences
为了构建领先的视网膜药物管线,Kodiak Sciences制定了2022年愿景。基于2b/3期DAZZLE试验、3期DAYLIGHT试验、3期GLEAM / GLIMMER试验、3期BEACON试验的顶线数据,预计公司将于2022年底或2023年初提交KSI-301的BLA申请,适应症包含wAMD、DME以及RVO。
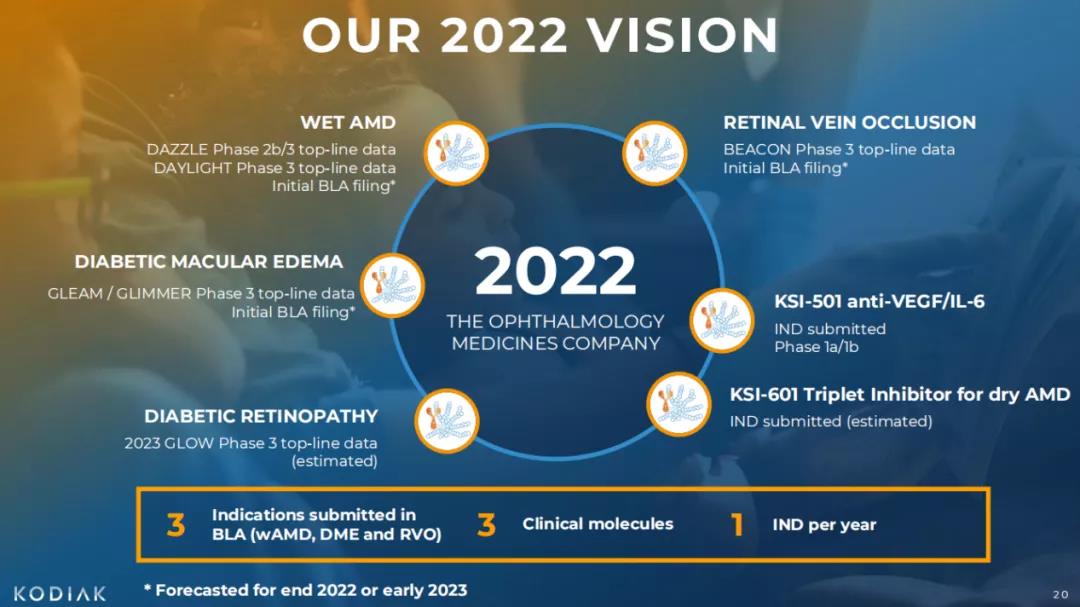
2022 VISION
图源:Kodiak Sciences
KSI-501是一款靶向IL-6 / VEGF的抗体-生物聚合物偶联物(ABC),由靶向IL-6 / VEGF的抗体融合蛋白(Trap-Antibody-Fusion, TAF)与磷脂酰胆碱生物聚合物相偶联,旨在抑制视网膜血管性疾病中异常的血管形成以及并发的炎症。临床前结构与功能研究表明,该TAF蛋白部分可同时特异性地与IL-6 / VEGF靶点相结合,该药或将为视网膜血管性疾病患者提供更加优越的治疗选择,尤其是那些具有高炎症水平的患者,如DME,以及眼部炎症性疾病,如葡萄膜炎。公司预计将于2022年上半年提交该药物的IND申请。
KSI-501结构
图源:Kodiak Sciences
上述几种血管增生性视网膜病变的致病机理相对明确,VEGF靶向治疗也已经相对成熟,但Kodiak Sciences的野心不止于此。基于公司历时十年精密设计的ABC技术平台,Kodiak正在开发“Triplet Medicines”,以治疗由多种致病机制引起的视网膜疾病:通过将小分子药物嵌入并附着在磷脂酰胆碱生物聚合物中,具有高生物相容性、高药物荷载量的特点,并能实现缓释,再与双特异性抗体相偶联,构成一种专用于视网膜疾病的新型药物形式,可参与调节多种细胞内和细胞外疾病相关通路。KSI-601就是基于该原理开发的药物,用于治疗干性年龄相关性黄斑变性(dAMD)。由于dAMD的致病机制尚未明确,可能与炎症、细胞退化与萎缩、氧化应激、脂质代谢障碍等多种因素相关,其治疗方案极其有限,而KSI-601可同时参与多个疾病相关通路的调节,有望为dAMD提供新的治疗选择。公司预计将于2023年提交该药针对dAMD的IND申请。
Triplet Medicines结构 图源:Kodiak Sciences
KSI-301动态
1.Kodiak修订与BBA的筹资协议
2019年12月2日,Kodiak Sciences与Baker Bros. Advisors(贝克兄弟顾问公司,BBA)宣布达成筹资协议,将以2.25亿美元将KSI-301的未来特许权使用费出售给BBA,来支持KSI-301后续关键临床研究。根据当时达成的协议,BBA将获得KSI-301未来净销售额4.5%的特许权使用费,但总共将不超过筹资总额的4.5倍(即不超过10.125亿美元)。当日,Kodiak Sciences股价大涨72%。截至2020年2月,BBA已为Kodiak筹得1亿美元。2021年7月22日,BBA在一份信函中确认,应Kodiak Sciences的要求,剩余的1.25亿美元将无需再支付给Kodiak,而BBA的特许权使用费上限将从10.125亿美元降至4.5亿美元。Kodiak表示这是由于公司现有资金足够,且临床试验进展顺利,董事会的一个独立委员会遂批准了不向BBA提取第二笔资金的决定。
2.INN名称确定
2021年5月,Kodiak Sciences选定了tarcocimab tedromer作为KSI-301的参考INN(国际非专利药品名称),该名称的两个词分别代表了KSI-301生物偶联物的两部分,即抗体(tarcocimab)和生物聚合物(tedromer)。
3.中国IND获批
2021年3月,KSI-301注射液在国内的IND申请获NMPA批准,适应症为视网膜静脉阻塞继发黄斑水肿、糖尿病黄斑水肿。该项批准允许KSI-301的3期BEACON试验以及3期GLIMMER试验在中国招募患者,这将有助于该药物未来在中国获批上市。

图源:NMPA
4.一年治疗数据惊艳
2021年2月13日,Kodiak Sciences在第18届美国眼科新生血管年会(Angiogenesis, Exudation and Degeneration 2021 Annual Meeting)上公布了KSI-301治疗wAMD、DME和RVO一年的持久性、疗效与安全性数据。
在三次负荷剂量后,约三分之二的患者实现了6个月及以上的无治疗间隔。
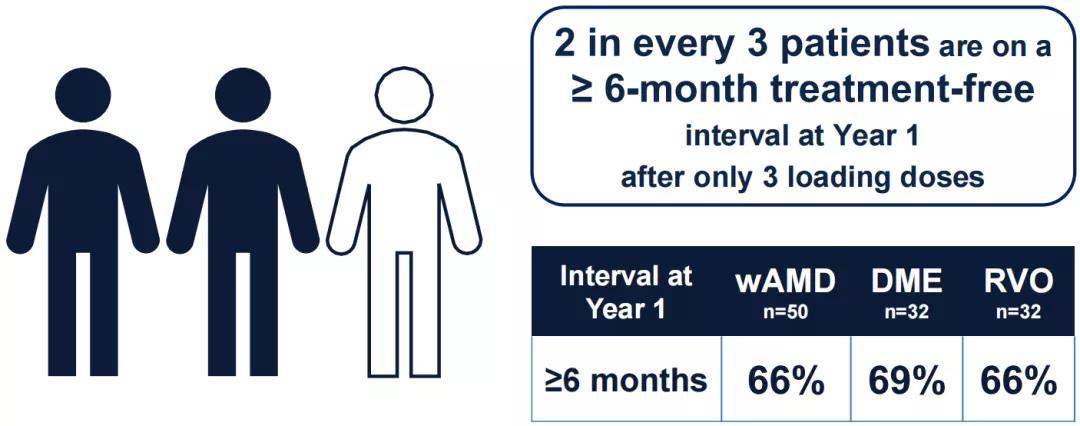
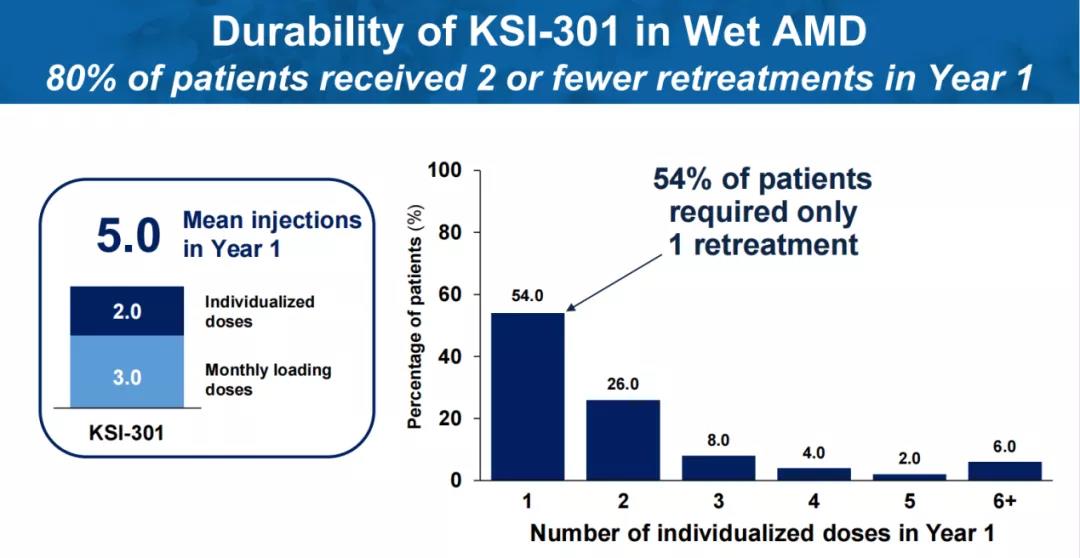
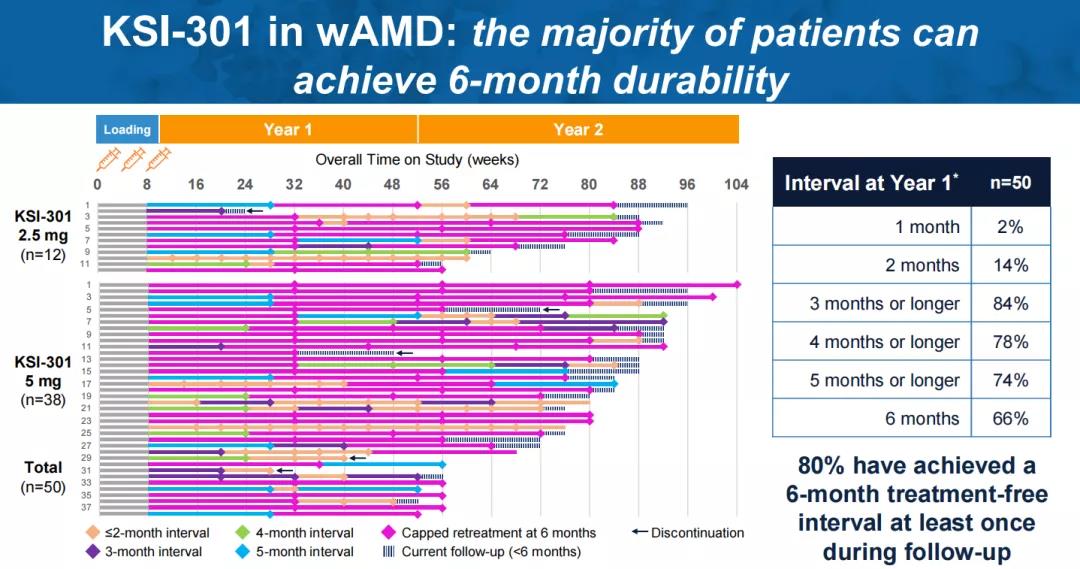
针对湿性年龄相关性黄斑变性(wAMD),在三次负荷剂量后,80%的患者在一年内再次给药不超过2次,54%的患者只需1次再次给药,80%的患者在随访期间至少实现了一次6个月的无治疗间隔。根据ETDRS视力表评估,患者最佳矫正视力较基线平均改善5.7个字母,达到69.7个ETDRS视力表字母(~20/40 Snellen)。
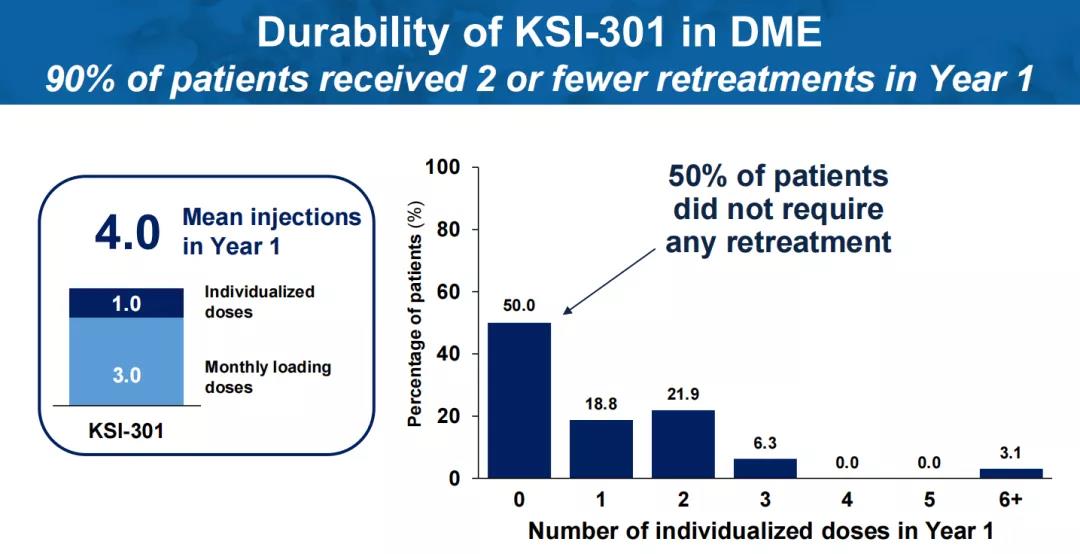
针对糖尿病性黄斑水肿(DME),在三次负荷剂量后,90%的患者在一年内再次给药不超过2次,50%的患者第一年无需再次给药,81%的患者在随访期间至少实现了一次6个月的无治疗间隔。根据ETDRS视力表评估,患者最佳矫正视力较基线平均改善7.6个字母,达到73.9个ETDRS视力表字母(~20/32 Snellen)。
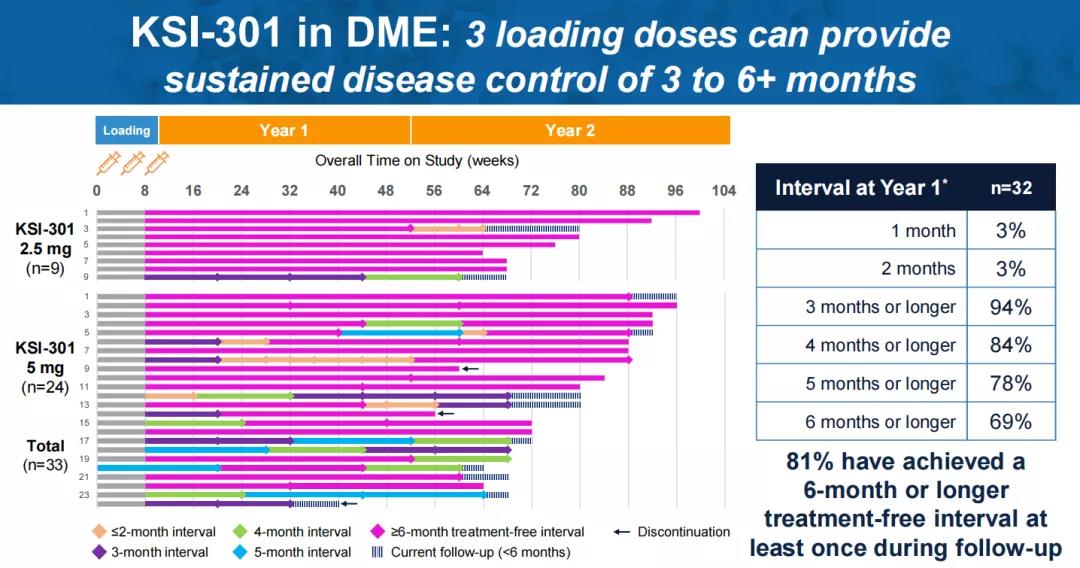
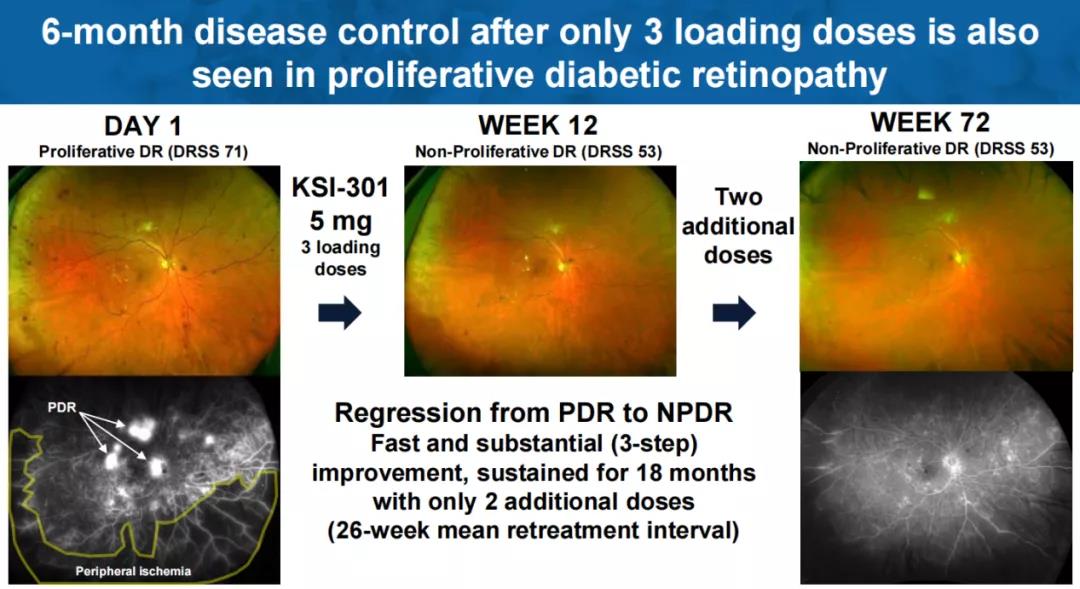
值得一提的是,KSI-301在一例糖尿病视网膜病变(DR)患者身上也实现了6个月的无治疗间隔。在三次负荷剂量后,3个月内,该病例从增殖性糖尿病视网膜病变(PDR)改善为非增殖性糖尿病视网膜病变(NPDR)。再经过2次给药,15个月内仍维持为NPDR。负荷剂量后,平均治疗间隔达到6.5个月。
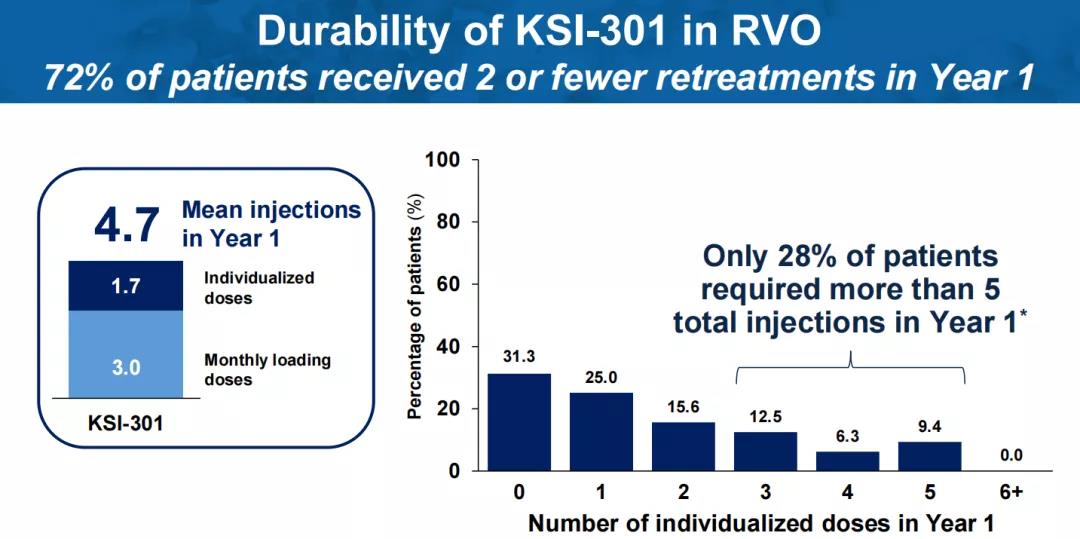
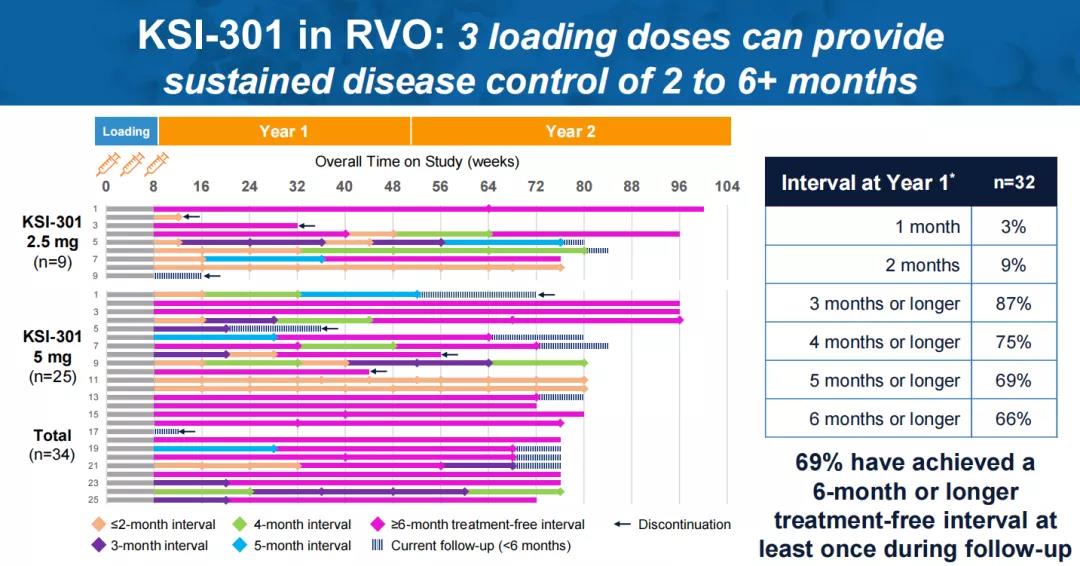
针对视网膜静脉阻塞(RVO),在三次负荷剂量后,72%的患者在一年内再次给药不超过2次,69%的患者在随访期间至少实现了一次6个月的无治疗间隔。根据ETDRS视力表评估,患者最佳矫正视力较基线平均改善22.2个字母,达到76.6个ETDRS视力表字母(~20/32 Snellen)。
图源:Kodiak Sciences
此外,在Kodiak Sciences最新的企业介绍幻灯片中,公司根据已公开数据,将KSI-301、Eylea(aflibercept,阿柏西普)以及罗氏新开发的VEGF-A/Ang-2双抗Faricimab的治疗间隔分布情况和一年平均注射次数进行了“PK”,具体如下。

注:因样本量不同,数据仅供参考
5.Kodiak与Lonza签订KSI-301制造协议
2020年7月,Kodiak Sciences与全球CDMO巨头Lonza宣布建立长期合作,以支持KSI-301未来的商业化制造。根据协议,Lonza将基于其Ibex™ Dedicate服务单元,为Kodiak建造定制的生物聚合物生产设施,Lonza-Kodiak Ibex工厂计划于2022年初完工,每年将达到数百万剂的产能。制造协议的初始期限为8年,公司有权将期限延长至16年。2021年4月,双方对协议进行了修订,计划进一步提高年度生产能力。
财务状况
2021年3月1日,Kodiak Sciences Inc. 公布2020年全年财务状况,截至2020年12月31日,公司的现金、现金等价物和有价证券共9.69亿美元,去年同期为3.48亿美元。主要是由于公司于2020年11月发行股票获得6.12亿美元净收入;研发支出为1.074亿美元,去年同期为3750万美元,主要是由于临床试验费用增加、工资和基于股票的薪酬支出增加以及制造活动增加;一般及行政开支为2860万美元,去年同期为1170万美元,主要是由于工资和基于股票的薪酬支出增加;2020全年净亏损1.331亿美元,去年同期为4740万美元;基本和摊薄后每股净亏损2.91美元,去年同期为1.25美元。
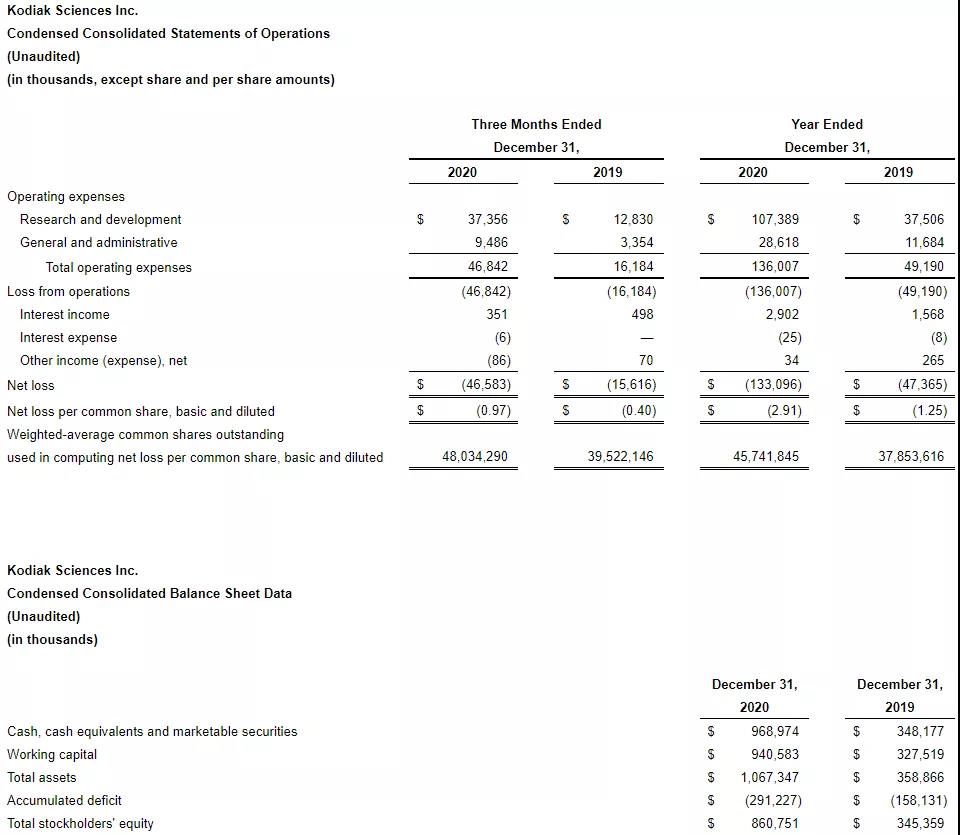
图源:Kodiak Sciences财报
2021年11月9日,Kodiak Sciences Inc. 公布2021年第三季度财务状况,截至2021年9月30日,公司的现金、现金等价物共7.992亿美元,相比于2020年底减少了1.7亿美元;2021年前三季度研发支出为1.417亿美元,去年同期为7003万美元,增加的主要原因是KSI-301临床研究费用增加,工资和基于股票的薪酬支出增加;一般及行政开支为3226万美元,去年同期为1913万美元,也是由于工资和基于股票的薪酬支出增加;公司2021年前三季度净亏损1.738亿美元,去年同期为8651万美元;基本和摊薄后每股净亏损3.36美元,去年同期为1.92美元。
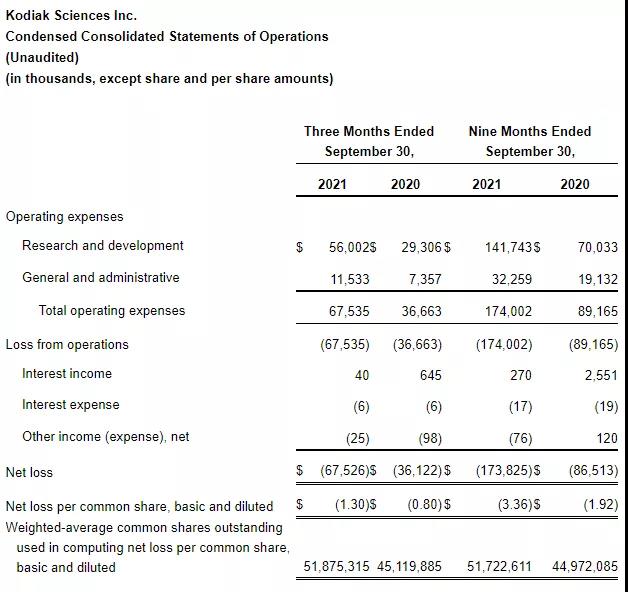
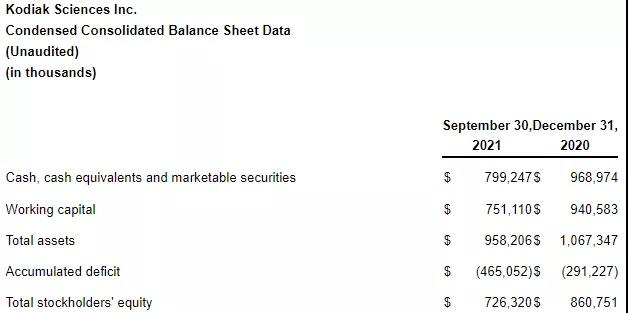
图源:Kodiak Sciences财报
结 语
随着人类社会老龄化程度提高以及人们健康意识不断加强,全球眼科药物市场显示出巨大的潜力。亚太、拉美等地区作为眼科药物新兴市场,未来市场容量有望保持快速增长。同时AMD等老年眼科疾病发病率增加,以及眼科用药细分化,将推动全球眼科药物市场进一步扩容。据统计,2020年全球VEGF抑制剂销售额达到了115亿美元,其中相当大一部分与wAMD、DME和RVO这类视网膜病变的治疗有关。KSI-301若能成功实现商业化,Kodiak Sciences将在这百亿“赛道”中成为一家极具特色与实力的企业。依托公司历经十年打磨的ABC技术平台,兼顾生物相容性、患者顺应性、安全性与疗效,KSI-301将VEGF抑制剂的给药间隔再提高一个台阶,或将挑战当前视网膜血管性疾病的一线治疗方案,成为重磅炸弹药物。手握独创性技术和极具潜力的候选产品,截至2021年11月9日,Kodiak Sciences股价与2018年IPO时相比,已上涨约12倍。目前市值约51.66亿美元(截止2021年11月24日收盘)。
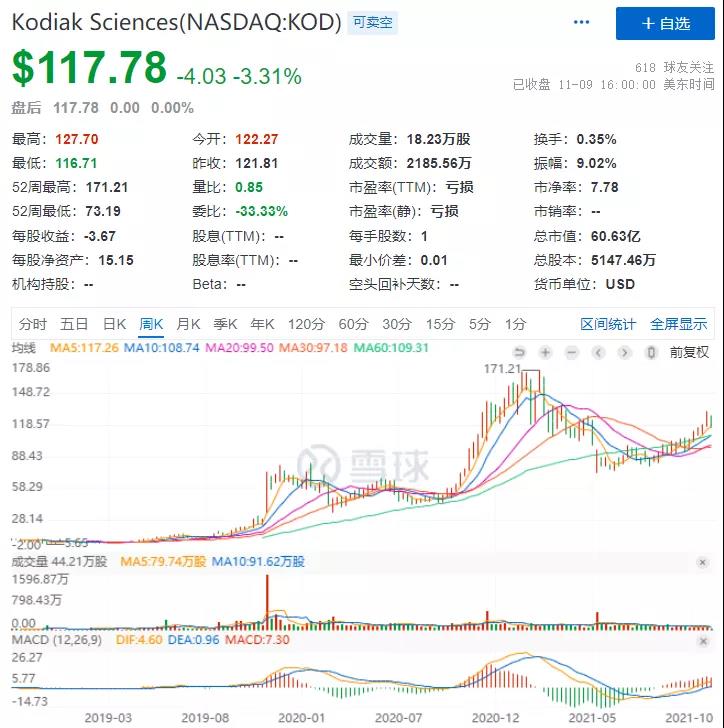
截图自雪球
参考资料:
NMPA/CDE;
药融云数据,www.pharnexcloud.com;
FDA/EMA/PMDA;
相关公司公开披露;
https://kodiak.com/;
Kodiak Sciences官网、财报、招股书;
年龄相关性黄斑变性治疗药物临床研究技术指导原则;
Apte RS. Age-Related Macular Degeneration. N Engl J Med. 2021 Aug 5;385(6):539-547. doi: 10.1056/NEJMcp2102061. PMID: 34347954.;
张开颜, 唐仕波. 干性年龄相关性黄斑变性的研究及治疗进展[J]. 中华眼科杂志, 2015(3):5.;
http://www.chinadrugtrials.org.cn/clinicaltrials.searchlist.dhtml;
https://ir.kodiak.com/news-releases/news-release-details/kodiak-sciences-announces-1-year-durability-efficacy-and-safety;
https://ir.kodiak.com/news-releases/news-release-details/lonzas-ibex-dedicate-support-commercial-manufacture-Kodiaks-ksi;等等。
<END>




















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论