
肿瘤电场治疗:来自以色列的抗癌“黑科技”
肿瘤电场治疗(Tumor Treating Fields, TTFields)是一种新型的非侵入性抗癌疗法,通过皮肤传感器阵列,将低强度(1-3 V/cm)、中频(100-250 kHz)交变电场局部作用于肿瘤部位。该疗法已被证明通过干扰有丝分裂过程,以达到抑制肿瘤增殖的目的。
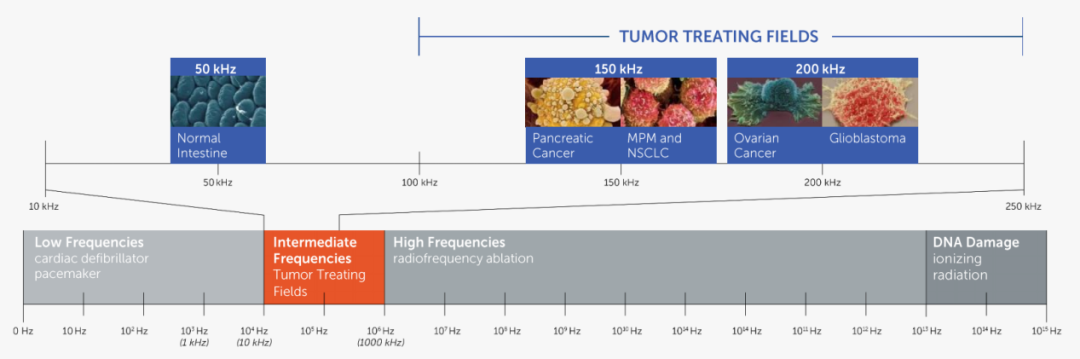
在细胞的有丝分裂过程中,一些重要的蛋白质和蛋白质复合体若受到电场的影响,将无法行使正常功能,如α和β-微管蛋白、异源三聚体蛋白等。这些蛋白质分子内的带电氨基酸残基(偶极子)是不均匀分布的,若暴露于交流电场,则可以抑制它们正常的运动与功能。而且在细胞分裂过程中,纺锤体负责将染色体拉向两极,因纺锤体中的蛋白质一端带正电荷,另一端带负电荷,施用肿瘤电场治疗(TTFields)可干扰纺锤体运动,从而阻断分裂并破坏癌细胞。
施用肿瘤电场治疗前,肿瘤细胞无限分裂、增殖:
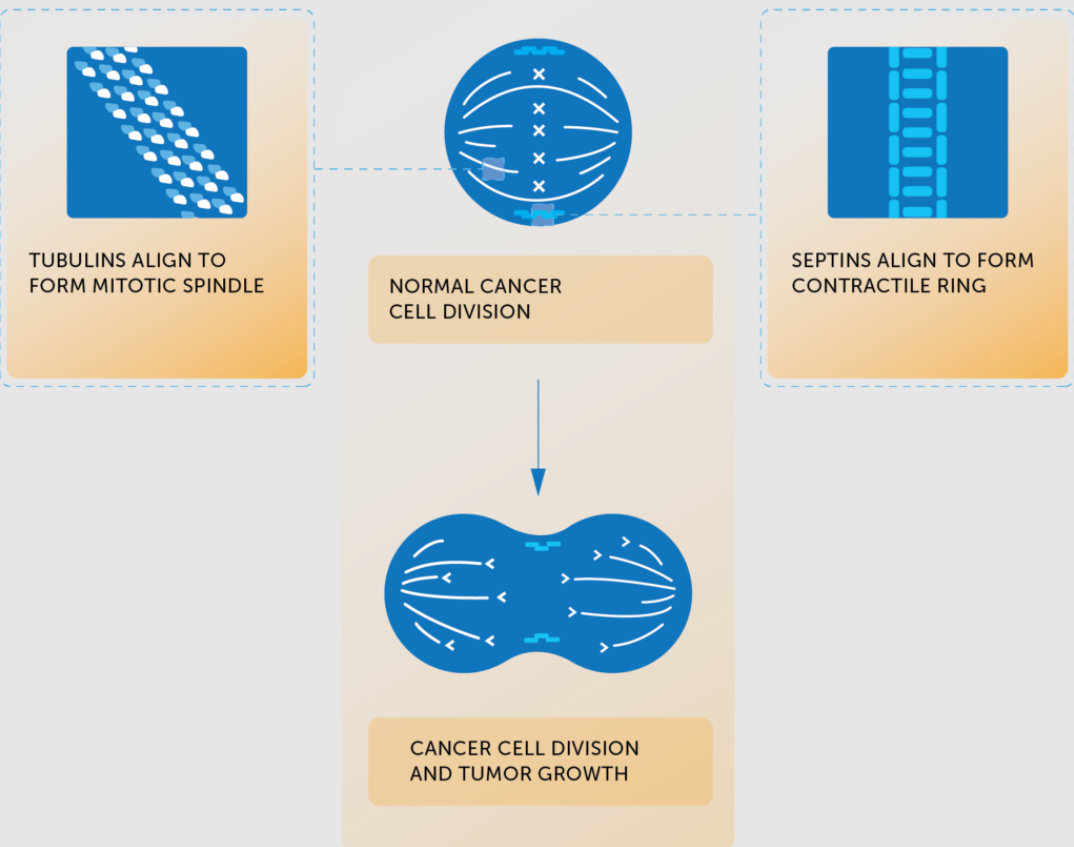
图源:Novocure
施用肿瘤电场治疗后,有丝分裂过程被干扰,最终肿瘤细胞死亡:
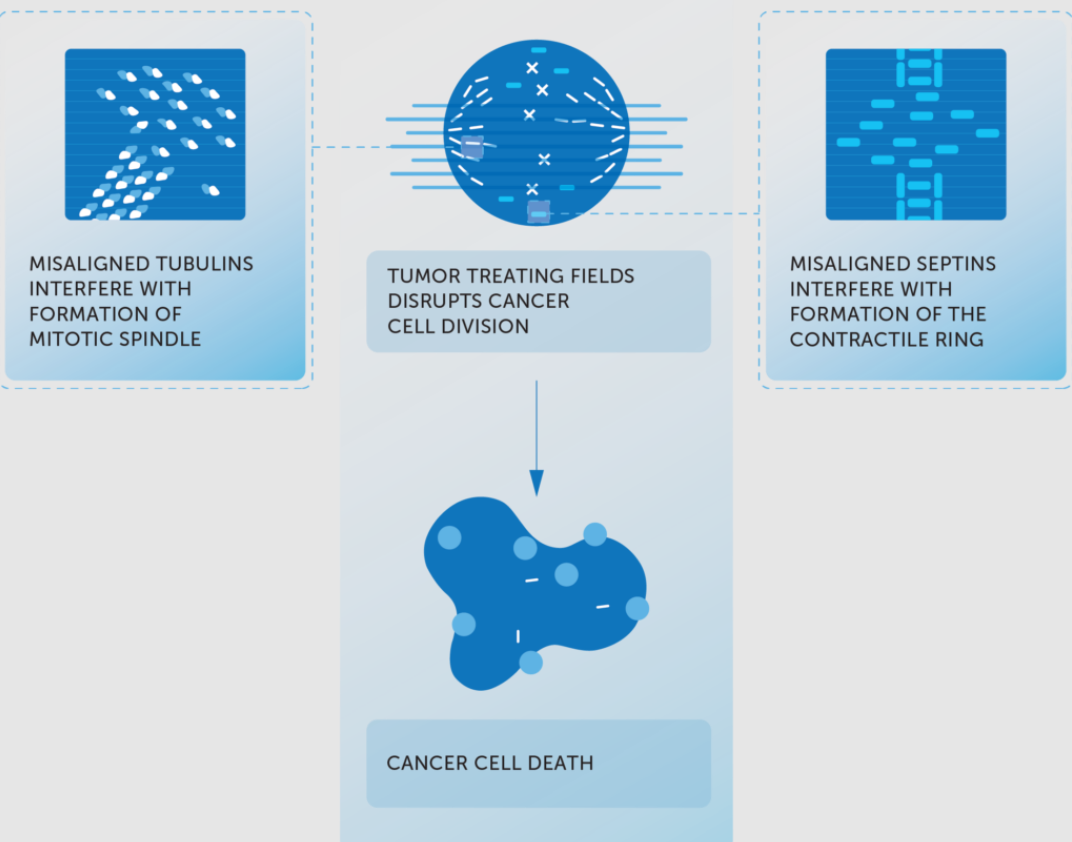
▲ 图源:Novocure
原则上,该疗法对肿瘤细胞具有高度的选择性,尤其是大脑中的肿瘤,因为大多数正常脑细胞在发育完成后便不再增殖。
近年来,有新的发现表明,肿瘤电场治疗除了对抗细胞的有丝分裂过程,还可影响DNA修复、细胞通透性、免疫应答、血脑屏障(BBB)渗透性等一系列生物过程以引发治疗效果,因而具有广泛的作用机制和治疗潜力。
全球首个FDA批准的肿瘤电场治疗疗法来自以色列肿瘤治疗公司Novocure(纳斯达克股票代码:NVCR)。该公司致力于通过其创新肿瘤电场治疗的开发与商业化,以延长那些患有最具侵袭性癌症的患者生存期。目前,Novocure的商业化产品已在一些国家被批准用于治疗成人胶质母细胞瘤和恶性胸膜间皮瘤患者。

Novocure成立于2000年,以色列理工学院的生理学和生物物理学名誉教授Yoram Palti是该公司的创始人兼首席技术官,他是肿瘤电场治疗的首倡者,在许多相关文献的作者列表中他是常客,而常以第一作者身份出现的Eilon Kirson博士曾是Novocure的首席医疗官(2019年5月1日退休)。

▲ Yoram Palti教授
谈到肿瘤电场治疗的早期开发阶段,Yoram Palti教授说道:“没有人明白我在做什么。”当时,他在地下室建立了一个实验室,以探索电场治疗实体瘤的潜力。事实证明,Palti教授团队的努力坚持是正确的,他们为肿瘤学领域带来了一种完全不同的治疗方法。当初在地下室获得的研究成果目前已经发展成为一家在美国、欧洲和亚洲拥有1000多名员工和业务的全球性肿瘤治疗公司。
2011年4月,美国FDA首次批准Novocure开发的临床肿瘤电场治疗设备,商品名现为Optune(原为NovoTTF-100A系统),用于治疗复发性胶质母细胞瘤(GBM)患者。早期临床前数据表明,肿瘤电场治疗在动物肿瘤模型中能阻止肿瘤细胞增殖,并且当与化疗联合使用时具有附加治疗效果。在首次人体研究中,肿瘤电场治疗针对多种癌症显示出积极结果。2004年,一项先导临床试验启动(EF-07),对20名复发和新诊断的GBM患者进行了验证,证实了用肿瘤电场治疗GBM的可行性。截至2012年,来自先导研究的4名患者仍然幸存。随后开展的3期EF-11试验证明了肿瘤电场治疗对复发性GBM的有效性和安全性,这也是FDA首次批准肿瘤电场治疗的依据。
5年生存率翻倍,肿瘤电场治疗被写入官方治疗指南
EF-14试验是一项具有里程碑意义的研究,该研究是10年来首个证明肿瘤电场治疗能为新诊断的胶质母细胞瘤(GBM)患者带来生存获益的大规模随机临床试验(NCT00916409)。该试验在2009年7月至2014年11月期间在美国、加拿大、欧洲、以色列和韩国的83个中心入组了695例患者。患者入组前已接受最大程度的手术切除,完成放化疗后,患者被随机分配接受肿瘤电场治疗+替莫唑胺(Temozolomide,TMZ)联合治疗(n = 466),或单独接受替莫唑胺(TMZ)维持治疗(n = 229),两组患者从诊断到随机分组的中位时间均为3.8个月。
EF-14中期分析
中期分析包括105例随机接受TMZ单药治疗的患者,以及210例随机接受TTFields + TMZ联合疗法的患者。中位随访38个月(范围18-60个月)后,TMZ单药治疗组患者的中位无进展生存期(mPFS)为4.0个月(95% CI,范围3.3-5.2个月),而TTFields+ TMZ组的mPFS达到了7.1个月(95% CI,范围5.9-8.2个月),因此,在TMZ治疗中加入肿瘤电场治疗可使意向治疗(ITT)患者mPFS延长3.1个月;
在两个试验组中移除了未开始第二个疗程TMZ维持治疗、换组治疗、或严重违背试验方案的患者后,根据遵循研究方案(PP)分析,TMZ单药治疗组(n = 84)中位总生存期(mOS)为15.6个月(95% CI,13.3-19.1个月),TTFields + TMZ组(n = 196)的mOS则达到20.5个月(95% CI,16.7-25.0个月);
此外,在入组之后,TMZ组患者的两年生存率为29%,TTFields + TMZ组两年生存率达到了43%。该中期分析结果于2015年12月发表于JAMA(doi:10.1001/jama.2015. 16669)。

▲ 截图自JAMA
中期结果表明肿瘤电场治疗使患者显著获益,这显然鼓舞人心,因此该试验的独立数据监察委员会建议提前终止试验,FDA批准修改试验方案,允许向试验中所有患者提供肿瘤电场治疗。更重要的是,肿瘤电场治疗不会引起全身性副作用,观察到的不良反应仅为长期接触传感器阵列而引起的局部皮肤反应,显示出肿瘤电场治疗与其他疗法联用的潜力以及协同效应。2015年10月,美国FDA正式批准了Novocure的临床肿瘤电场治疗设备Optune(原名NovoTTF-100A)用于治疗新诊断的胶质母细胞瘤(GBM)患者。
EF-14最终分析
2017年12月,EF-14试验的最终分析结果同样发表于JAMA(doi:10.1001/jama.2017. 18718),与中期分析相一致。在中位随访40个月后,TMZ单药治疗组mPFS为4.0个月,而TTFields + TMZ组mPFS达到了6.7个月;TMZ单药治疗组mOS为16.0个月,TTFields + TMZ组的mOS则在此基础上增加了4.9个月,达到20.9个月。探索性分析显示,TMZ单药治疗组的患者两年和五年生存率分别为31%和5%,而TTFields + TMZ组患者的两年和五年生存率分别为43%和13%。
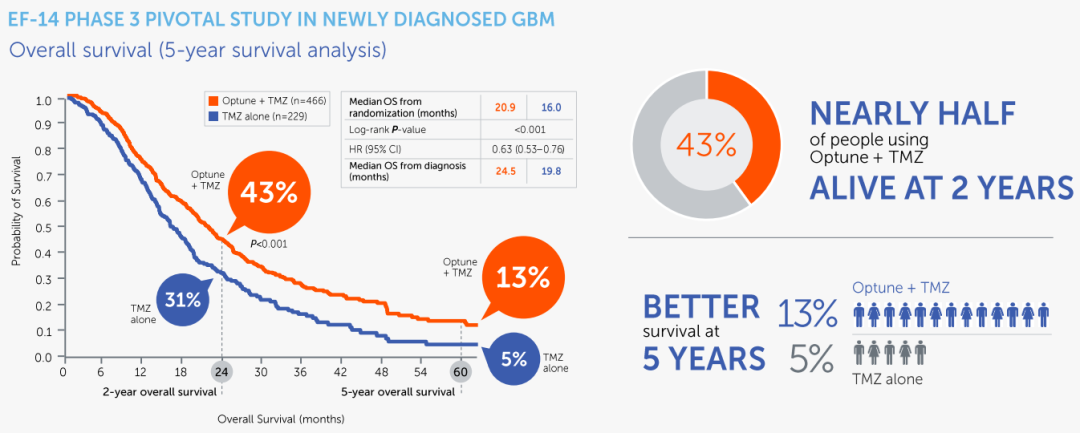
▲ 图源:Novocure
这些喜人的结果也促使美国国立综合癌症网络(NCCN)临床实践指南1类推荐,将TTFields + TMZ联合疗法作为新诊断胶质母细胞瘤(GBM)的标准治疗方案。
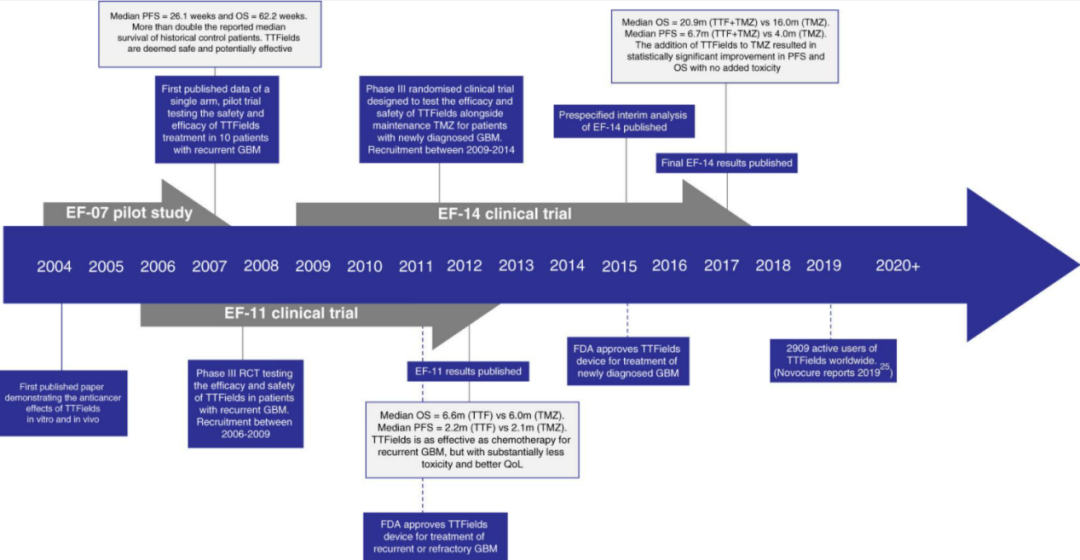
▲ 肿瘤电场治疗作为GBM患者治疗方案的时间轴
图源:Br J Cancer(doi: 10.1038/s41416-020-01136-5)
Novocure的临床肿瘤电场治疗设备Optune由两个主要部件构成:一个电场发生器,以及分布在四块胶布上的绝缘传感器阵列。该系统通过将传感器阵列贴附于患者的头皮上,以将肿瘤部位暴露于交变电场。由于使用该设备通常需要患者剃光头发,出于美观考虑,患者可能会用围巾、帽子或假发隐藏设备。同时,该设备可以直接接通电源使用,也可连接可充电式电池来供电。此外,传感器阵列是否放置准确密切影响着肿瘤电场的治疗效果,为此Novocure开发了NovoTAL软件系统,可根据患者的头部大小、肿瘤位置和磁共振成像数据,针对患者肿瘤的具体特征,优化传感器阵列布局。下图为第二代Optune设备,与第一代相比减轻了设备重量,提高了操作效率,从而改善患者治疗体验。

▲ 图源:Novocure
目前,Optune已在美国被批准用于复发性(作为单一疗法)和新确诊(与替莫唑胺化疗联合)的多形性胶质母细胞瘤(GBM)成人患者,该装置已在欧洲获得了CE认证,并在日本获得“免临床上市”批准,用于相同的适应症。肿瘤电场治疗与化疗的联合使用也已在欧洲获得了CE认证,并已在FDA人道主义器械豁免(HDE)途径下获批准用于恶性胸膜间皮瘤(MPM)成人患者。同时,国家卫健委《脑胶质瘤诊疗规范(2018年版)》也推荐肿瘤电场疗法用于新发胶质母细胞瘤(1级证据)和复发高级别脑胶质瘤(2级证据)的治疗。截至2022年1月,全球范围内已经有超过22000例患者接受了Optune的治疗。
再鼎医药获肿瘤电场治疗大中华区独家授权
2018年9月,Novocure与再鼎医药宣布达成战略合作,根据协议,再鼎医药获得了Novocure的肿瘤电场治疗设备(包括Optune®品牌)在大中华区(中国大陆、香港、澳门和台湾地区)的独家授权许可,并与Novocure合作推进针对多个实体瘤的临床试验。

2018年,Optune设备在香港上市,中文名:爱普盾®。2020年5月,国家药品监督管理局(NMPA)批准爱普盾®上市,用于与替莫唑胺联用治疗新诊断的胶质母细胞瘤患者,以及作为单药疗法用于治疗复发性胶质母细胞瘤患者。爱普盾®是15年来首个在中国内地获批用于胶质母细胞瘤的创新疗法,也是再鼎医药在中国内地获批的第二个产品。

截至2021年11月,爱普盾已被列入25个省级或市级政府指导的区域定制商业健康保险计划(或补充保险计划)。2021年前三季度,再鼎医药爱普盾在大中华区的销售收入为2731.8万美元(约1.7亿人民币,全年销售额达3,890万美元)。
肿瘤电场治疗开发路径:探索多种实体瘤治疗潜力
目前,肿瘤电场治疗在全球开展了多项临床试验,适应症涵盖复发/新诊断的胶质母细胞瘤、胸膜间皮瘤、非小细胞肺癌、非小细胞肺癌脑转移、胰腺癌、卵巢癌、肝细胞癌、胃腺癌。其中有5项试验已处于临床开发的后期阶段。如果进展顺利,预计到2024年将新获批4项适应症。
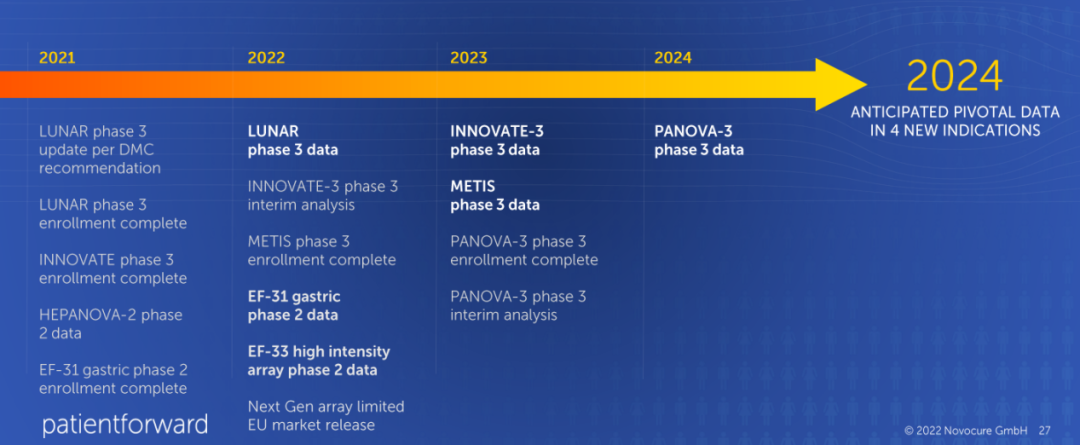
此外,Novocure还针对多个瘤种开展了临床前研究,包括:乳腺癌、宫颈癌、结直肠癌、室管膜瘤、纤维组织细胞瘤、胶质肉瘤、恶性黑色素瘤、髓母细胞瘤、脑膜瘤、骨肉瘤、肾细胞癌、小细胞肺癌、膀胱移行细胞癌、葡萄膜黑色素瘤。
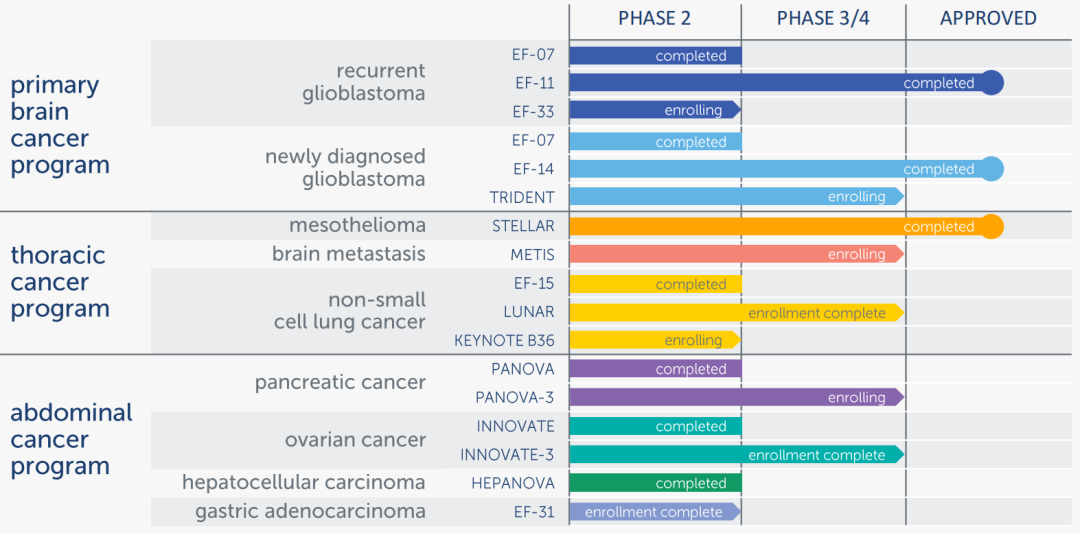
▲ Novocure临床阶段Pipeline
信息更新至2022年2月
非小细胞肺癌
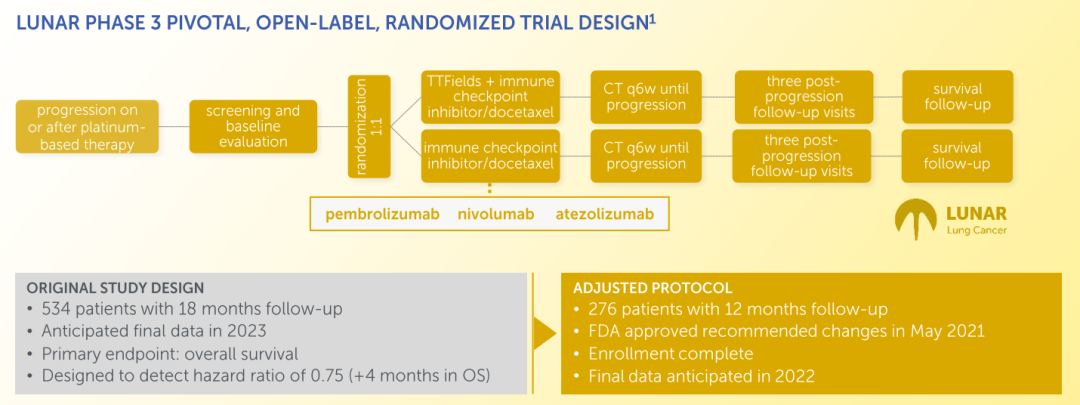
LUNAR试验是一项随机、开放标签的关键3期临床试验,旨在研究Novocure的临床肿瘤电场治疗系统NovoTTF-200T设备(150 kHz)在接受含铂类化疗方案治疗期间或之后出现疾病进展的4期非小细胞肺癌患者中的安全性与疗效。该试验在全球124个中心入组了276例患者,主要终点是肿瘤电场治疗联合免疫检查点抑制剂或多西他赛(Docetaxel)治疗的患者总生存期(OS)优于单独使用免疫检查点抑制剂或多西他赛治疗(标准治疗方案)的患者。患者将接受12个月的随访,预计到2022年底将获得顶线数据。
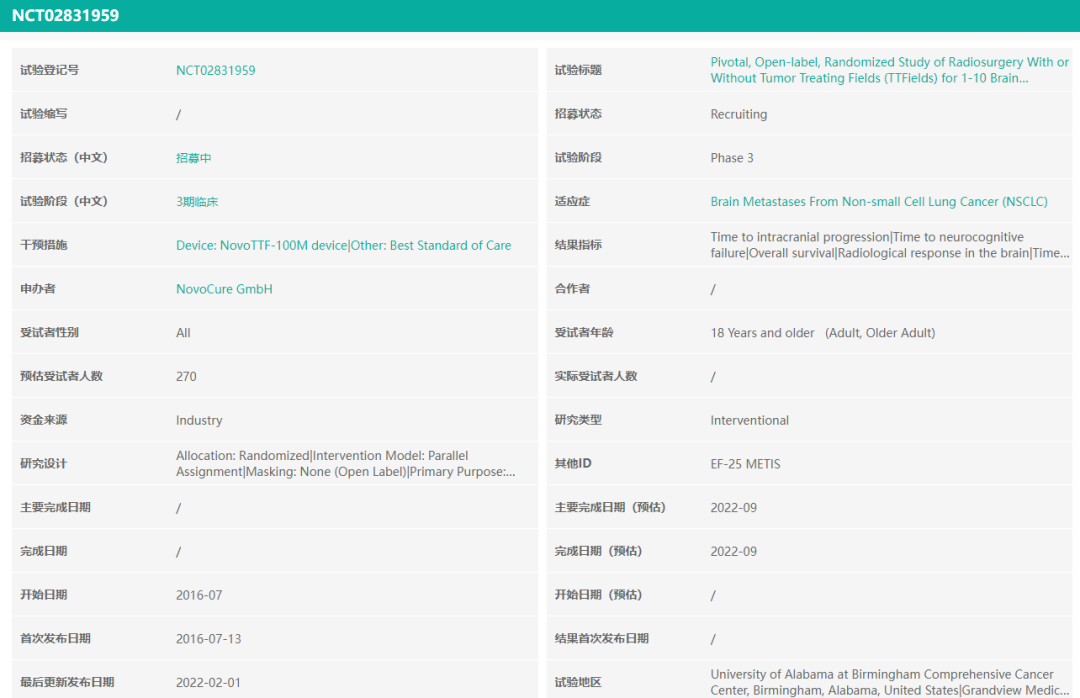
METIS试验也是一项随机、开放标签的关键3期临床试验,旨在研究肿瘤电场治疗系统NovoTTF-200M设备在非小细胞肺癌脑转移患者中的安全性、疗效、以及神经认知结局。药融云数据(https://www.pharnexcloud.com/?zmt-mhwz)显示,该试验计划入组270例患者,公司预计将于2023年公布最终数据。
2021年4月,美国FDA批准了公司的一项IDE申请,允许开展一项2期KEYNOTE B36试验(EF-36)。该试验由Novocure与默沙东合作开展,旨在评估肿瘤电场治疗系统NovoTTF-200T设备(150 KHz)联合Keytruda(帕博利珠单抗)一线治疗晚期非小细胞肺癌的安全性与疗效。
卵巢癌
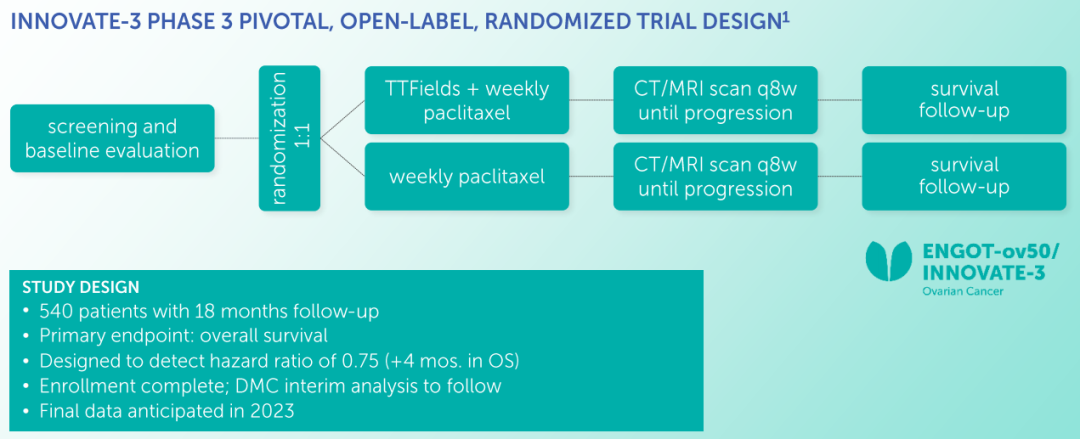
INNOVATE-3试验是一项随机、开放标签的关键3期临床试验,旨在研究肿瘤电场治疗系统NovoTTF-100L(O)设备(200 kHz)联合每周一次紫杉醇治疗铂耐药复发性卵巢癌患者的安全性与疗效。2021年10月,该试验最后一例患者完成入组,共入组540例患者。欧洲妇科肿瘤试验组织网络(ENGOT)、妇科肿瘤联盟(GOG)基金会以及Novocure共同开展这项研究。公司预计独立数据监察委员会(DMC)将在2022年第二季度初进行中期分析,若进展顺利,最终数据预计将于2023年公布。
胰腺癌
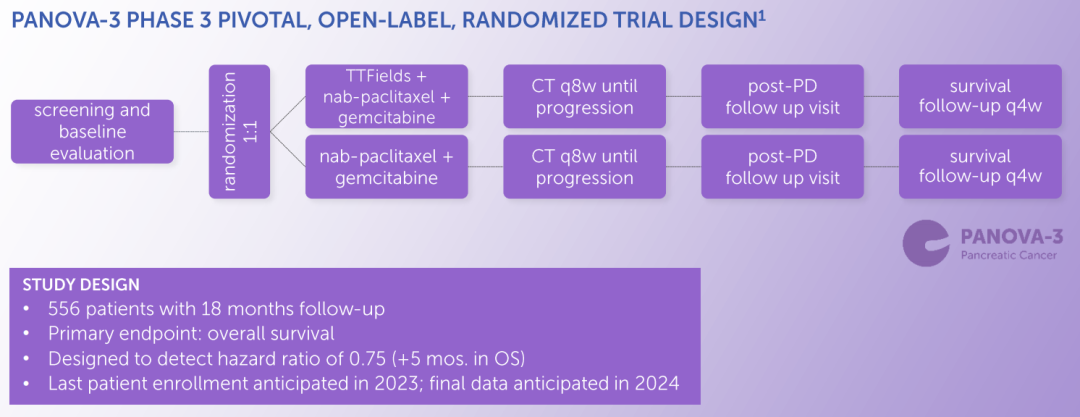
PANOVA-3试验是一项随机、开放标签的关键3期临床试验,旨在研究肿瘤电场治疗系统NovoTTF-100L(P)设备(150 kHz)联合吉西他滨(Gemcitabine)以及紫杉醇(白蛋白结合型)用于一线治疗局部晚期胰腺癌的安全性与疗效。不过Abraxane(注射用紫杉醇[纳米蛋白颗粒结合型])的供应短缺将对临床试验中的化疗造成影响。该试验预计将于2023年完成最后一例患者入组,最终数据预计将于2024年公布。
2021年9月,Novocure与罗氏达成一项临床试验合作协议,共同探索肿瘤电场治疗与罗氏的抗PD-L1单抗Tecentriq(阿特珠单抗,Atezolizumab)联合治疗转移性胰腺导管腺癌(mPDAC)的潜力。两家公司计划开展一项2期临床试验,以评估肿瘤电场治疗联合阿特珠单抗以及吉西他滨和白蛋白紫杉醇一线治疗mPDAC的安全性与疗效,计划在美国和欧洲招募约75例患者。
胶质母细胞瘤
2020年,Novocure开启了一项名为TRIDENT(EF-32)的全球4期临床试验,旨在评估Optune®(200kHz)设备与放射治疗(RT)以及替莫唑胺(TMZ)联合治疗新诊断的胶质母细胞瘤(GBM)患者的安全性与疗效。当前的GBM治疗路径是在肿瘤切除手术、术后放疗完成后,在TMZ维持治疗之时才开始施用肿瘤电场治疗,而该研究的实验组将在肿瘤切除手术之后,术后放疗之时就开始施用肿瘤电场治疗,并评估与标准治疗方案相比,在较早阶段就开始施用肿瘤电场治疗能否改善患者临床结局。该研究主要终点是患者总生存期(OS),计划在全球的129个研究中心招募950例患者,预计主要完成时间为2024年8月。

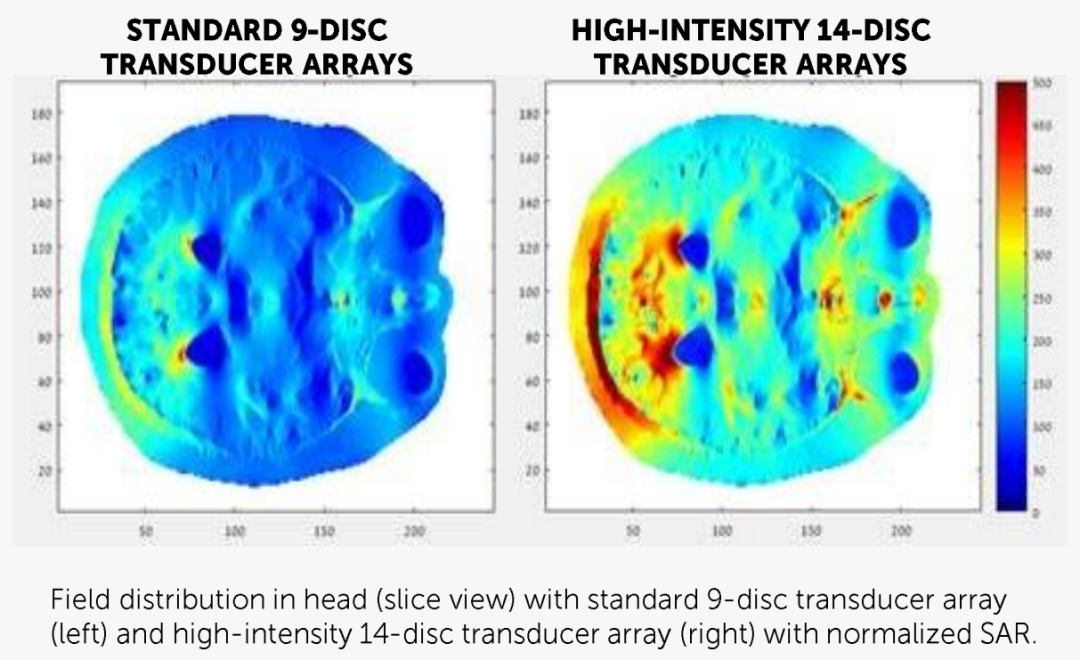
除此之外,Novocure还开展了一项2期EF-33试验,该试验旨在评估Novocure新开发的装有高密度传感器阵列的Optune®设备在复发性GBM患者中的安全性和有效性。Optune®设备的一个标准传感器阵列包含9个传感器,而一个高密度传感器阵列包含14个传感器。新的传感器阵列有望减少皮肤发热,从而能够提高肿瘤电场治疗的强度以改善患者预后,同时保证安全性。预计该试验最终数据将于2022年公布。
2021年5月,Novocure与脑瘤手术靶向疗法研发商GT Medical达成一项临床试验合作协议,共同探索Novocure的肿瘤电场治疗联合GT Medical的GammaTile手术靶向放疗(STaRT)治疗复发性胶质母细胞瘤的潜力。两家公司计划开展一项2期临床试验,以检验在复发性GBM患者GammaTile手术靶向放疗前施用新辅助肿瘤电场治疗,并在之后进行辅助肿瘤电场治疗的安全性与有效性,计划在美国招募约55例患者,主要研究终点是患者的无进展生存期(PFS)。
肝 癌
2021年7月,Novocure公布了2期HEPANOVA试验的最终结果。该试验研究了肿瘤电场治疗系统NovoTTF-100L(P)设备(150 kHz)联合索拉非尼(Sorafenib)治疗晚期肝细胞肝癌(HCC)的疗效与安全性。历史对照数据显示,单独使用索拉非尼治疗的患者客观缓解率(ORR)为4.5%,疾病控制率(DCR)为43%。在该试验中,那些预后不良、治疗时间有限的患者ORR为9.5%,DCR为76%(中位无进展生存期5.8个月,高于索拉非尼单药治疗);而那些完成至少12周肿瘤电场治疗的患者ORR为18%,DCR为91%,该结果令人鼓舞,表明肿瘤电场治疗可在不增加副作用的情况下延长晚期肝癌患者的生存期。3期关键临床试验正在设计中,考虑将肿瘤电场治疗与标准治疗方案联用(包括免疫治疗)。
2021年9月FDA授予Novocure的肿瘤电场治疗系统NovoTTF-200T™突破性医疗器械资格(Breakthrough Device Designation)认定,用于与阿特珠单抗(Atezolizumab)和贝伐珠单抗(Bevacizumab)联用一线治疗不可切除或转移性肝癌。
胃 癌
2021年10月,2期EF-31试验(ZL-8301-001)完成最后一例患者入组。该研究由Novocure与再鼎医药联合开展,旨在评估肿瘤电场治疗系统NovoTTF-100L(P)设备(150 KHz)联合XELOX化疗方案(奥沙利铂+卡培他滨)一线治疗不可切除的局部晚期或转移性胃食管交界处癌或胃腺癌(GEJ/GC)患者的安全性与疗效。该试验最终数据预计将于2022年公布。
财务状况
目前在美国,Novocure向患者提供Optune的每月总价格约为21000美元(具体取决于医疗提供者/支付者协商的折扣,全球其他市场的价格大致与此相当,视汇率波动而定),治疗费用涵盖全套设备、患者/医生培训和24小时技术支持。额外费用可能包括具体治疗所需的额外人员安排与培训,以及治疗相关疾病的管理费用。
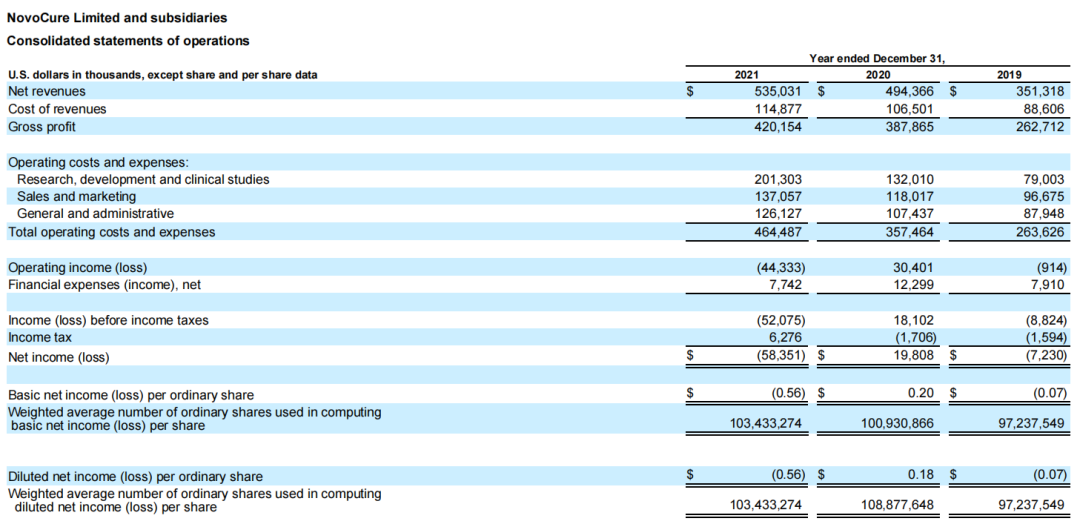
2022年2月24日,Novocure公布2021年全年财务业绩,据披露,公司全年净收入5.35亿美元,同比增长8%;研发投入达到了创记录的2亿美元。截至2021年12月31日,共有3587例活跃患者接受治疗,同比增长5%;截至2021年12月31日,Novocure拥有现金、现金等价物和短期投资共9.377亿美元。
结 语
当肿瘤电场治疗最开始进入大众视野的时候,不少人质疑这样的疗法会不会又是一门“伪科学”,但经过长期的试验和深入研究,肿瘤电场治疗的原理与机制已经越来越清晰。近年来的发现表明,肿瘤电场治疗除了对抗细胞的有丝分裂过程,还可影响DNA修复、细胞通透性、免疫应答、血脑屏障(BBB)渗透性等一系列生物过程以引发治疗效果。当前,肿瘤免疫疗法研发火热,但大都难以在实体瘤领域实现突破;而肿瘤电场治疗已在多种实体瘤中显示出了积极的效果,可以说是一种新型的,几乎无副作用的治疗手段。值得一提的是,目前肿瘤电场治疗的费用高达每月2.1万美元,这对许多肿瘤患者来说是难以负担的,如果能在探索多种支付方式,降低治疗费用等方面努力,这样的“黑科技”将能惠及更多的患者。药融云数据数据显示,国内本领域开发企业有海莱新创,安泰康成等等。
参考:
NMPA/CDE;
药融云数据:https://www.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
Novocure公司公开披露;
Rominiyi, Ola et al. “Tumour treating fields therapy for glioblastoma: current advances and future directions.” British journal of cancer vol. 124,4 (2021): 697-709. doi:10.1038/s41416-020-01136-5;
Stupp R, Taillibert S, Kanner AA, et al. Maintenance Therapy With Tumor-Treating Fields Plus Temozolomide vs Temozolomide Alone for Glioblastoma: A Randomized Clinical Trial. JAMA. 2015;314(23):2535–2543. doi:10.1001/jama.2015.16669;
Stupp R, Taillibert S, Kanner A, et al. Effect of Tumor-Treating Fields Plus Maintenance Temozolomide vs Maintenance Temozolomide Alone on Survival in Patients With Glioblastoma: A Randomized Clinical Trial. JAMA. 2017;318(23):2306–2316. doi:10.1001/jama.2017.18718;
https://www.nature.com/articles/d42473-018-00156-3;
国家卫健委《脑胶质瘤诊疗规范(2018年版)》;
https://www.Novocure.com/;
https://www.zailaboratory.com/;等等。
想要解锁更多药企信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企产品布局、研发阶段、临床试验信息、药物销售情况、投融资情况、年报与前景,可否投资!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论