
受国家政策导向和临床需求导向,近几年,国内关注儿童药的企业越来越多,但儿童药物开发的难度远大于成人,企业应该充分评估可能的项目风险。
ICH E11(R1)儿科人群药物临床研究指导原则指出:任何儿童药物开发阶段的核心原则是除非有必要实现的重要的儿科公共健康需求,否则儿童不应被纳入临床研究。因此,必须评估风险和可能的临床益处之间的平衡,保障儿童不用受到临床研究的不利影响。
研发难度大,投资获益比例低,是导致目前全球儿童药短缺的原因。国际人用药品注册技术协调会(ICH)最新更新了“在儿科人群中进行药品安全、有效和合乎伦理研究的方法”,鼓励和支持企业以一种“儿童友好”的方式进行儿童药物的开发。并且各国监管机构也制定了相应的鼓励儿童药物开发的策略以及发布多项儿童药物开发的指导原则,下表为FDA、EMA以及NMPA发布的儿科药物研究指南。


构建模型的方式可以解决部分儿童药物研究的问题,其中包括生物制药分类系统模型(BCS),药代动力学-药效学模型等,模型研究还可用于“临床试验模拟、剂量选择、研究设计的选择和优化、终点选择和儿科外推”。
儿科人群不是一个单一的人群,按照年龄段可分为早产儿,足月新生儿/新生儿(0-27天),婴幼儿/学步儿童(28天- 2岁),儿童(2-11岁)和青少年(11-16或18岁),因此儿童药物开发时需要考虑适合年龄的处方,降低剂量错误的风险并可以最大化提高药品疗效,另外还应该考虑制剂的便利性和护理人员使用、可接受性(例如适口性和片剂大小)、辅料的选择和数量、以及使用可选择的给药系统和适当的包装。
儿童常用剂型口服溶液剂以及肠外制剂,会涉及到防腐剂的使用,而防腐剂本身就是一种细胞毒性物质,在儿童药物中的应用一直备受争议,另外掩味剂在儿童剂型的应用较多,有些成人安全可用的掩味辅料,对儿童会产生危险。
各国药品监管机构均对儿童药物开发制定了激励措施,以FDA为例,儿科药物独占权为启动儿科临床研究的药品提供额外六个月的市场排他期或专利保护,《最佳儿童药物法案》(BPCA)还制定了一项支持仿药物在儿科应用研究的措施,采用额外市场权益的形式支持非儿科应用仿制药在儿科应用中的研究。另外FDA认识到儿科药物审批过程的复杂性,针对这类药物会制定特殊审批途径,以2019年上市治疗SAM的基因治疗药物Zolgensma为例,在美国审批过程曾获得多项特殊审评:罕见儿童药(RPDD)、快速通道、孤儿药、优先审评以及突破性治疗。下图为Zolgensma在美国获得特殊审评的指定流程。
图1:Zolgensma在美国获得特殊审评的指定流程
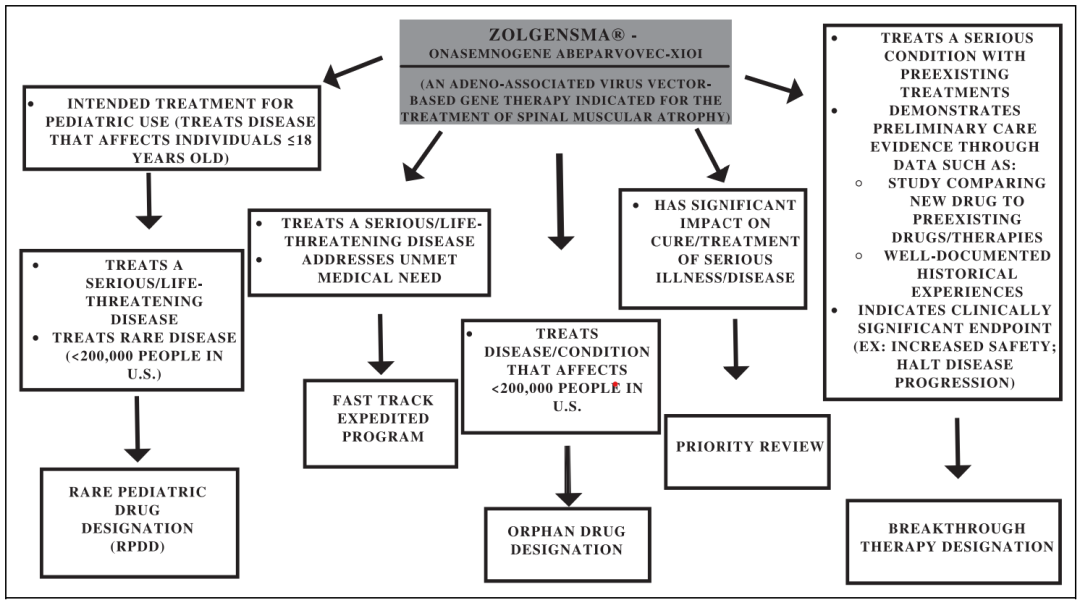
目前国内NMPA针对儿童药物,制定了审评方面的激励措施例如将儿童用药的申报项目均纳入优先审评审评,而其他市场方面并没有实质上的激励措施出台。
儿童是国家的未来,儿科药物对儿童的健康至关重要,儿童不是小大人,成人药物的剂型或剂量,虽然通常适用于青少年,但往往完全不适合早产儿,新生儿,婴幼儿和儿童,开发“适合年龄”的儿童药品任重道远。
参考文献:
1. ICH E11(R1) guideline on clinical investigation of medicinal products in the pediatric population. Step 5. European Medicines Agency.(2021)
2. Guidance for industry. qualifying for pediatric exclusivity under section 505A of the federal food, drug, and cosmetic act. US Food and Drug Administration.(2021)
3. BPCA Best Pharmaceuticals for Children Act.(2021)
4. US Food and Drug Administration Facilitated Pediatric Approval Programs: Application to
Pediatric Neurological Disorders. (2022)
5. pediatric drug development in china:reforms and challenges. (2019)
6. Pediatric Drug Development: Key Considerations and Challenges. (2021)
<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论