
引言
2016年12月13日,时任美国总统巴拉克·奥巴马签署了《21世纪治愈法案》,癌症登月计划作为该法案的关键部分,在7年内获得18亿美元的资金,旨在促进癌症治疗新方法的开发,特别是基于特定致癌驱动因素的免疫疗法和分子靶向和肿瘤不可知疗法。在这些年里FDA审批药物疗法的方式也发生了改变,发表在NATURE子刊nature reviews clinical oncology上的一篇文章评估了近5年FDA批准的实体瘤疗法,总结了这些年批准的特征和趋势。

新疗法获批速度加快
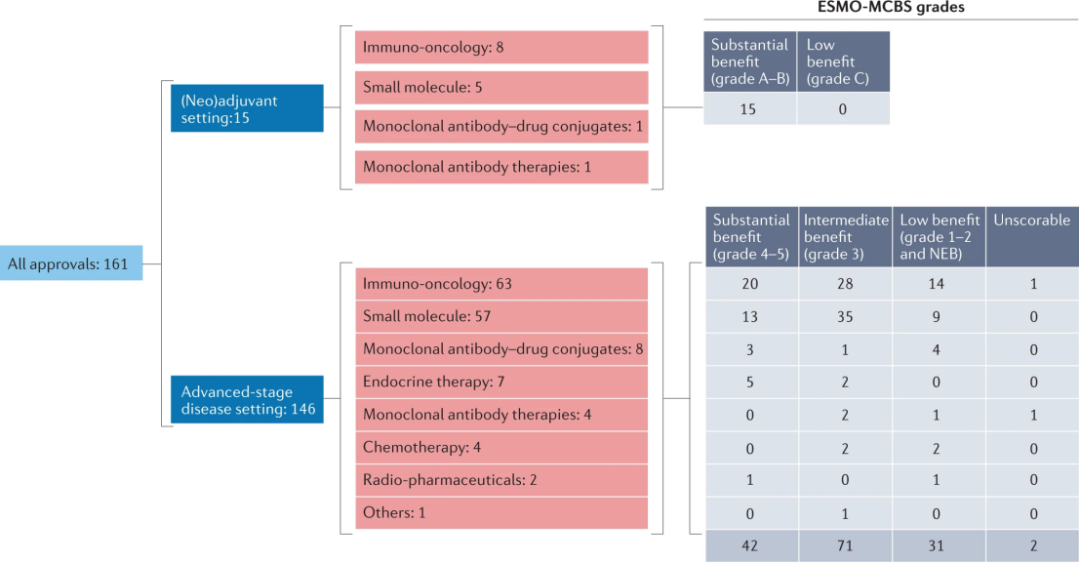
2017-2021年FDA共批准了161项成人实体瘤疗法(平均每年32.2项),与2002年至2014年的13年期间的71项(平均5.5每年)相比,新疗法的开发速度加快了5倍。已经批准的申请里包括119个常规批准和42个加速批准。这些批准包括71种不同的药物(包括新药和已上市的药物),许多药物获得了不止一种适应症的许可。
批准的药物多为免疫治疗药物和小分子药物,仅有11项为化疗用药(n=4;2.5%)或内分泌治疗(n=7;4.3%)。
免疫疗法肿瘤药获批最多
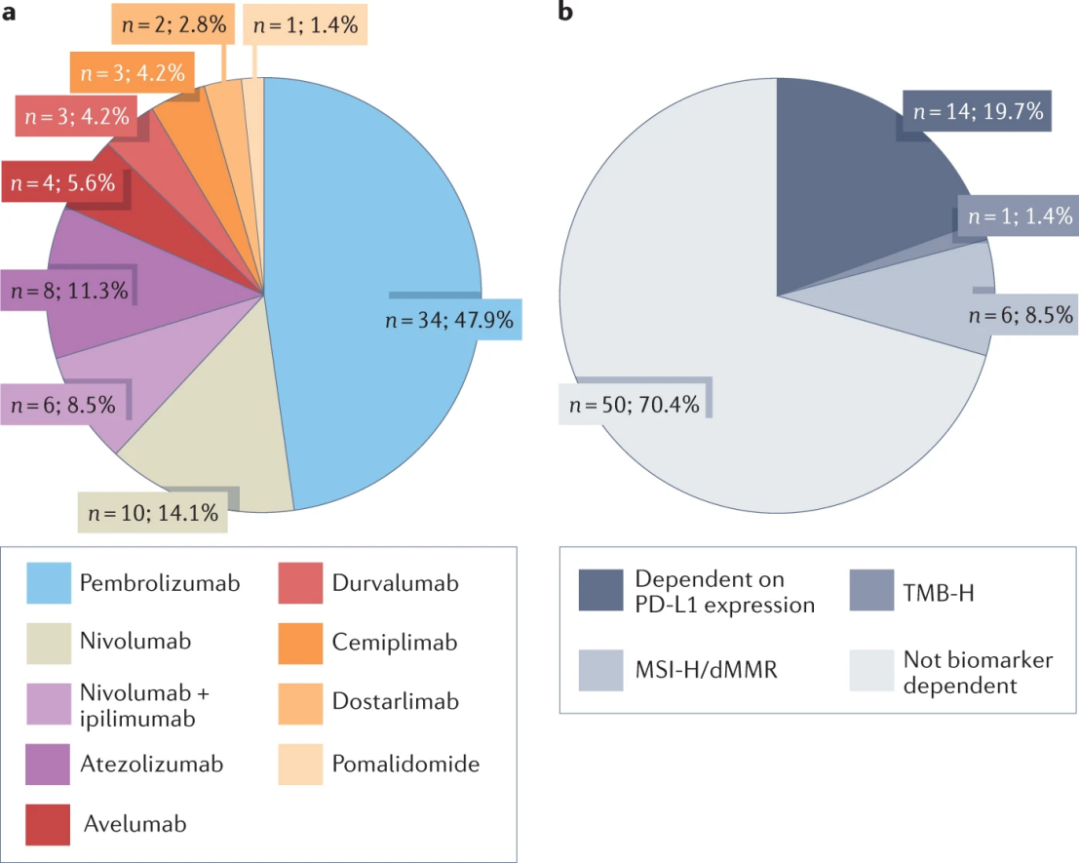
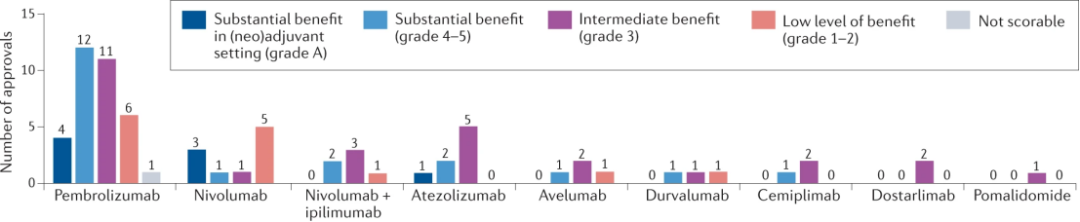
在161项新批准中,单独或与其他疗法联合使用的免疫肿瘤药物占71项(42%);8个作为辅助治疗,其余63个作为晚期疾病的治疗。Pembrolizumab、nivolumab单独或与ipilimumab和atezolizumab占主导地位,占新批准的57个(35%)。Pembrolizumab被批准用于34种适应症,涉及17种不同的肿瘤类型,Nivolumab被批准用于16个适应症,涉及9种疾病类型,Atezolizumab被批准用于八种适应症,包括五种肿瘤类型。其余13个批准由avelumab(四个),durvalumab(三个),cemiplimab(三个),dostarlimab(两个)和pomalidomoide(一个)共享。
免疫治疗批准多集中在PD-L1,高微卫星不稳定性(MSI-H)/缺陷错配修复(dMMR)和高肿瘤突变负荷(TMB-H)分别为14,6和1个批准。其余为不依赖生物标志物的疗法。
在63项免疫肿瘤学药物中,只有20种(32%)批准用于晚期疾病适应症,其ESMO-MCBSv1.1评分较高(4-5级),所有药物在其批准的适应症中总体临床益处处于中低水平。
小分子疗法仍有重要地位
在161项新批准中,小分子疗法占62项(39%),辅助治疗中早期实体瘤有5项,晚期癌症有57项。
批准用于NSCLC的小分子靶向疗法最多,有15种,包括osimertinib,afatinib和dacomitinib,用于携带经典EGFR外显子19和21突变的肿瘤以及一系列用于携带各种不太常见的驱动突变的肿瘤的药物。
CDK4/6抑制剂在晚期激素受体阳性、HER2阴性(HRHER2)乳腺癌管理中的作用进一步得到巩固。此外,聚(ADP-核糖)聚合酶(PARP)抑制剂在治疗BRCA突变或同源重组缺陷卵巢癌中的重要性得到牢固确立。
其他疗法
在免疫疗法和小分子靶向治疗的两个主要类别之外,FDA批准了23种不同的药物,用于28种适应症。这些药物包括六种内分泌药物,均用于前列腺癌和五种单克隆抗体,其中只有两种是新药:用于EGFR外显子20插入突变NSCLC的抗EGFR-MET双特异性抗体amivantamab和Fc工程抗HER2抗体margetuximab用于晚期HER2乳腺癌的三线或后期治疗。此外,自2019年以来,已有五种抗体药物偶联物被批准用于八种不同的适应症。
组织学不可知疗法(Histology-agnostic therapies)首次获批
2017年5月23日,FDA首次批准了组织学不可知的治疗:pembrolizumab被批准用于治疗难治性MSI-H/dMMR实体瘤且没有令人满意的替代治疗方案的成人或儿科患者。随后,基于特异性预测性肿瘤生物标志物的其他四种组织学不可知的疗法获得批准:dostarlimab也用于MSI-H/dMMR肿瘤,pembrolizumab用于TMB-H肿瘤,以及larotretinib和entrectinib用于NTRK融合肿瘤。
5年间FDA批准实体瘤疗法的趋势
已批准疗法多用于转移性/晚期癌症
绝大多数新的FDA批准用于成人实体瘤患者(161个中的146个(91%))适用于转移性或不可切除的局部晚期疾病患者。其中包括104项常规批准和42项加速批准。
FDA拥抱代替终点
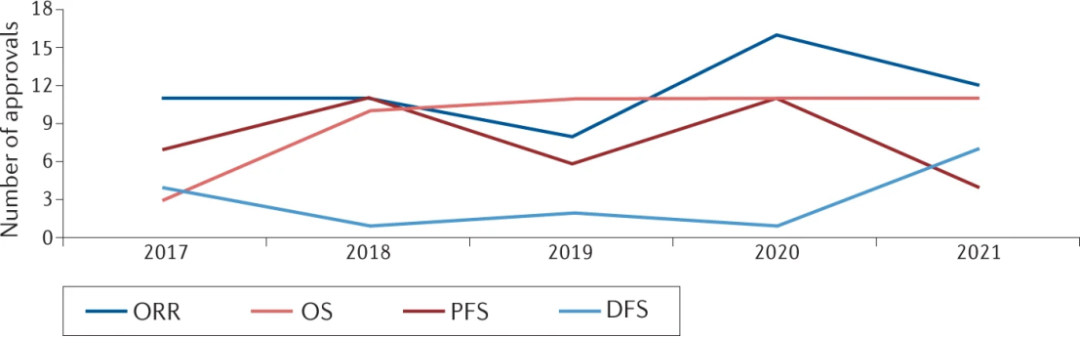
2017-2021年,FDA显示出降低证据门槛的趋势,以确定新疗法的益处,证明其风险是合理的。过去5年146项批准中的大多数都基于替代结局的数据,特别是单臂试验中与反应持续时间(DoR)相关的总体反应率(ORR)(n =58),或RCT中的PFS(n =39)。
加速批准虽多,但不少药物长期结果并不明显,难以转化为最终批准
2017-2021年,一共有42项加速批准,加速批准的药物大多数都是基于替代终点,仅有29%的批准得到了长期OS的明确证据的支持。在后期的随机确认性对照实验中验证了其中8项拥有积极的效果,但也有5项加速批准因为消极结果被撤回,更多的是未经确认的“挂起”加速批准或未经验证的常规批准。
新批准实体瘤疗法增加,对癌症可治愈性的改善虽有限,但临床益处高的药物正在逐年增加
应用ESMO-MCBSv1.1来评估146个新批准的晚期实体癌适应症的临床益处水平,42个(29%)达到了实质性益处的阈值,71个(49%)具有中等效益,31个(21%)具有低水平的益处。
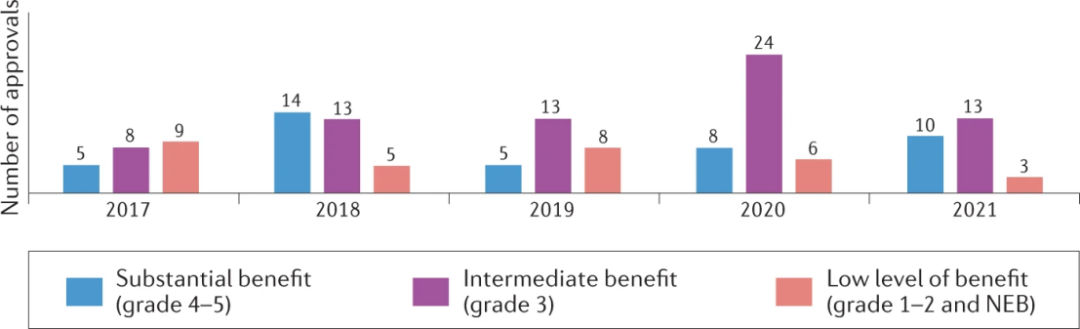
在所分析的5年期间,低效益药物的比例从2017年的40%下降到2021年的11%,高效益疗法的比例从23%增加到37%,这是一个令人鼓舞的趋势。
单药多适应症获批数量较多
这5年间主要是pembrolizumab和nivolumab的新适应症的激增,这些免疫肿瘤药物的50个新适应症占2017-2021年所有批准的31%。值得注意的是,在这50个批准中,有22个(44%)的ESMO-MCBSv1.1得分很高;只有11个(22%)得分低,其中四个随后被撤回。在FDA在2017-2021年批准的71种不同药物中,pembrolizumab和nivolumab以及osimertinib是“荒岛”清单中仅有的20种药物,这些药物被肿瘤学家判断为对治疗成人实体瘤至关重要。
参考来源:
[1] An appraisal of FDA approvals for adult solid tumours in 2017–2021: has the eagle landed?
<END>




















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论