
按照总局关于落实《国务院办公厅关于开展仿制药质量与疗效一致性评价的意见》的通告,在开展一致性评价过程中,药品生产企业需以参比制剂为对照,全面深入的开展比对研究。包括处方、质量标准、晶型、粒度和杂质等主要药学指标的比较研究,其中溶出试验被作为关键的评判指标,以提高体内生物等效性试验的成功率。对于符合《人体生物等效性试验豁免指导原则》的品种,还会允许该药品生产企业采取体外溶出试验的方法进行一致性评价,可见溶出度试验是仿制药一致性评价中的重中之重。
指导原则:为规范指导国内仿制药一致性评价工作,国家药品审评中心(CDE)相继颁布了《普通口服固体制剂溶出度试验技术指导原则》与《普通口服固体制剂溶出曲线测定与比较指导原则》,分别用于指导溶出度检查与溶出曲线比较。最新2022年4月,CDE还发布了《已上市化学药品药学变更研究技术指导原则(试行)〉中溶出曲线研究条件的问答(征求意见稿)》,用于指导上市后多种药学变更情形的溶出度试验,建议至少在三种溶出介质(pH1.2、pH4.5、pH6.8)中进行研究。如标准介质(指注册标准所用介质)与以上介质不同,需增加在标准介质中的溶出曲线研究。对于溶解度受pH 值影响较大的药物,可能还需要在更多种 pH 值的溶出介质中进行考察。
主要技术:国内仿制药溶出的一致性评价绝大多数采用差异因子(f1)与相似因子(f2)来比较受试制剂与参比制剂两条曲线是否一致,f1值越接近0,f2值越接近100,则认为两条曲线相似。当受试制剂和参比制剂在15 分钟溶出量均≥85%时,则认为两者溶出相似,无需进行f2 的比较。评价的标准很简单也很明确,难点是如何把握溶出趋势来调整相似因子。溶出速度同样遵循一定的原理,应用最广泛的是固体药物溶解速度方程为Noyes-Whitney方程:
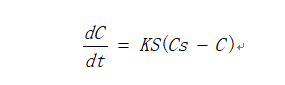
式中,K-溶出速度常数;Cs-固体药物的饱和溶度;C-溶液主体中药物溶度;S-溶出界面积。
首先理解溶出试验的基本原理,如图1:
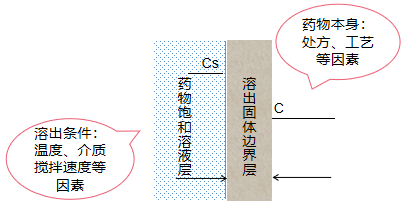
图1:固体制剂溶出原理示意图
固体制剂在吸水后崩解分散成为无数个固体单元,这一阶段主要是药物从固体制剂表面溶解,形成溶出固体边界层,这主要受药物本身性质影响。药物不断进入到溶出介质后会形成饱和溶液层,再由饱和溶液层向周围扩散,直至完全溶出,这一阶段主要受溶出的条件影响。所以,药物前期的溶出速度与崩解快慢以及崩解程度有密切关系,固体制剂完全崩解后,后期溶出速度则主要受扩散层的扩散控制,因此,调整溶出快慢有以下两种思路:
药物本身:从药物本身性质入手,有以下几种调节方向:
(1)固体单元的粒径:自研与原研片重相同,对于重量相同的固体药物,粒径越小,表面积越大,溶出速度增加。
(2)固体内部孔隙率:自研与原研体积一般大致相同,相同体积大小的固体药物,内部孔隙率越高,表面积越大,溶出速度增加。
(3)辅料类型:某些品种使用较多疏水性辅料,在制粒后形成疏水性较强的颗粒状,为了减少和避免在溶出介质中结块,可加入润湿剂来改善固体粒子的分散度,比如有些品种中加入适当表面活性剂,来增加溶出界面,有利于提高溶出速度。
(4)疏水性药物:对于疏水性药物粉末,药物从边界层进入溶液层较慢,将药物微粉化可以作为增加溶出速度的考察思路,固体分散体也是基于这一原理提高难溶性药物的溶出速度。
溶出条件:从溶出条件入手,参照相关标准,能够调节的空间有限。
(1)溶出介质的性质:溶出介质条件根据指导原则配制和使用,《中国药典》规定溶出介质应使用新鲜配制并经脱气的溶出介质,溶出介质的性质还受到关键辅料的影响,某些辅料溶于介质后改变介质的黏度、PH等,这也是关键辅料用量会影响溶出速度的因素之一。
(2)溶出介质的体积:在测定溶出速度时,要求有足够大体积的溶出介质。根据取样体积和时间点,有补液和不补液两种取样方式,选用何种方式需满足漏槽条件,一般所用样品全部溶出后的最终浓度在溶解度10%-20%,才能满足漏槽条件。
(3)扩散系数:温度升高,扩散速度加快从而加快药物的溶出速度。在测定溶出速度时要严格控制温度,避免由于温度不准而造成的影响。
(4)扩散层厚度:扩散层厚度与搅拌速度有关,当测定溶出速度时,一定要控制搅拌速度,搅拌速度越高,药物溶出速度越快,同时却能降低区分力,搅拌速度应优化选择,保证有足够区分力。
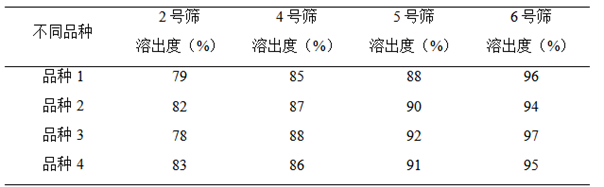
例子1:例如某品种制粒大小对片剂溶出度的影响:
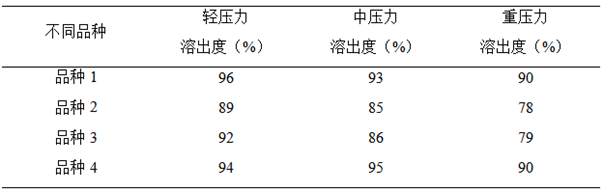
例子2:不同压片力对片剂溶出度的影响:
结语:在实际工作中,对于药物本身的因素,往往需要通过实验设计获得稳定可重现的参数范围,该范围需要有一定的耐用性,即不要因为微小变化而改变溶出速度。对于溶出条件影响因素,则恰恰相反要求精准性,即任何影响溶出速度的微小变化都需要得到控制。
<END>




















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论