
过去,中国医药市场主要是引入国外进口药,随着中国创新药产业的快速发展,越来越多的中国创新药通过对外授权(License out)、自主出海等方式走向国际市场,打破过去“只进不出”的局面。国产创新药获得FDA审批并上市,一方面有助于打开美欧更广阔的市场,另一方面,也可以证明中国创新药企的临床开发能力、申报能力达到新高度。
从2019年,百济神州的泽布替尼成为中国第一个在美国上市的创新药后,目前,已有十多款创新药在FDA提交NDA/BLA,大部分企业倾向于选择在海外先占据小适应症市场。未来,将会有更多国产创新药走向全球。
泽布替尼上市时间轴
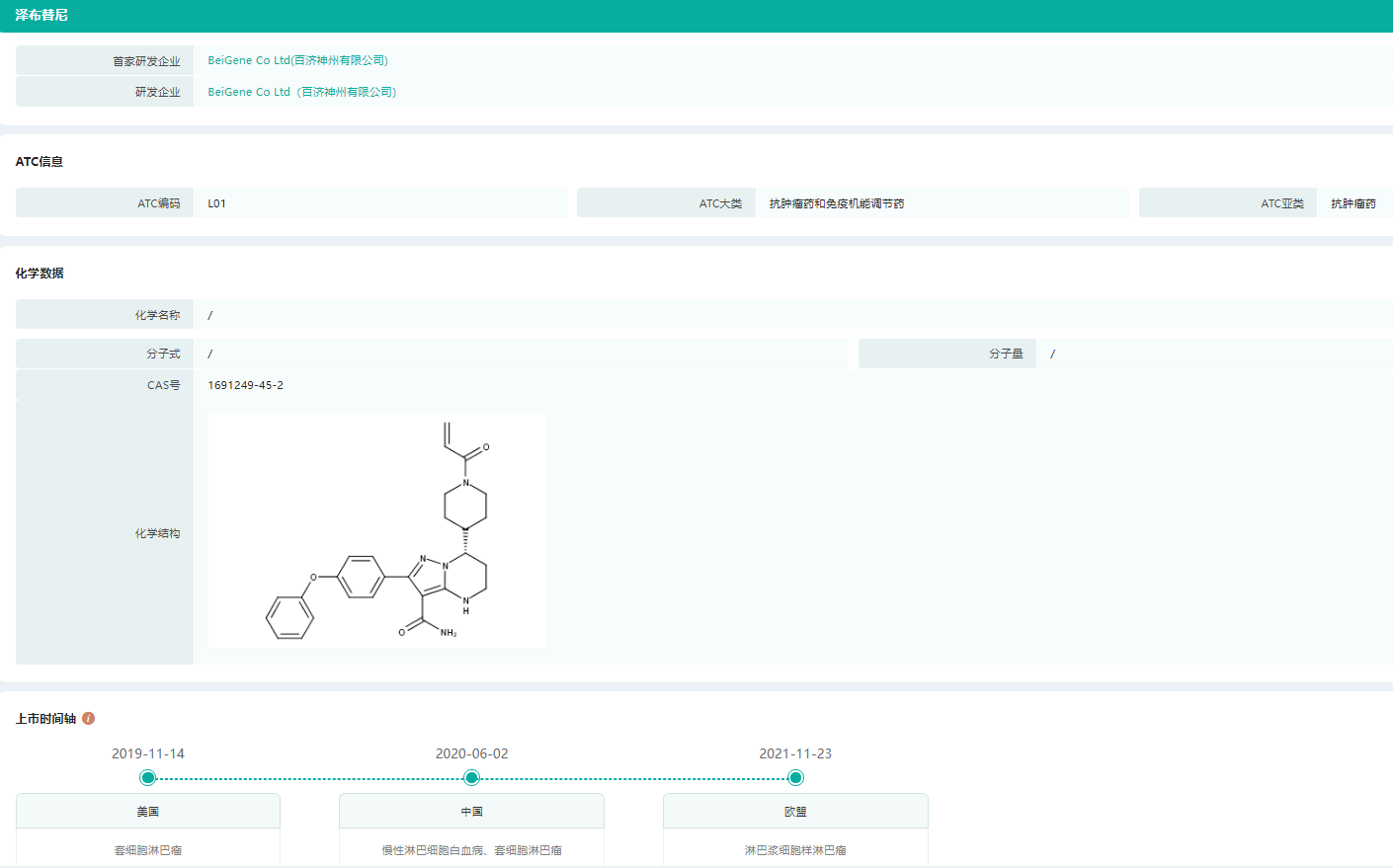
图片来源:药融云全球药物研发数据库
目前而言,国产创新药的出海之路仍走得磕磕绊绊。以PD-1肿瘤药为例,今年2月,信达生物的信迪利单抗闯关美国食品药品监督管理局(FDA)肿瘤药物咨询委员会(ODAC)失败;5月,FDA要求君实生物就特瑞普利单抗进行一项质控流程变更;7月,百济神州的合作方诺华据称在获得FDA反馈后,公司没有提交替雷利珠单抗单药的非小细胞肺癌美国上市申请。
但是,一时的曲折无法改变国产创新药国际化的大趋势。对于本土创新药企而言,从挫折中汲取经验和教训,未来才能更好地推动国产创新药出海。那目前国产创新药出海有哪些重要进展呢?以7月君实生物、石药集团的国际化动态为例,我们一起来看看。
1.君实生物——PI3K-α抑制剂“JS105”
7月初君实生物公告,与合作伙伴润佳医药收到美国FDA的通知,PI3K-α抑制剂(项目代号“JS105”)用于联合氟维司群治疗激素受体(HR)阳性、人表皮生长因子受体-2(HER-2)阴性、PIK3CA突变的晚期或转移性乳腺癌女性(绝经后)和男性患者的临床试验申请获得FDA批准。
PI3K能够介导磷酸化过程并且能调控如细胞增殖、分化、迁移和凋亡等一系列过程。相关研究表明,PI3K信号异常与很多癌症(例如前列腺癌、乳腺癌、子宫内膜癌、肺癌、肝癌、结肠癌等)的发生和发展相关,炎症与自身免疫疾病中也可见。
PI3K全称为磷脂酰肌醇-3-激酶,根据不同的结构和特定的底物可以分为不同的亚型,其中就包括PI3K-α。目前全球仅上市5款PI3K抑制剂,分别是艾德拉尼(Idelalisib)、库潘尼西(Copanlisib)、度维利塞(Duvelisib)、阿培利司(Alpelisib)、厄布利塞(umbralisib)。
Idelalisib基本信息(部分)
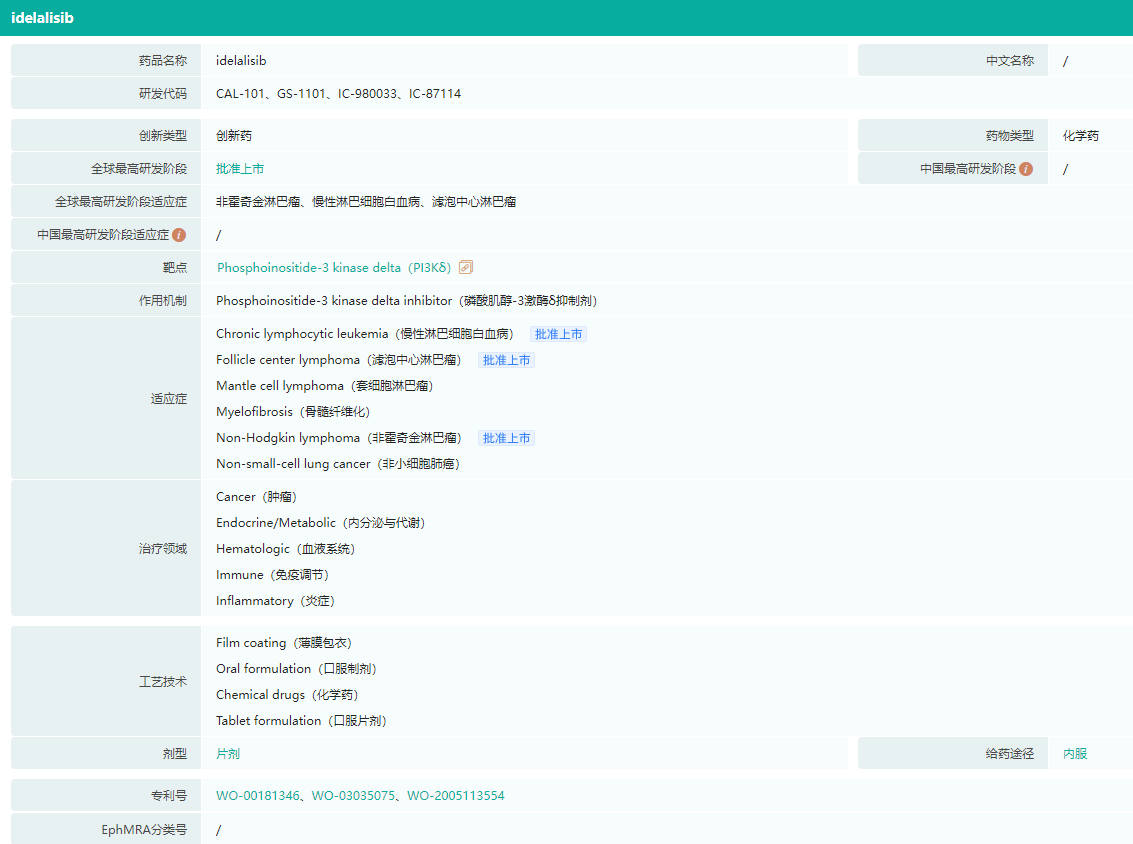
图片来源:药融云全球药物研发数据库
JS105为靶向PI3K-α的口服小分子抑制剂。截至目前,全球仅有一款PI3K-α抑制剂获批用于治疗HR阳性、HER2阴性、PIK3CA突变晚期乳腺癌,即诺华旗下的阿培利司(商品名:Piqray);国内尚无PI3K-α抑制剂获批上市。
2.君实生物——特瑞普利单抗
7月初,美国FDA受理了君实生物重新提交的特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌患者的一线治疗和单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗的生物制品许可申请。若特瑞普利单抗顺利获批,将成为美国首个且唯一用于鼻咽癌治疗的肿瘤免疫药物。
7月21日,君实生物继被美国食品药品监督管理局(FDA)授予突破性疗法和孤儿药资格认定之后,其自主研发的抗PD-1单抗药物特瑞普利单抗用于治疗鼻咽癌又获得了欧盟委员会授予的孤儿药资格认定。
至此,特瑞普利单抗鼻咽癌适应症已拿到全球主要的两大发达国家药品市场的“孤儿药”资格认定。此前,特瑞普利单抗治疗黏膜黑色素瘤、鼻咽癌、软组织肉瘤及食管癌、小细胞肺癌已分别获得FDA孤儿药资格认定。
特瑞普利单抗不同适应症研发状态(部分)
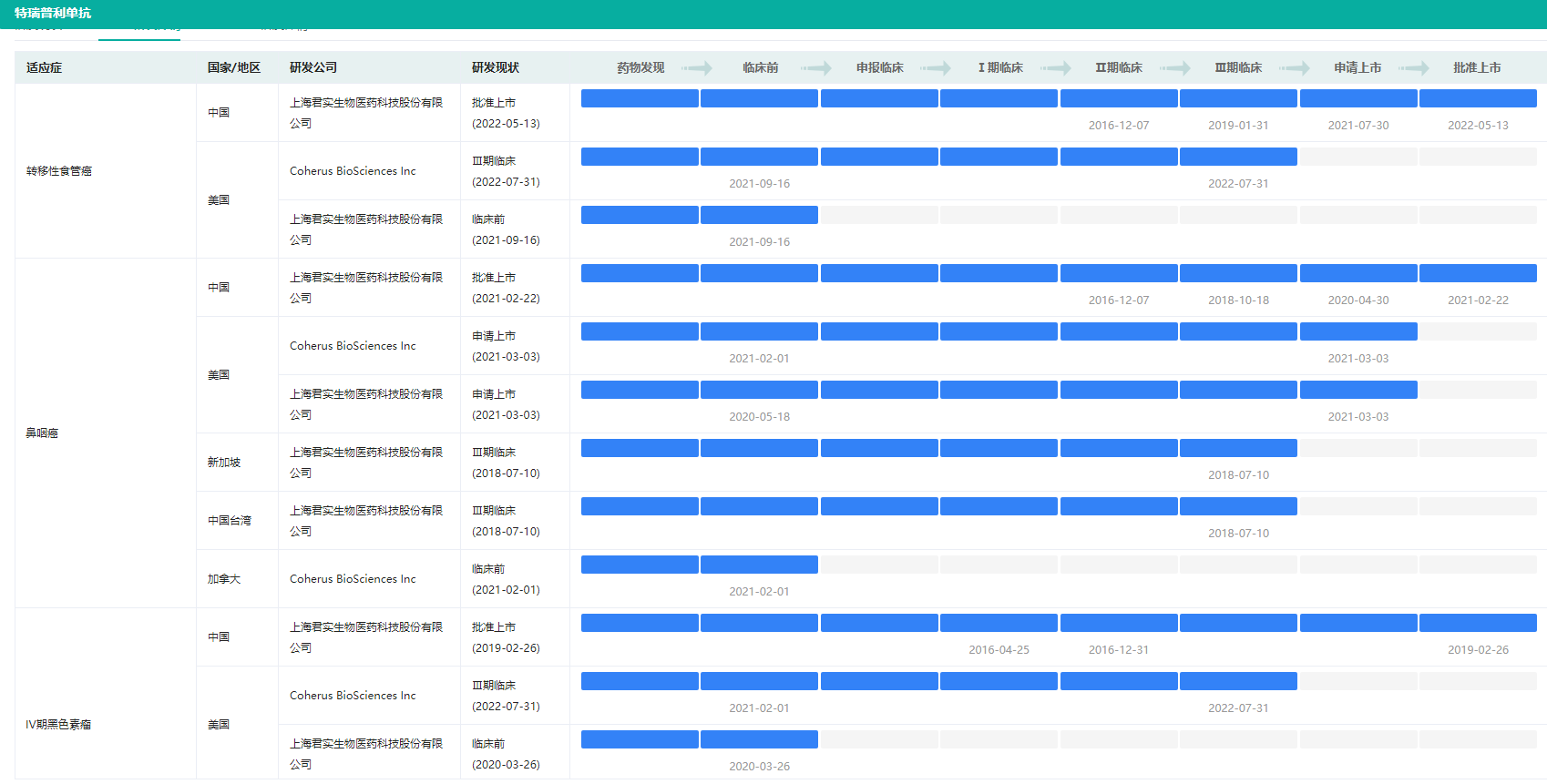
图片来源:药融云全球药物研发数据库
孤儿药(Orphan-drug)又称为罕见病药,指用于预防、治疗、诊断罕见病的药品。FDA授予的孤儿药资格认定适用于在美国地区针对少于20万患者的罕见病的药物和生物制剂。
3.石药集团——注射用多西他赛
7月28日,石药集团创新药物注射用多西他赛(白蛋白结合型),获FDA授予用于治疗胃癌(包括食道胃结合部癌)的孤儿药资格。其采用创新的人血白蛋白包裹技术,将多西他赛纳米粒输送至患者体内。凭借该项技术,该产品将可避免现时市场上多西他赛产品注射前的激素预处理,且无输注相关过敏反应发生,并可显著提高药物的体内暴露量,改善安全性、疗效及患者依从性。
目前,注射用多西他赛已经在中国进入多项关键临床研究,同时已在美国开展I期研究。现有临床研究数据显示,该产品最大耐受剂量为125 mg/m2,高于普通多西他赛注射液(75 mg/m2);临床拟用剂量下的体内暴露量为普通注射液的2.8倍;在胃癌患者二线治疗的客 观缓解率(ORR)达40%,是普通注射液的2倍。
注射用多西他赛中国临床试验数据(部分)
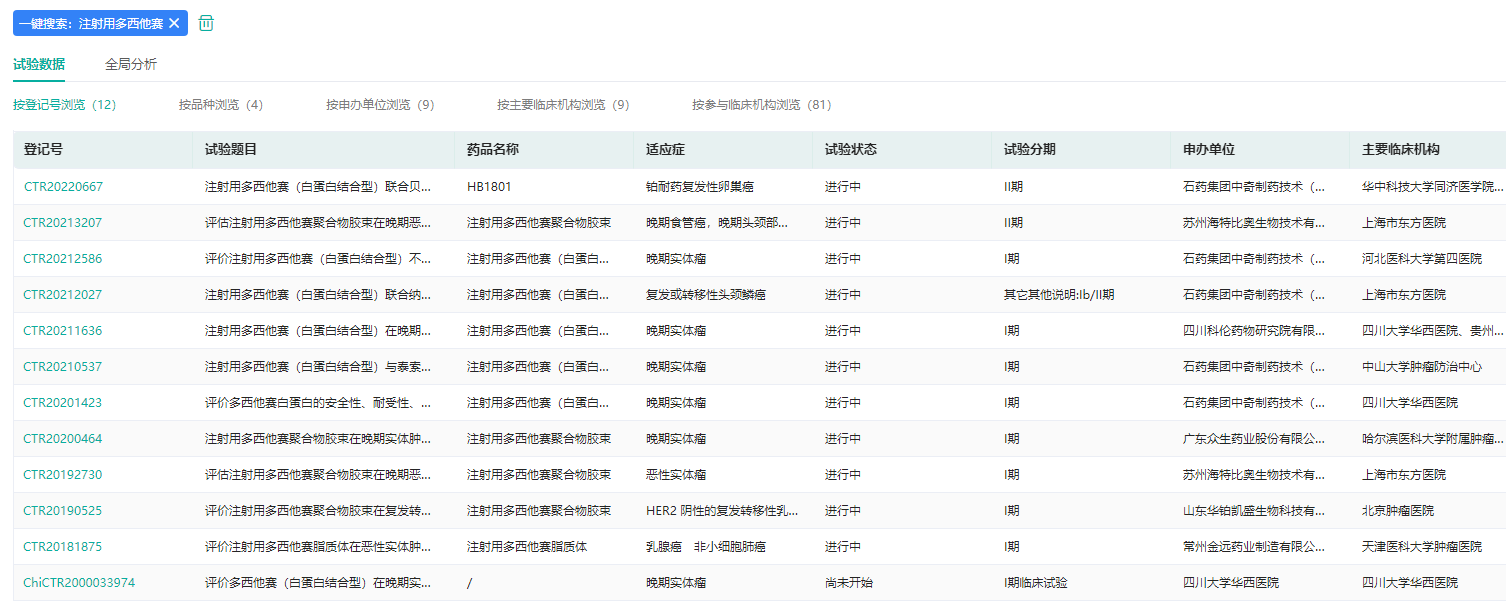
图片来源:药融云中国临床试验数据库
由于该产品给药前不需要使用激素预处理, 因此联用PD-1/PDL-1抗体时,不会因为激素的使用而影响PD-1/PDL-1抗体的疗效。基于临床研究显示的优势,或将有潜力取代现时市场上多西他赛产品成为一线治疗药物。
4.石药集团——ADC产品SYSA1801
与此同时,石药集团还宣布,其附属公司石药集团巨石生物已与Elevation Oncology就其潜在“first-in-class”的抗Claudin 18.2抗体偶联药物(ADC)SYSA1801在大中华地区(包括中国大陆、香港、澳门及台湾地区)以外地区的开发及商业化订立独家授权协议。石药巨石生物将保留该产品在大中华地区的所有权利。
SYSA1801是石药集团在研的一款靶向Claudi18.2的ADC产品。临床前研究表明,SYSA1801对胃癌、胰腺癌和肺癌具有良好的体内外活性和良好的安全性。目前一项评估SYSA1801治疗CLDN18.2阳性晚期恶性实体瘤的安全性、耐受性、药代动力学、免疫原性和初始疗效的I期试验正在中国进行。
SYSA1801中国临床试验信息(部分)
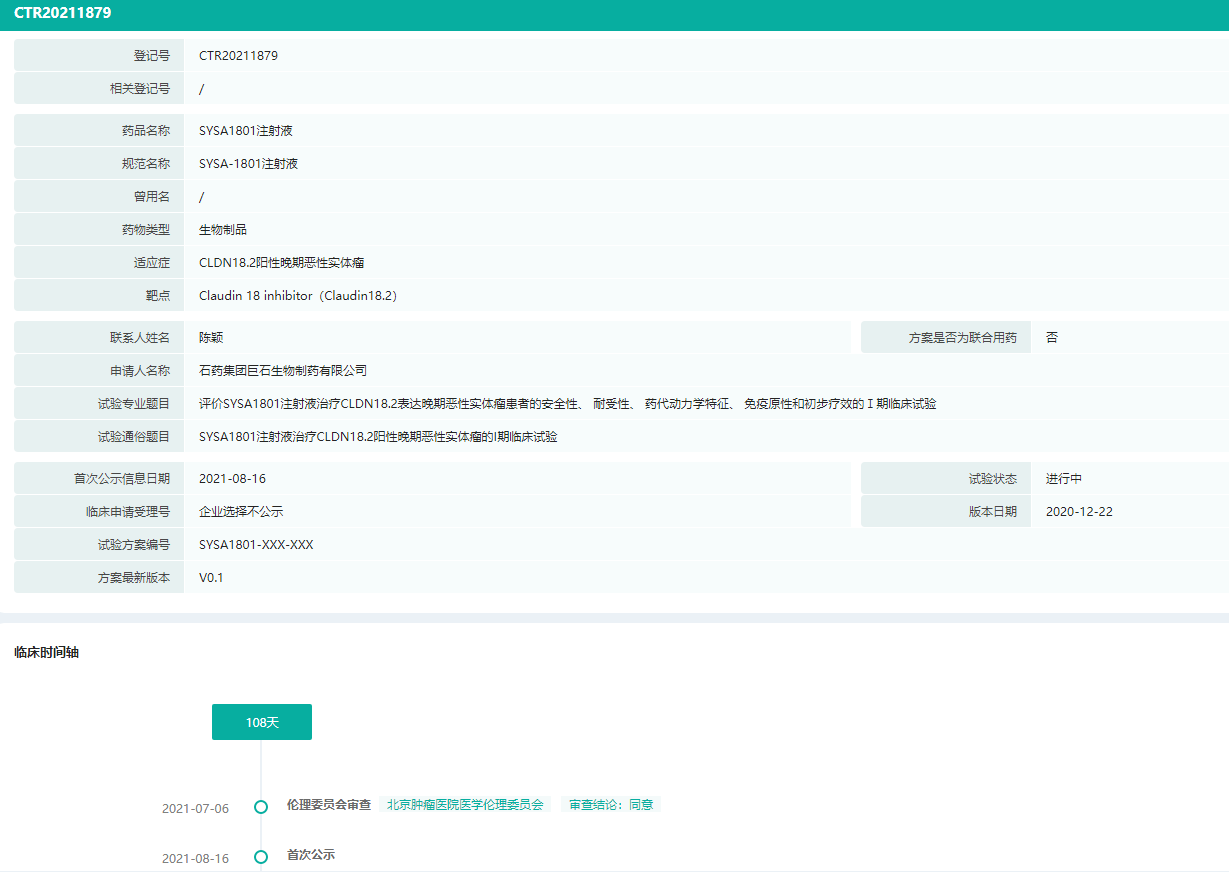
图片来源:药融云中国临床试验数据库
Claudin 18.2经常在胃癌、胰腺癌及肺癌中过度表达,而在其他类型的癌症中较少普遍表达。在正常组织中,Claudin 18.2被严格限于通常埋藏在胃黏膜中的分化上皮细胞中,基本上无法被单克隆抗体所接触。该等机制使Claudin 18.2成为具吸引力及前景的治疗靶点。
药融云专业咨询团队精心打造的《全球在研新药与靶点月报》,每月定期监控中国医药市场发生的重大事件,并对这些事件进行统计和分析,帮助行业内客户快速跟踪行业发展的脉络,及时获取到最核心的新药与靶点的情报信息。关注“药融云公众号(gh_d20f87bd52d9)”,回复关键词“报告”会有惊喜收获。
<END>





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论