
悲观是一种情绪,乐观是一种思路。
与其抱怨天气如何,不如每天把地种好。
2022年对中概医药股来说,是极其艰难的一年。
自然环境恶劣(疫情、管线内卷,融资不易),精神压力(美国退市警告)也很大。
站在2023年初,回顾下2022年,中概医药股经历了暴跌,退市警告,临床暂停等一系列挫折,不过可喜的是,中概医药股正在持续蜕变,活的越来越好。
从以下2022年10支中概医药股表现来看,大部分均是暴跌收尾,科兴生物停牌,唯一上涨的是传奇生物,去年涨幅仅7%。
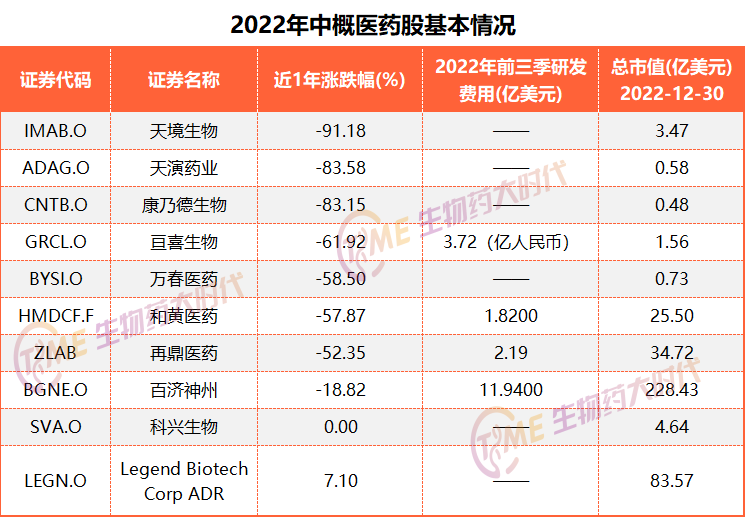
备注:股价和市值以2022年12月30日收盘价
去年6家中概医药股跌幅超过50%,天演药业和万春医药市值已经不足1亿美元。去年6月康乃德生物收到了纳斯达克的退市警告,跌幅83%。2022年11月18日,万春医药收到纳斯达克的书面退市警告,因其股价连续30个交易日低于1美元/股的最低要求。不过,随后在12月初股价一路暴涨至2.6元以上,退市警报暂时解除。背靠一哥恒瑞医药,加上万春自身有一定的研发实力,春天或许不会太遥远,中概医药股或许不久后也会脱离寒冬。
一、传奇生物的上涨“传奇”
2022年2月15日晚,金斯瑞发布公告称,子公司传奇生物已在11日收到美国FDA的邮件通知,暂停了旗下一款CAR-T产品的Ⅰ期临床试验。
上帝给你关上了一扇窗,同时也会给你打开一扇门。
2022年2月28日,传奇的另一款BCMA靶点的CAR-T产品西达基奥仑赛(英文商品名:CARVYKTI,英文通用名ciltacabtagene autoleucel,简称Cilta-cel)获得美国FDA批准上市, 用于治疗复发或难治性多发性骨髓瘤(R/R MM)患者,是中国首个获FDA批准细胞治疗产品。2022年Q2首季销售约2400万美元,Q3约5500万美元,环比快速放量。
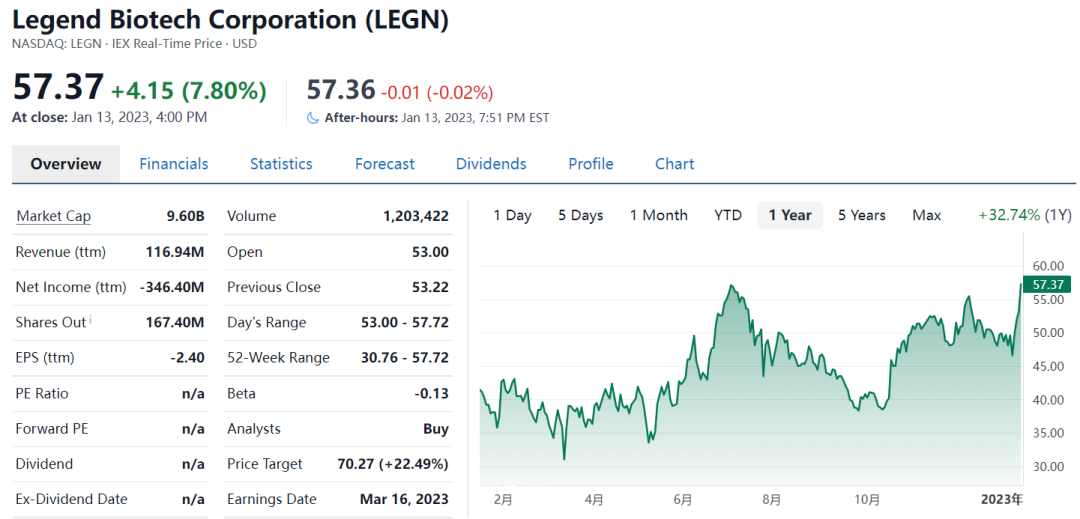
二级市场上,传奇生物股价是去年少有的受到国外投资者追捧的中概医药股。
2023年1月12日,CDE官网显示,传奇生物的西达基奥仑赛上市申请拟纳入优先审评。
二、再鼎医药:营收大增,港股成功“摘B”
再鼎医药美股去年大跌52%,港股成功“摘B”。港交所18A开市4年多,上市药企超50家,但成功“摘B”的至今仅6家,去年11月再鼎成功摘掉帽子。再鼎医药成立8年,目前已有4款创新产品商业化落地。
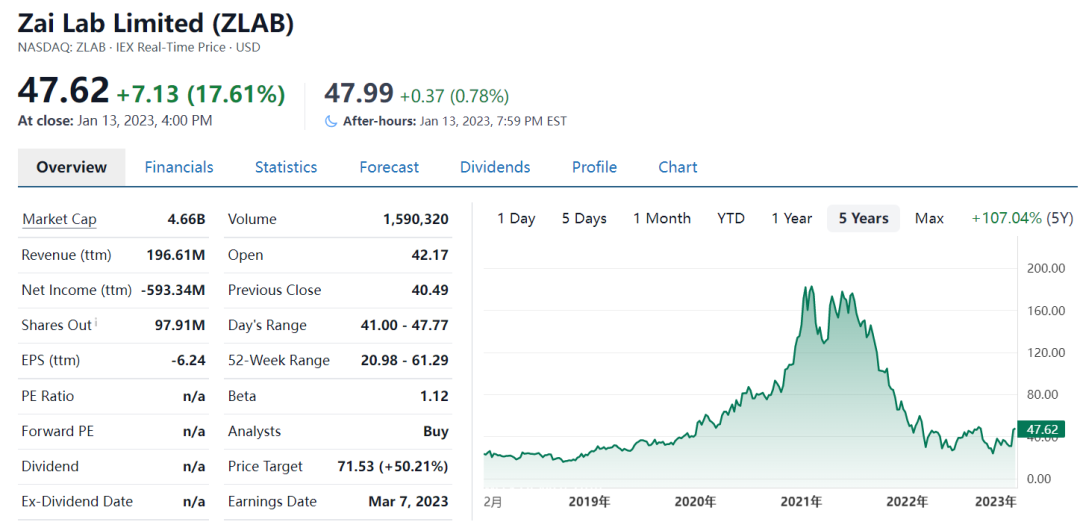
2022年前三季度,再鼎医药收入1.52亿美元,同比增长52%;亏损净额为3.82亿美元,同比下降23%,Q3研发支出为9950万美元,同比增长81%。2023年1 月 5 日晚,再鼎医药和Novocure宣布针对非小细胞肺癌的关键性LUNAR研究达到主要终点总生存期。
新的一年,随着研发的不断推进以及商业化的成功,再鼎中概医药股有望“顶起来”。
三、百济神州:海外市场放量明显
百济神州2022Q1-3营业收入为10.36亿美元,其中产品收入9.16亿美元,较上年同期增长约109.6%;前三季研发费用支出11.94亿美元。
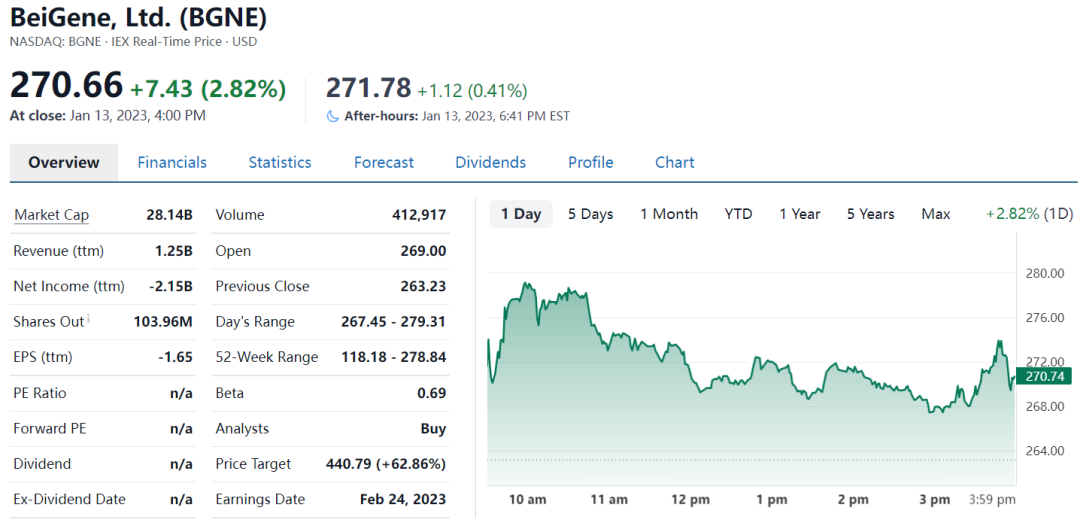
海外市场放量明显,国内疫情影响有限。
从三季报来看,百济神州核心品种BTK抑制剂泽布替尼和PD-1抑制剂替雷利珠单抗保持高速放量,收入均超预期。泽布替尼2022Q1-3全球销售额达3.89亿美元,同比增长约196%。其中三季度实现全球销售额1.56亿美元,同比增长136%,环比增长20.9%。美国区销售额1.08亿美元,相较去年同期增长221%,环比增长22.3%,持续高速放量。中国区销售额3950万美元,同比增长23%,环比增长7.6%。欧洲区开始贡献收入,销售额700万美元。
PD-1替雷利珠单抗2022Q1-Q3中国销售额3.21亿美元,同比增长60.5%;其中三季度实现营收1.28亿美元,同比增长67%。
百济神州继续保持研发高投入和其他药企拉开距离,上市产品的商业化也很成功,未来有望在国际化上更进一步,或将会是一支后起之秀的中概医药股。
四、和黄医药:战略大调整
2022年3月8日,美国证监会(SEC)将5家公司列入《外国公司问责法》(简称HFCAA)的暂定清单,包括百济神州、再鼎医药、和黄医药、百胜中国、盛美半导体。
2022年5月2日,FDA拒绝批准和黄医药索凡替尼上市申请,需要补做国际多中心试验。
受到两次打击后,和黄医药进行战略大调整。
2022年11月15日,和黄医药宣布,为应对当前影响全球生物制药行业的具有挑战性的市场条件,公司正在积极进行战略转变,专注于其内部开发管线中最前沿的、最有可能推动近期价值的药物。现任执行副总裁、研发负责人兼首席医学官(中国)石明博士将总体负责全球研发及临床开发。在石博士的领导下,和黄医药继FRESCO-2于2022年8月取得成功的多中心临床试验结果后,将继续高度聚焦其领先国际的药物呋喹替尼的监管申请和进一步开发。
2022年12月19日,和黄医药布已开始向FDA滚动提交呋喹替尼用于治疗难治性转移性结直肠癌的新药上市申请。
和黄的国际化拓展精神值得学习,随着战略的大调整,该中概医药股的未来值得期待。
总结
出海是对创新最好的演练,印度仿制药全球闻名,也是经历过无数的蜕变而成,中国创新药企要想做大做强,需要不断的去开疆破土。2022年是中概医药股经历非常困难的一年,这些优秀的公司没有被打倒,在战略上积极调整,在研发上以更加的高标准要求自己,对于国际规则也有了更深入的理解,凤凰涅槃,“能活下来的都是优秀的物种”,中概医药股的春天或不远。
<END>


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论