摘要:药品质量研究中涉及各种计算方法,如内标法、外标法、标准加入法等,本文将各种计算方法进行了系统整理,相关计算公式也进行了简化,便于记忆及运用,不足和缺陷之处,望同行批评指正。
一、面积归一化法
把所有出峰的组分含量之和按100%计的定量方法,通常各组分的校正因子差异不大时,较为准确,药品质量研究前期使用较为广泛,如原料药的工艺开发,中间体过程控制等,常采用该方法。该方法的优点是简单,方便,人为带来的干扰较小(如浓度差异、进样精度等),缺点是只能应用于相对比较,无法准确定量。
二、加校正因子的自身对照法
目前为已知杂质定量控制的常规手段,有加校正因子的主成分自身对照法和加校正因子的主成分对照品法,审评中心更倾向于后者,校正因子的计算方式有单点法、多点法和标准曲线法,其中标准曲线法测定的结果更为准确,计算公式为:
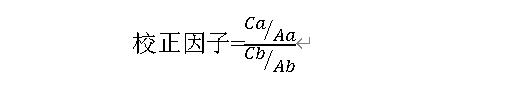
该校正因子与USP相对相应因子(Relative Response Factor)互为倒数关系,计算时应注意。
三、不加校正因子的自身对照法
根据药品安全控制的需要,参照EP10.0 2.2.46. CHROMATOGRAPHIC SEPARATION TECHNIQUES中的相关规定,校正因子在 0.8-1.2之间可不加校正因子。参照《HPLC法校正因子研究中的几个问题》张哲峰,化药药学二部的相关文章,该校正因子的适用范围为0.2~5之间,超出该范围,方法应进一步优化。
四、外标法(标准曲线法)
又称校正曲线法,是用标准物质配制标准系列,在标准条件下,测定各标准样品的吸光度值Ai,以吸光度值A,(i=1,2,3...)对被测物质的含量c(i=1,2,3...)建立校正曲线A= f(c),在同样条件下,测定样品的吸光度值A,根据被测物质的吸光度值A,从校正曲线求得其浓度Cx。通常在荧光分光光度法、原子吸收分光光度法等应用中使用。
五、外标法(直接比较法)
精密称(量)取对照品和供试品,配置成溶液,分别精密取一定量进样,适用于以手动进样器定量环或自动进样器进样为宜。利用的是对照品与样品中单位浓度峰面积的响应值一致的原理。
外标法计算公式:
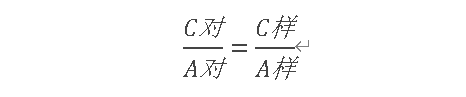
六、内标法
可避免因样品前处理及进样体积误差对测定结果的影响,通常在GC、ICP-MS等检测中常用,精密称(量)取对照品和内标物质,分别配制溶液,各精密量取适量,记录色谱图。根据对照品内标的比值与样品中内标的比值一致的原理,内标法计算公式如下:
公式变形,=
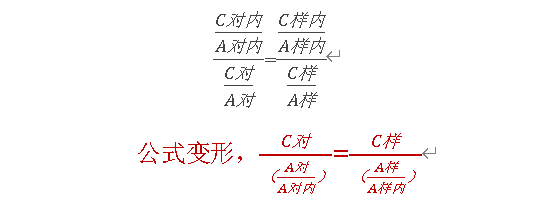
C对内:指对照品中的杂质内标的浓度;A对内:指对照品中内标物的峰面积;C对:指对照品中目标物的浓度;C样:指供试品中目标物的浓度;
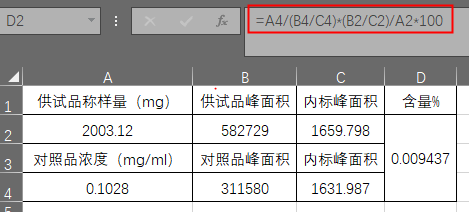
实例:以某原料中残留溶剂检测为例,分析方法大致简述如下,内标溶液 称取丁酮适量,用水稀释制成每1ml中约含0.2mg的溶液。供试品溶液 取本品约1.0g,精密称量,置10ml量瓶中,加内标溶液使溶解并稀释至刻度,摇匀。对照品溶液 取对照品适量,精密称定,用内标溶液稀释,定容至刻度,摇匀即得,精密量取对照溶液与供试品溶液(1)各4ml,分别置顶空瓶中,密封。 色谱条件 顶空进样,毛细管色谱柱,限度 按标准加入法以峰面积计算,残留量不得过0.1%。
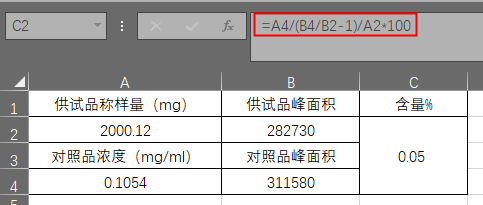
七、标准溶液加入法
可以消除基质效应的影响,适用于顶空进样等,供试品和对照品处于不完全相同的基质中,基质有干扰的情况。通常在气相色谱中使用,精密称(量)取某个杂质或待测成分对照品适量,配制成适当浓度的对照品溶液,取一定量,精密加入到供试品溶液中,根据外标法或内标法测定杂质或主成分含量,再扣除加入的对照品溶液含量,即得供试品溶液中某个杂质和主成分含量。
计算公式如下:

C本:样品中杂质的本底浓度;∆C:样品中杂质的加入浓度;A对(本+∆C):对照品中杂质本底加加入浓度后的峰面积;
实例:以某原料中残留溶剂检测为例,分析方法大致简述如下,供试品溶液 取本品约1.0g,精密称量,置10ml量瓶中,加稀释剂使溶解并稀释至刻度,摇匀。对照品溶液 取对照品适量,精密称定,用供试品溶液稀释定容至刻度,摇匀。精密量取对照品溶液与供试品溶液各4ml,分别置顶空瓶中,密封。 色谱条件 顶空进样,毛细管色谱柱,限度 按标准加入法以峰面积计算,残留量不得过0.1%。
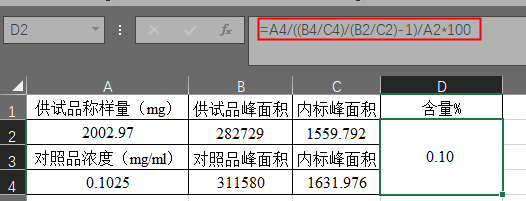
八、标准加入内标法
可避免因样品前处理及进样体积误差对测定结果的影响,又能排出基质干扰。通常在气相色谱中使用,标准加入内标法中,采用对照品峰面积/内标物峰面积,带入外标法公式计算即可,公式如下:
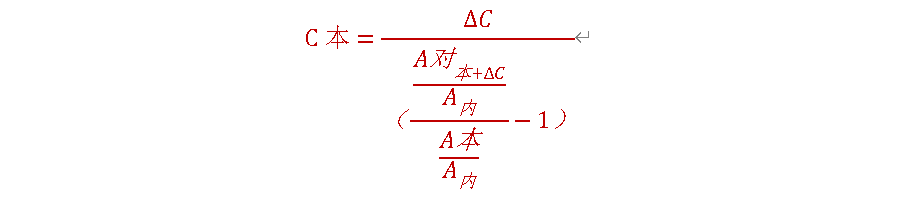
实例:以某原料中残留溶剂检测为例,分析方法大致简述如下,内标溶液 称取丁酮适量,用水稀释制成每1ml中约含0.2mg的溶液。供试品溶液(1)取本品约1.0g,精密称量,置10ml量瓶中,加内标溶液使溶解并稀释至刻度,摇匀。供试品溶液 精密量取供试品溶液(1)与内标溶液各2ml,置顶空瓶中,密封。对照品溶液 取溶剂适量,精密称定,用内标溶液定量稀释制成每1ml中约含待测物0.1mg,精密量取对照溶液与供试品溶液(1)各2ml,置顶空瓶中,密封。 色谱条件 顶空进样,毛细管色谱柱,限度 按标准加入内标法以峰面积计算,残留量不得过0.5%。计算公式如下:
九、思考
计算方式属于分析方法非常重要的组成部分,基于检测物质的化学性质、检测设备及控制理念选择合适的计算方式将有效的提高分析方法的准确性,不用计算方式其原理相同,即“待测物峰面积与其浓度成正比” ,内标法避免因样品前处理及进样体积误差对测定结果的影响,标准加入法可以消除基质效应的影响,工作中若能适当运用不同的计算方式,可以弥补检测方法自身的不足,起到事半功倍的效果。
十、参考文献
[1] 液相色谱检测方法(第二版)。
[2] 2020版《中国药典》。
<END>





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论