一、引言
多肽是由多个氨基酸(2≤N≤50)通过酰胺键连接形成的一类化合物,其分子大小介于小分子化药和大分子生物药之间。与小分子化药相比,多肽具有更高的功效、选择性和特异性以及更低的代谢毒性;与大分子生物药比,多肽具有更低的免疫原性,能更深入的渗透到目标组织,且连续生产成本更低。基于这些独特的优势,近年来,多肽类药物越来越受到关注,据统计,肽药物市场的增长速度是其他药物的两倍,目前已有上千种肽类药物进入市场,用于治疗糖尿病、骨质疏松症、癌症、多发性硬化症、慢性疼痛、HIV感染等多种疾病。
在多肽药物兴起的初期,由于多肽药物的特殊性,针对多肽药物的指导原则并不多,且对多肽性质的了解也不够深入。随着多肽药物数量的增加和对多肽性质理解的不断加深,针对多肽的指导原则也在不断地更新和扩充,美国和欧洲药典中均有多个关于合成多肽原料药质量控制的相关章节,2022年9月EMA发布了“关于制定合成肽和合成寡核苷酸研发生产指南”的概念文件,我国SFDA也于今年更新了《化学合成多肽药物药学研究技术指导原则》,这些指导原则为我们进行多肽类药物研发提供了重要的参考和指引。
我们知道,活性肽是产生药效的物质基础,因此在肽药物的开发过程中,对活性肽(API)进行质量控制是十分重要的,而肽相关杂质的控制又是质量控制的重要工作,杂质不仅影响用于临床试验样品的质量和安全性,在药物发现的早期阶段,这些杂质还可能影响药效的判断,杂质研究不到位甚至可能导致错误的结论。由于在国内外批准的治疗肽药物中合成多肽占多数(大于70%),因此今天主要探讨的是合成多肽的相关杂质以及可能的产生途径,以期对包装、储存条件选择及制剂处方开发提供一定的指导。
二、杂质分类及产生途径
2.1 合成过程相关杂质
化学合成技术是多肽生产的金标准,该工艺最初在溶液中进行,后来引入了固相肽合成,固相肽合成一经问世就受到研发者的偏爱,几十年来不断发展与成熟,已稳坐化学合成的第一把交椅。化学合成多肽的步骤包括:挂树脂-去保护基-活化和交联-肽切割。在这个过程中去保护基和活化与交联的步骤容易产生杂质,通常是需要质控的点。
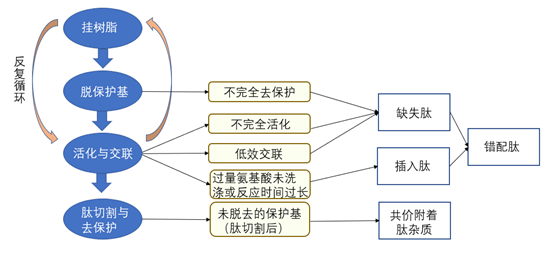
图1 固相合成流程简图及相关杂质的产生途径
- (1)缺失肽
顾名思义,缺失肽即是缺失一个或多个所需氨基酸的多肽,不完全去除氨基酸的瞬时保护集团、即将结合的氨基酸活化不足或交联效率低都会导致缺失肽的产生。缺失肽的鉴定方法,即质谱中观察到的杂质与目标肽之间的质量差为所缺失氨基酸分子量减去水。
例如,某合成多肽药物A目标分子量为1311.5,在样品中检测出分子量1103.5的杂质,与母肽分子量相差208,初步推测至少缺失2个氨基酸,经过推算当缺失脯氨酸(分子量:115)及5-氧代脯氨酸(分子量:129)时所得杂质分子量=1311.5-115+18-129+18=1103.5,与所检测到的该杂质质荷比相符合。
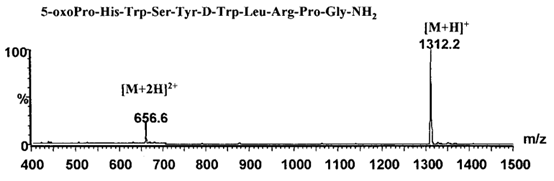
图2 某合成多肽药物A的质谱图
(图谱来源于文献2)
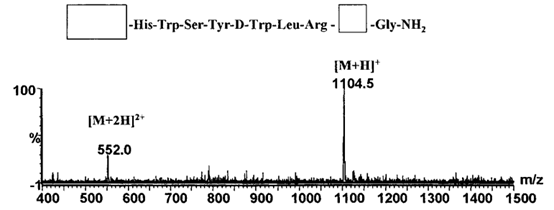
图3 某合成多肽药物A缺失肽的质谱图
(图谱来源于文献2)
- (2)插入肽
在合成多肽交联过程中通常会将氨基酸过量投料,如果过量的氨基酸未被充分洗涤或者反应时间过长会将氨基酸再次交联,产生插入肽。对于插入肽的鉴定方法,即质谱中观察到的杂质与目标肽之间的质量差为所插入氨基酸分子量减去水。
例如:上述某合成多肽药物A目标分子量为1311.5,在样品中检测出分子量1474.9的杂质,与母肽分子量相差163.4,初步推测插入酪氨酸,酪氨酸分子量为181,杂质分子量=1311.5+181-18=1474.5,与所检测到的该杂质质荷比相符合。
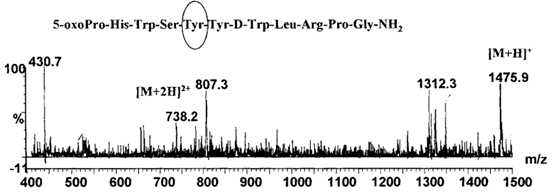
图4 某合成多肽药物A插入肽的质谱图
(图谱来源于文献2)
- (3)错结肽
当固相反应过程中既发生氨基酸缺失又发生氨基酸插入时就会产生错结肽。
- (4)共价附着肽杂质
在固相合成完成后永久性保护基团不完全去除将导致保护基共价附着在肽序列中,产生共价附着肽杂质。对于这类杂质的鉴定方法,如果质谱中杂质分子量与目标肽分子量相差56 Da,那么附着的保护基为tBu保护基,如果质谱中杂质分子量与目标肽分子量相差100 Da,那么附着的保护基为tBoc-TCS保护基。
2.2 降解相关杂质
降解相关杂质包括制造过程中通过降解机制形成的杂质和储存过程中通过降解机制形成的杂质。引起多肽不稳定的因素包括氧化、光照、高温、pH、离子强度变化及吸附等,肽链中氨基酸种类及氨基酸所在的位置对多肽的稳定性有重要影响。因稳定性而产生的肽杂质包括:
- (1)差向肽
差向肽是指序列中含有1个或多个非预期手性构型的氨基酸残基所形成的杂质,其产生可能源于起始物料中的光学异构体,也可能是合成过程中氨基酸手性中心烯醇化或氮杂内酯化形成。差向肽杂质的色谱行为与主成分非常接近,分子量也与主成分一样,仅此分离和鉴定难度较大。可采用氘代试剂对多肽进行水解并衍生化处理,通过水解所得氨基酸的手性异构体的含量判断肽链中易发生消旋的氨基酸,通过定向制备可能的差向异构体肽进行有针对性的研究。
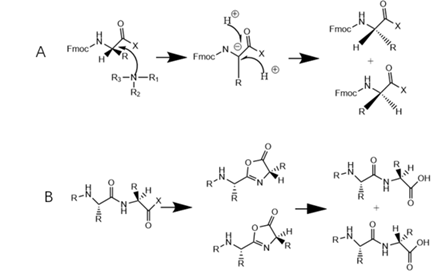
图5 差向肽形成机制(A)烯醇化(B)氮杂内脂化
(图谱参考文献3绘制)
- (2)缺失肽(断裂肽)
此处的缺失肽与合成过程中的缺失肽不同,此处主要是指断裂肽。多肽化合物在遇到高温或pH变化时可能发生肽键断裂,产生断裂肽,有研究表明碱性条件最易引起肽键断裂。断裂肽的鉴定相对简单,通过杂质与母肽的分子量差可以推断是哪个酰胺键断裂。
- (3)脱酰胺杂质
当多肽中含有谷氨酰胺或天冬酰胺残基时,可能脱去酰胺键形成谷氨酸或天冬氨酸残基,形成的机制有两种,一是直接水解(pH<5时容易发生),二是通过β转变(碱性条件下易发生),β转变通过主链中酰胺键的N原子攻击侧链上的羰基,形成琥珀酰亚胺环(氮杂内酯的一种),在碱性或中性条件下水解形成羧基。琥珀酰亚胺水解过程往往还伴随着两个副反应即异构化和外消旋化,最终形成4个分子量相同的异构体产物。脱酰胺杂质的鉴定主要通过质谱,检测到分子量+1 Da的杂质通常是脱酰胺杂质。
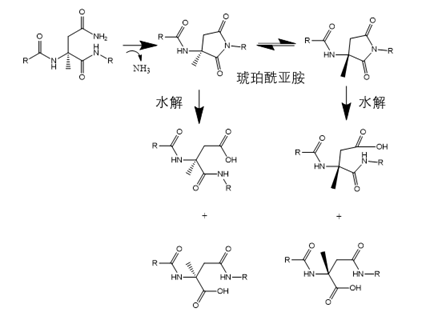
图6天冬酰胺脱酰胺杂质产生机制
(图谱参考文献3绘制)
- (4)异构化杂质
天冬氨酸是容易产生异构化的氨基酸,天冬氨酸容易因侧链失水或氨而环化到主链,形成琥珀酰亚胺,琥珀酰亚胺稳定性较差,易水解开环,在开环的过程可形成异构体,同时还会产生差向肽副产物,其生成机制与天冬酰胺脱酰胺相似。
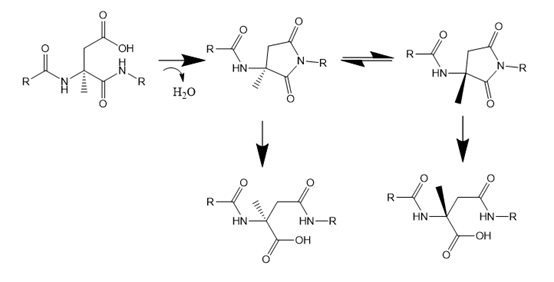
图7天冬氨酸相关杂质产生机制
- (5)二嗪哌酮和焦谷氨酸
二嗪哌酮是指N端活性基团(通常为氨基)进攻β位主链酰胺键的羰基,形成二酮哌嗪类似物,得到缺失两个氨基酸的缺失肽,当N端氨基酸位阻较小时反应更容易发生。
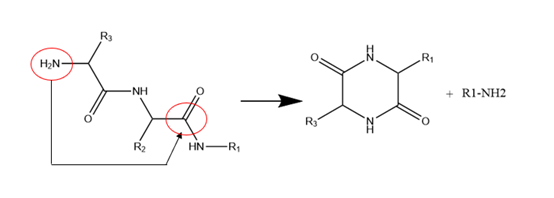
图8 二嗪哌酮杂质产生机制
(图谱参考文献3绘制)
焦谷氨酸是指N-端含有的谷氨酸发生环化形成吡咯烷酮羧酸。该杂质的鉴定可采用质谱,分子量较母肽减少17Da(脱去NH3)。
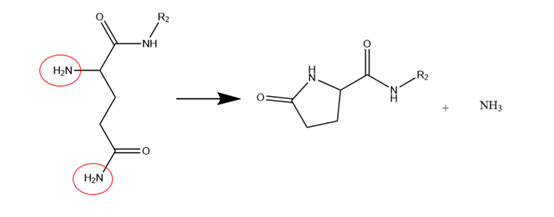
图9 焦谷氨酸相关杂质产生机制
(图谱参考文献3绘制)
- (6)聚合物
多肽分子间聚集和自结合可导致高分子量杂质也就是聚合物的形成。聚合机制有共价和非共价两种,非共价聚合通过静电或疏水相互作用形成,是一种中间状态,当溶液浓度、pH或离子强度发生变化时,这种作用力容易减弱或消失,聚合状态恢复到单体状态;当肽链中含有巯基或酪氨酸时可通过生成二硫键或形成二酪氨酸而引起共价聚合,共价聚合是一种稳定的聚合状态,不会随肽浓度或pH、离子强度等而改变聚合状态。聚合物杂质由于其分子量和体积的进一步加大,容易增加免疫原性,引起过敏性反应,因此应合理控制聚合物的含量。聚合物的检测通常采用体积排阻色谱,与质谱联用后可以判断其聚合体的倍数。
- (7)氧化杂质
氧化杂质是多肽在储存过程中接触氧气和光的情况下形成的,易发生氧化的氨基酸包括含硫氨基酸、组氨酸、酪氨酸、色氨酸。
①含有硫的氨基酸(甲硫氨酸、半胱氨酸、胱氨酸)容易发生氧化反应,氧化途径有两种,一是生成二硫键,杂质分子量为母肽分子量2倍减2,二者生成亚砜、砜和磺酸,杂质分子量与母肽的分子量通常相差16Da、32Da或48Da(图10 A、B)。
②酪氨酸中酚羟基及临位均可成为氧化位点,氧化会生成2-氨基-3-(3,4-二氧环己-1,5-二烯基)丙酸,分子量增加14(图10 C)。
③组氨酸氧化有两种途径,一是咪唑环的双键氧化成羰基,其氧化杂质与母肽分子量相差16Da,另一种氧化途径是生成n -甲酰基犬尿氨酸,分子量相差48(图10 D)。
④色氨酸在氧化条件下可生成羟色氨酸(分子量增加16Da)或犬色氨酸(分子量增加4Da),犬色氨酸进一步氧化可生成羟基-甲酰犬尿氨酸(分子量增加48Da)(图10 E)。
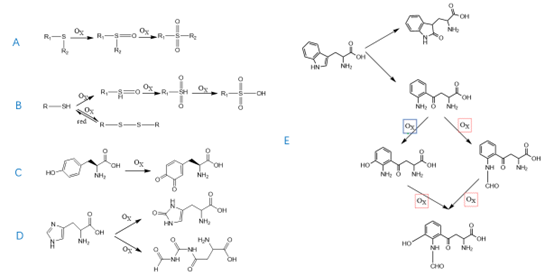
图10 多肽氧化的降解机制
- (8)其他杂质
多肽除发生以上降解外还会在还原剂存在的条件下发生还原反应,如二硫键还原为巯基,这一反应与相应的氧化反应形成动态平衡。
此外,物理不稳定性也是需要关注的问题,如与包材、滤膜等发生吸附或当多肽分子微环境发生变化时其高级结构发生改变等,这些都可能引起药效改变或产生安全性的风险。
结束语:
多肽的肽相关杂质不仅是药物开发和生产过程中GMP监管需要持续关注的问题,在药物发现和开发的早期阶段还可能因为杂质的拮抗作用或超强的药效引起研发者的误判,因此通常在开展生物试验时,建议采用不同来源的肽进行复测,以排除杂质对药效的影响。
合成过程相关的肽杂质包括fmoc脱保护效率低下、氨基酸活化不足或交联效率低下、氨基酸过量或反应时间过长引起的缺失肽、插入肽。与稳定性相关的杂质包括差向肽、断裂肽、脱酰胺杂质、异构化杂质、聚合物、二嗪哌酮和焦谷氨酸、氧化等。了解多肽类药物杂质产生的原因,我们不仅可以对容易产生杂质的合成步骤进行监控,在后续制剂处方设计和储存过程中我们也可依据由于多肽不稳定所产生杂质的产生机制有针对性的设计处方工艺和储存条件,确保多肽药物的质量在可接受范围内。
相关阅读:
《当多肽遇上小核酸会擦出怎样的火花?多肽核酸偶联物未来可期!》
《多肽类药物:药物研发热点之一!从多肽百年发展史看其未来发展》
《ADC抗体偶联药物大热!万药皆可连,多肽偶联药物是下一个风口?》
《重磅!CDE发布《化学合成多肽药物药学研究技术指导原则(试行)》》
参考文献:
[1]Muttenthaler M, King GF, Adams DJ, Alewood PF ,Trends in peptide drug discovery. Nat Rev Drug Discov 20:309–325.
[2] V.Sanz-Nebot,I.Toro,Investigation of synthetic peptide hormones by liquid chromatography coupled to pneumatically assisted electrospray ionization msaa spectrometry:analysis of a synthesis crude of peptide triptorelin, Rapid Commun. Mass Spectrom,2001;15:1031-1039.
[3] Matthias D’Hondt, Nathalie Bracke, Related impurities in peptide medicines, Journal of Pharmaceutical and Biomedical Analysis 101 (2014) 2–30.
[4]化学合成多肽药物药学研究技术指导原则。
[5] ShikhaPatel · Vivek K. Vyas · Priti J. Mehta,A Review on Forced Degradation Strategies to Establish the Stability of Therapeutic Peptide Formulations,International Journal of Peptide Research and Therapeutics (2023) 29:22.
[5] 胡玉玺,蒋煜, 合成多肽药物质控及杂质谱研究, 中国新药杂志 2018年第 27卷第5期。
[6] Brian Gregg,Aleksander Swietlow,Control Strategies for Synthetic Therapeutic Peptide APIs Part III: Manufacturing Process Considerations.
[7] Virender K. Sharma a& Nigel J.D. Graham , Oxidation of Amino Acids, Peptides and Proteins by Ozone: A Review, Ozone: Science & Engineering, 32: 81–90.
-END-

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论