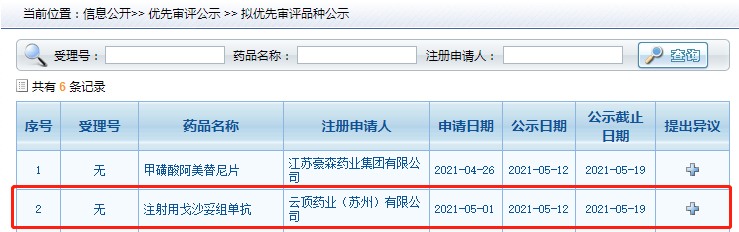
2021年5月12日,CDE 官网显示,云顶药业(云顶新耀子公司)递交 Trop2 ADC(抗体药物偶联物antibody-drug conjugate)产品注射用戈沙妥组单抗上市申请并拟纳入优先审评,用于既往接受过至少 2 种疗法的转移性三阴性乳腺癌(mTNBC)成人患者。5月13日,CDE受理了上海诗健生物科技有限公司/东曜药业有限公司重组人源化抗Trop2单抗-SN38偶联物的临床申请,受理号CXSL2101069。Trop2靶点受到国内外药企的充分关注,已有多家企业积极布局中。
一、什么是Trop2
TROP2属于TACSTD家族,是由TACSTD2基因编码表达的细胞表面糖蛋白,又名肿瘤相关钙离子信号转导子2(TACSTD2)、表皮糖蛋白1(EGP-1)、胃肠肿瘤相关抗原(GA733-1)、表面标志物1(M1S1)。TROP2在多种恶性肿瘤中过表达,是一种与恶性肿瘤发生、侵袭和转移有关的癌基因。
TROP2是与肿瘤密切相关的基因。它主要通过调节钙离子信号通路、细胞周期蛋白表达及降低纤黏蛋白黏附作用促进肿瘤细胞生长、增殖和转移。TROP2也可以与Wnt信号级联中的β-连环蛋白相互作用,因而对细胞核癌基因的转录、细胞的增殖起作用。
二、TROP2与肿瘤的关系
研究发现,与正常组织相比,TROP2在各种人类上皮癌中表达更高,包括乳腺癌、肺癌、胃癌、结肠直肠癌、胰腺癌、前列腺癌、宫颈癌、头颈癌和卵巢癌等。Trop2的过表达在肿瘤生长过程中起着关键作用。此外,在乳腺癌等几种癌症中,Trop2的高表达还被发现与更具侵袭性的疾病和预后不良相关。例如,在浸润性导管癌乳腺癌患者中,Trop2 mRNA表达的增加是生存期较差和淋巴结转移的强预测因子,而Kaplan-Meier生存曲线还显示,Trop2表达高的乳腺癌患者生存期明显较短。
三、Trop2靶点研发管线
由于TROP2在多种实体肿瘤中高表达的特性,目前它已成为研究人员开发ADC抗体的新靶点。ADC抗体已被视为对付癌症的新利器 ,由于其具有精准治疗的特性,被誉为“生物导弹”。目前全球仅上市了一款靶向TROP2的单抗ADC抗体sacituzumab govitecan(戈沙妥组单抗),原研厂商为美国 Immunomedics 公司(已被吉利德收购),2019 年云顶新耀通过与 Immunomedics 达成一项 8.35 亿美元的合作,获得了该药物在大中华区等国家和地区的权益。
全球TROP2靶点管线一览
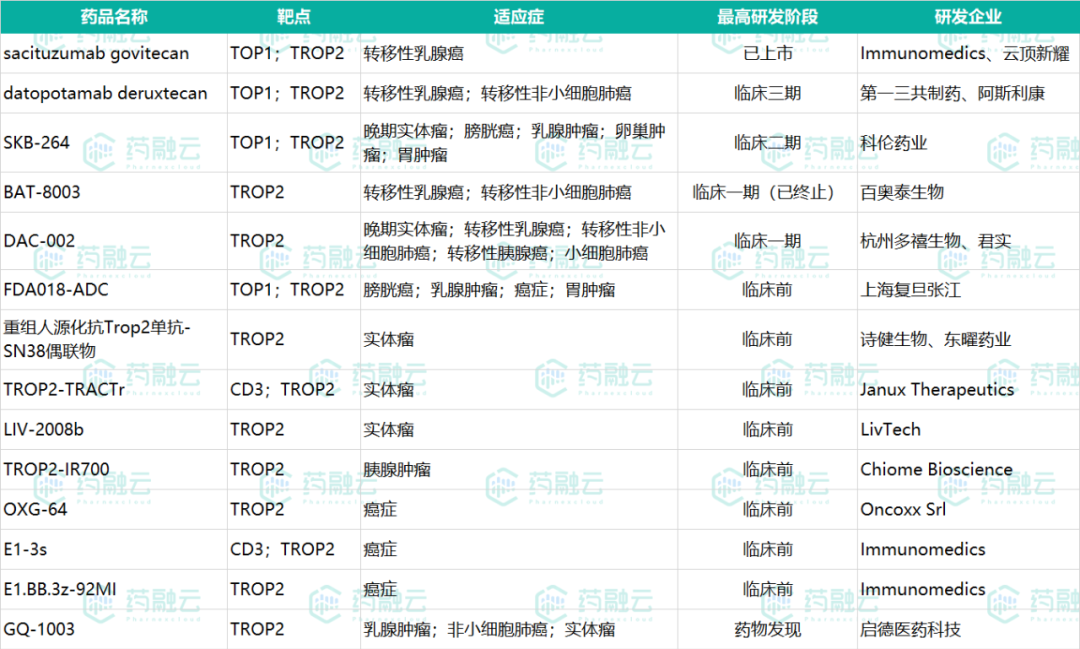
数据来源:药融云全球研发数据库
从药融云全球研发数据库监测到全球共有21条TROP2研发管线,14条研发管线处于相对活跃的状态(无后续进展报道等inactive状态的管线未纳入图表)。14条研发管线中,我们看到了多个国产药企的身影,如云顶新耀、科伦药业、百奥泰、杭州多禧生物、上海复旦张江、诗健生物、启德医药科技等,这也说明国产药企研发实力在不断加强,fast follow的模式越加成熟。
1. sacituzumab govitecan(戈沙妥组单抗)
sacituzumab govitecan(戈沙妥组单抗)是一款 First in class 抗 Trop2 抗体药物偶联物(ADC),是 Immunomedics 公司的核心产品,吉利德在 2020 年 9 月以 210 亿美元大手笔收购 Immunomedics 获得了该产品,将其带上行业内热议的风口浪尖。该药于2020年4月22日获得美国FDA批准上市,商品名为Trodelvy®,用于转移性三阴乳腺癌的治疗。在顶级期刊NEJM上发表的一项III期临床研究中,抗体偶联药物Sacituzumab Govitecan(SG),让复发或难治性三阴乳腺癌患者的中位无进展生存期达到了5.6个月,相比传统疗法的1.7个月足足提高了两倍多。

值得一提的是, 2019年4月,云顶新耀通过与Immunomedics公司达成独家许可协议,获得了sacituzumab govitecan在大中华区、韩国及一些东南亚国家和地区的开发、注册和商业化权益,涉及金额高达8.35亿美元。目前该药在中国已经提交了上市申请,预计能在今年Q4之前获批,对国内三阴乳腺癌患者来说是个很好的消息。
2. datopotamab deruxtecan
datopotamab deruxtecan是阿斯利康(AstraZeneca)与第一三共制药(Daiichi Sankyo)旗下TROP2靶向ADC抗体药物,在转移性非小细胞肺癌和三阴乳腺癌治疗中展现出不俗潜力。
2.1针对转移性非小细胞肺癌
2021年1月,阿斯利康(AstraZeneca)与第一三共制药(Daiichi Sankyo)在由国际肺癌研究协会主办的2020年第21届世界肺癌大会(WCLC)线上会议上公布了datopotamab deruxtecan的TROPION-PanTumor01 I期试验新数据。数据显示,该药在治疗晚期或转移性非小细胞肺癌(NSCLC)患者方面取得了令人鼓舞的结果,显示出良好的临床活性。
在名为TROPION-PanTumor01的1期临床试验中,总计159名晚期或转移性NSCLC患者接受了不同剂量的datopotamab deruxtecan (4 mg/kg, 6 mg/kg或8 mg/kg)的治疗。这些患者曾经接受过3种以上的前期治疗,包括含铂化疗(94%)或免疫疗法(84%)。在中位随访时间为7.4个月时,由独立审评委员会确定的客观缓解率(ORR)在21%~25%之间,疾病控制率在67%~80%之间,中位无进展生存期在4.3个月和8.2个月之间。
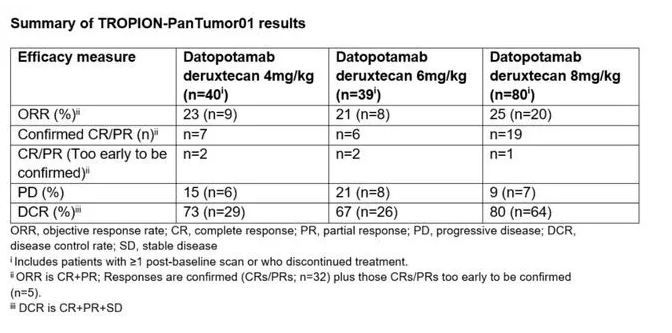
Datopotamab deruxtecan(第一三共/阿斯利康)全球最高研发阶段处于III期临床研究阶段,被开发用于治疗经治的转移性非小细胞肺癌。
2.2针对三阴乳腺癌
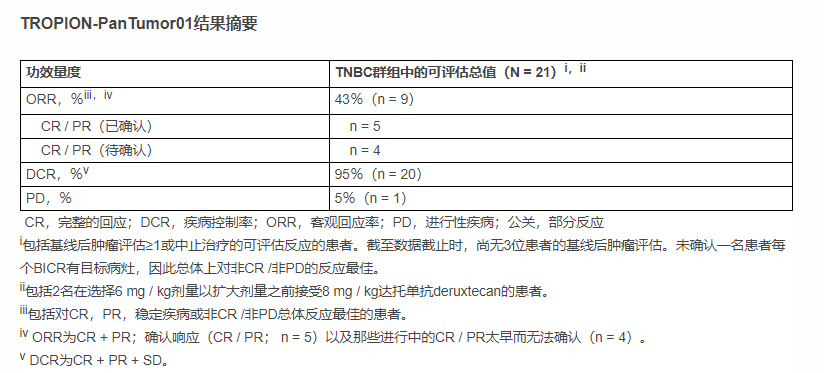
在21例接受datopotamab deruxtecan [6 mg / kg(n = 19)或8 mg / kg(n = 2)]治疗的可评估患者中,通过盲态独立中心评估的初步客观缓解率(ORR)为43%。截止2021年1月8日的数据表明,已观察到5个患者已确认得到完全或部分缓解(CR / PR),还有4个患者正在等待确认CR / PR,疾病控制率达到95%。
除去sacituzumab govitecan(戈沙妥组单抗)在国内开展临床外,目前国内尚有 2 个 Trop2 ADC 抗体项目临床试验正在开展,分别来自科伦博泰(科伦药业子公司)和多禧生物。其中科伦博泰进展最快,已经进入 2 期临床;杭州多禧生物联手君实,也已启动 1 期临床。百奥泰于2021年3月4日发公告终止Trop2抗体偶联药物项目BAT8003(1期临床)的临床开发,该项目花费已达6056.5万元。此外,上海复旦张江的FDA018-ADC于2021年 4 月 21 日申报临床;上海诗健生物科技有限公司/东曜药业有限公司重组人源化抗Trop2单抗-SN38偶联物于2021年5月13日IND申请获得CDE受理。
通过各药企公司官网披露、药融云中国专利数据库等监测,发现国内还有一些企业在布局Trop2靶点的ADC抗体药物,如启德医药科技的GQ-1003;四川百利药业有限责任公司申请了SN38相关ADC药物专利,一种含SN38的抗体药物偶联物,申请日2020.05.25。相信该靶点赛道将会出现越来越多玩家。
















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论