获批量创新高!2021上半年已有16款国产1类新药获批,全年或有近30款国产新药问世
截至2021年6月30日,中国国家药品监督管理局(NMPA)在2021年已经批准16款国产1类新药上市,国产1类新药的获批数量已超2020整年,创历史新高,预计全年会有近30款国产1类新药获批上市。
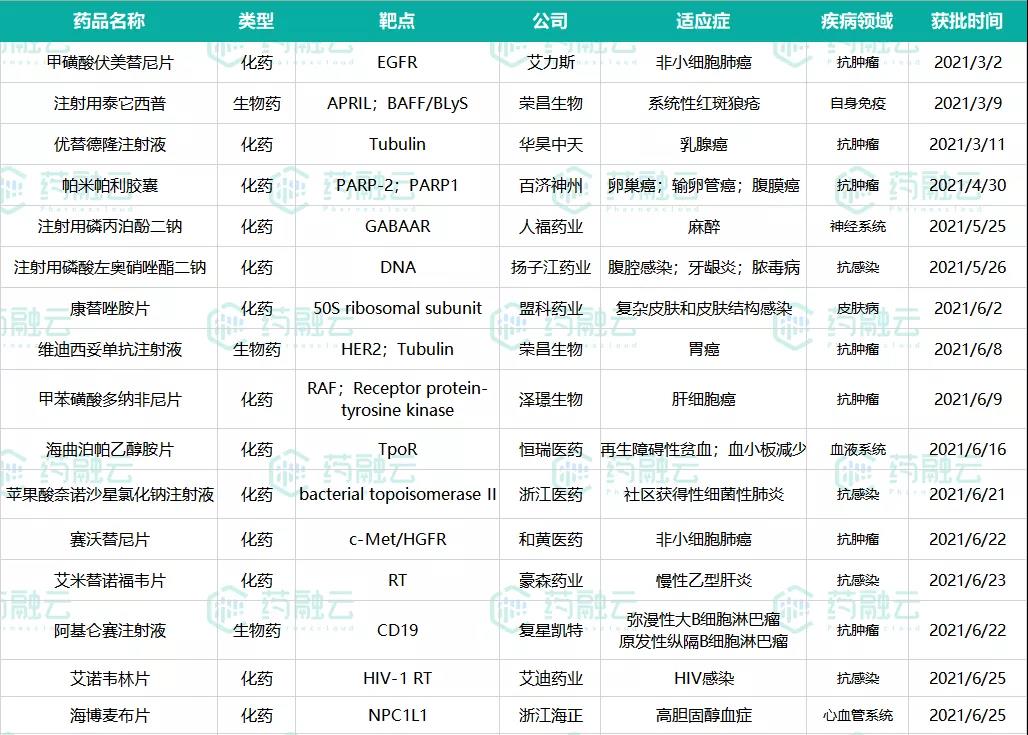
(数据来源:国家药监局官网、药融云数据库)
16款国产1类新药中,抗肿瘤药物依旧占据重头戏,2021上半年已有7款抗肿瘤国产1类新药获批上市,包含5款小分子化药和2款生物药。抗感染、自身免疫、血液系统等领域也均有一定斩获。
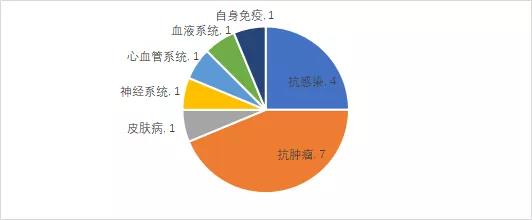
一、7款抗肿瘤新药
1、甲磺酸伏美替尼片
公司:艾力斯
靶点:EGFR
获批适应症:用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFRT790M突变阳性的局部晚期或转移性非小细胞性肺癌(NSCLC)成人患者的治疗。
化学结构式:
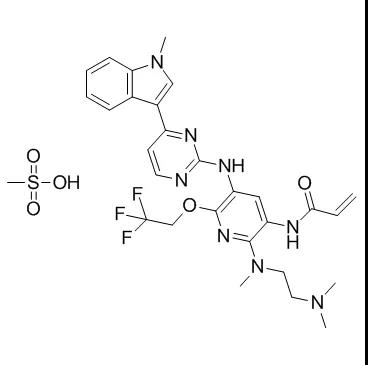
2021年3月3日,国家药品监督管理局(NMPA)发布公告,通过优先审评审批程序附条件批准上海艾力斯医药科技股份有限公司(以下简称艾力斯)申报的1类创新药艾弗沙®(甲磺酸伏美替尼)上市。艾弗沙®是中国原研、拥有自主知识产权的第三代EGFR-TKI,具有“双活性、高选择、强缩瘤、安全佳”的特点。
此次申请是基于艾弗沙®治疗T790M突变阳性的局部晚期或转移性NSCLC患者的关键注册临床研究。该研究结果已于2020年在美国临床肿瘤学会(ASCO)年会上发布。结果显示:艾弗沙®治疗EGFR T790M突变阳性局部晚期或晚期NSCLC的客观缓解率(ORR)为74.1%,疾病控制率(DCR)为93.6%。
2. 优替德隆注射液
公司:华昊中天
靶点:Tubulin
适应症:转移或局部晚期乳腺癌
化学结构式:
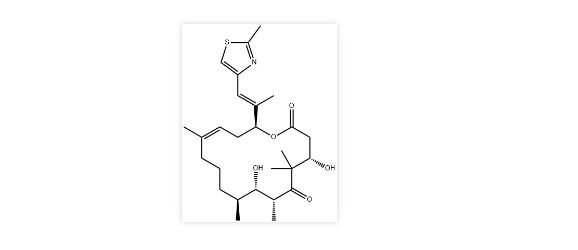
2021年3月15日,国家药品监督管理局官网发布消息,成都华昊中天药业有限公司申报的1类创新药优替德隆注射液获批上市,该品种上市为晚期乳腺癌患者提供了新的治疗选择。
作为国内首个且唯一获批的埃博霉素类抗肿瘤药物,此次优替德隆(优替帝®)的获批打破了我国长期以来晚期乳腺癌治疗的瓶颈,结束了国内近三十年来除紫杉醇外无突破性化疗药物的局面,将为我国晚期乳腺癌患者带来新希望。
3. 帕米帕利胶囊
公司:百济神州
适应症:用于既往经过二线及以上化疗的伴有胚系BRCA(gBRCA)突变的复发性晚期卵巢癌、输卵管癌或原发性腹膜癌患者的治疗
化学结构式:
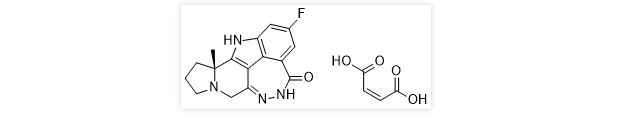
2021年5月7日,国家药品监督管理局通过优先审评审批程序附条件批准百济神州(苏州)生物科技有限公司申报的1类创新药帕米帕利胶囊(商品名:百汇泽)上市,用于既往经过二线及以上化疗的伴有胚系BRCA(gBRCA)突变的复发性晚期卵巢癌、输卵管癌或原发性腹膜癌患者的治疗。
帕米帕利是一种PARP-1和PARP-2的强效、选择性抑制剂。它通过抑制肿瘤细胞DNA单链损伤的修复和同源重组修复缺陷,对肿瘤细胞起到合成致死的作用,尤其对携带BRCA基因突变的DNA修复缺陷型肿瘤细胞敏感度高。帕米帕利胶囊上市为复发性晚期卵巢癌、输卵管癌或原发性腹膜癌患者提供了新的治疗选择。
4. 注射用维迪西妥单抗
公司:荣昌生物
靶点:HER2;Tubulin
适应症:用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗
作用机制:
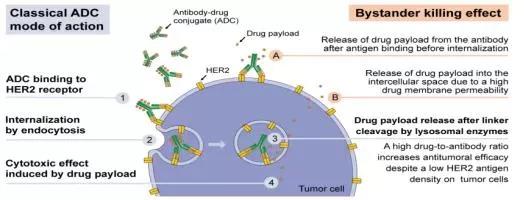
2021年6月9日,NMPA附条件批准荣昌生物自主研发的注射用维迪西妥单抗上市,这是国内第三个获批的ADC抗体,也是首个国产ADC。
纬迪西妥单抗(RC48)是由荣昌生物自主研发的靶向HER2的ADC药物,于2020年8月向国家药监局提交该药上市申请,上市申请的适应症为HER2阳性局部晚期或转移性尿路上皮癌。
2021年6月4日(美国东部时间),在美国临床肿瘤学会(ASCO)第57届年会上,荣昌生物以壁报讨论(PosterDiscussion)、壁报(Poster)等形式,公布了维迪西妥单抗多项临床研究的最新数据,该药在尿路上皮癌及乳腺癌领域取得的新突破令人振奋。纬迪西妥单抗用于HER2过表达局部进展或转移性尿路上皮癌的单臂多中心Ⅱ期临床研究,是RC48用于既往多线化疗失败后的HER2过表达局部进展或转移性尿路上皮癌的治疗。2018年12月至2020年9月共入组64例患者,其中既往接受过二线及以上治疗的患者为85.9%,截至2021年3月,独立影像学评估的客观有效率达到50%,中位无进展生存时间为5.1个月,中位生存时间为14.2个月,临床数据亮眼。
5. 甲磺酸多纳非尼片
公司:泽璟制药
靶点:RAF;Receptor protein-tyrosine kinase
适应症:用于既往未接受过全身系统性治疗的不可切除肝细胞癌患者
分子结构式:
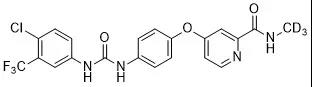
2021年6月9日,泽璟制药1类新药甲苯磺酸多纳非尼片已获得国家药监局批准上市(受理号:CXHS2000010),用于既往未接受过全身系统性治疗的不可切除肝细胞癌患者。
甲苯磺酸多纳非尼片是一种口服多靶点、多激酶抑制剂类小分子抗肿瘤药物,其中,多纳非尼既可抑制VEGFR、PDGFR等多种受体酪氨酸激酶的活性,也可直接抑制各种Raf激酶,并抑制下游的 Raf/MEK/ERK 信号传导通路,抑制肿瘤细胞增殖和肿瘤血管的形成,发挥多重抑制、多靶点阻断的抗肿瘤作用。
多纳非尼片一线治疗晚期肝癌列入了《CSCO原发性肝癌诊疗指南2020》(为I级专家推荐和1A类证据)、《肝癌肝切除围手术期管理中国专家共识(2021年版)》(为一级推荐)、《肝癌靶向治疗专家共识(草案)-2020》、《中国肝癌多学科综合治疗专家共识》和《中国原发性肝细胞癌放射治疗指南(2020年版)》。
6. 赛沃替尼片
公司:和黄医药
靶点:c-Met/HGFR
适应症:用于治疗间质-上皮转化因子(MET)外显子14跳变的局部晚期或转移性的非小细胞肺癌
分子结构式:
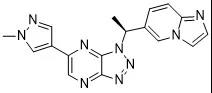
6月23日,NMPA通过优先审评程序附条件批准和黄医药的1类创新药赛沃替尼片以商品名沃瑞沙/ORPATHYS上市,成为国内首个获批的特异性靶向MET激酶的小分子抑制剂。
赛沃替尼是一种小分子MET抑制剂,可选择性抑制MET激酶的磷酸化,对MET ex14跳跃突变的肿瘤细胞增殖有明显的抑制作用。研究表明,在MET ex14跳跃突变的肺肉瘤样癌及其他NSCLC患者中,赛沃替尼显示出令人鼓舞的客观缓解率,具有良好的有效性及安全性;而且无论病理亚型和既往治疗如何,都观察到了相似的肿瘤缓解。
7. 阿基仑赛注射液
公司:复星凯特
靶点:CD19
2021年6月22日,国家药监局官网显示,复星凯特靶向CD19的CAR-T细胞疗法阿基仑赛注射液(axicabtagene ciloleucel)在中国的上市申请(受理号:CXSS2000006)获得NMPA批准上市,这是国内首个获批上市的CAR-T疗法。
目前全球共有5款CAR-T疗法获批上市,4款靶向CD19,1款靶向BCMA,分别是诺华的Kymriah(2017年8月获批),吉利德的Yescarta和Tecartus(2017年10月、2020年7月获批),百时美施贵宝的Breyanzi 和Abecma(2021年2月、2021年3月获批)。
复星凯特于2017年初从美国KitePharma引进Yescarta(阿基仑赛),获得全部技术授权,并拥有其在中国包括香港、澳门的商业化权利,并于中国境内(不包括港澳台)进行本地化生产。在完成治疗成人复发难治性大B细胞淋巴瘤的中国境内桥接临床试验后,2020年2月复星凯特在国内提交了阿基仑赛注射液上市申请,用于治疗治疗成人复发难治性大B细胞淋巴瘤,包括弥漫性大B细胞淋巴瘤(DLBCL)非特指型、原发性纵隔B细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的DLBCL,并于3月13日被CDE纳入优先审评。
作为国内第一款获批上市的CAR-T疗法,传闻中的高达120w的定价也在网络上引起了不小争议,市场表现值得期待。
二、4款抗感染新药
1. 注射用磷酸左奥硝唑酯二钠
公司:扬子江药业
靶点:DNA
适应症:用于治疗由厌氧消化链球菌、衣氏放线菌、牙龈卟啉单胞、脆弱拟杆菌、产气荚膜梭菌、产黑色素普氏菌等多种厌氧菌感染引起的多种疾病。此外,也可用于术前预防感染和术后厌氧菌感染的治疗
分子结构式:
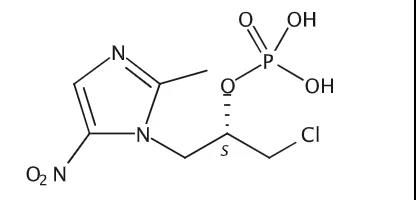
2021年5月26日,扬子江药业集团自主研发的注射用磷酸左奥硝唑酯二钠(商品名:新锐®)获批上市,批准文号:国药准字H20210018。这也是扬子江药业获批上市的首个国产化学1类新药,标志着企业的研发创新跨入一个新的里程碑。
磷酸左奥硝唑酯二钠为硝基咪唑类抗生素,为奥硝唑拆分药物左奥硝唑的前体药物。通过静脉输注进入人体,可迅速转化为左奥硝唑,研究结果显示,磷酸左奥硝唑酯二钠进入人体内,完全遵循左奥硝唑的代谢规律,两者具有生物等效性特征。
磷酸左奥硝唑酯二钠解决了奥硝唑水溶性差的问题,无需添加奥硝唑注射液使用的乙醇、丙二醇有机溶剂增溶,减少了有机溶剂引起的不良反应风险。其pH值接近人体血浆pH,血管刺激性小,患者用药舒适程度更高。
2. 苹果酸奈诺沙星氯化钠注射液
公司:浙江医药
靶点:bacterial topoisomerase II
适应症:用于治疗对奈诺沙星敏感的由肺炎链球菌、金黄色葡萄球菌、流感嗜血杆菌、副流感嗜血杆菌、卡他莫拉菌、肺炎克雷伯菌、大肠埃希菌、铜绿假单胞菌、鲍曼不动杆菌以及肺炎支原体、肺炎衣原体和嗜肺军团菌所致的轻、中、重度成人(≥18岁)社区获得性肺炎。
肺炎分子结构式:
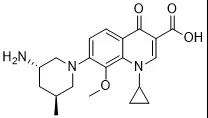
2021年6月21日,浙江医药公告,近日收到国家药品监督管理局核准签发的苹果酸奈诺沙星氯化钠注射液 250ml:0.5g 的《药品注册证书》。

奈诺沙星是全球首个无氟喹诺酮药物,具有广谱的抗革兰阴性菌、革兰阳性菌和非典型病原菌的生物活性,且加强了对耐药阳性菌的抗菌活性,能有效对抗日益泛滥的多种超级细菌,如抗药性金黄色葡萄球菌(MRSA)、万古霉素耐药细菌、AB菌等。
此外,奈诺沙星具有良好的药物安全性和极佳的组织穿透力,口服与注射剂型兼具,不易产生耐药性菌株,可作为社区获得性肺炎一线用药,并且具有其他适应症的延展性。
3. 艾米替诺福韦片
公司:豪森药业
靶点:reverse transcriptase (RT)
适应症:用于慢性乙型肝炎成人患者的治疗
分子结构式:
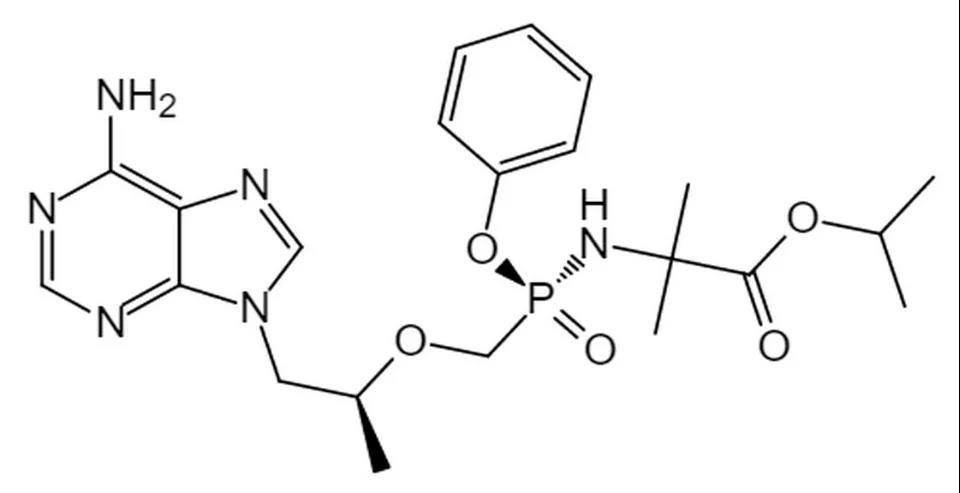
2021年6月23日,NMPA通过优先审评程序批准豪森药业1类创新药艾米替诺福韦片以商品名【恒沐】上市。艾米替诺福韦片是翰森制药自主研发的新型第二代替诺福韦,也是首个中国原研口服抗乙型肝炎病毒(HBV)药物。
富马酸艾米替诺福韦片是一种新型核苷酸类逆转录酶抑制剂,通过优化结构,拥有更高细胞膜穿透率,更易进入肝细胞,实现肝靶向,同时有效提高药物血浆稳定性,降低全身 TFV 暴露,长期治疗更安全。
作为替诺福韦(TFV)的前药,通过优化结构,艾米替诺福韦比替诺福韦拥有更高血浆稳定性,TFV 暴露量低,安全性更高;经肝细胞代谢,活性代谢产物双磷酸替诺福韦(TFV-DP)在肝脏高浓度聚集,从而实现肝靶向,提升了药物的利用度。
与富马酸替诺福韦酯 (Viread,TDF)300 mg 相比, 艾米替诺福韦只需要少于 1/10 的剂量便可获得相似的抗病毒效用, 药物对骨密度及肾脏影响较小。临床前研究结果显示了艾米替诺福韦的强效抑制乙型肝炎病毒(HBV)复制效应。早期临床研究结果也证实该药在健康志愿者和慢性乙型肝炎(CHB)患者中的良好耐受性和安全性,PK 特征和疗效符合预期。
4. 艾诺韦林片
公司:艾迪药业
靶点:HIV-1 RT
适应症:与核苷类抗逆转录病毒药物联合使用,治疗成人HIV-1感染初治患者
分子结构式:
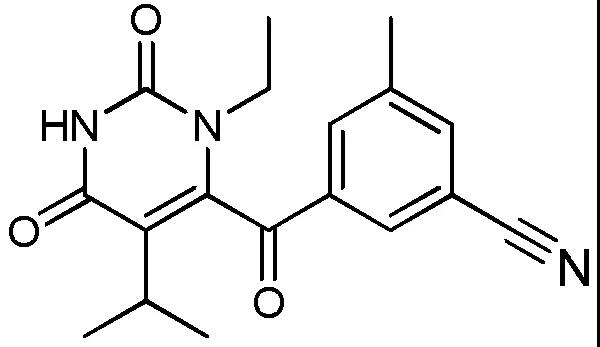
2021年6月25日晚,据中国国家药监局药品审评中心(CDE)最新审评信息,艾迪药业1类新药艾诺韦林片(研发代号:ACC007片)获批上市。
艾诺韦林片是全新一代非核苷类逆转录酶抑制剂,通过非竞争性结合并抑制HIV逆转录酶活性,从而阻止病毒转录和复制。临床前研究显示,艾诺韦林片不易产生耐药性,对野生型HIV病毒、常见耐药性突变病毒(K103N、Y181C)均具有较高体外活性。
3. 抗感染、自身免疫、血液系统等共5款新药
1. 注射用泰它西普
公司:荣昌生物
靶点:APRIL;BAFF/BLyS
适应症:系统性红斑狼疮(SLE)
作用机制:
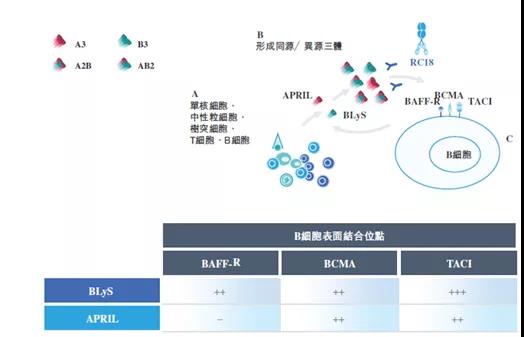
2021年3月9日,国家药品监督管理局官网显示:荣昌生物1类新药注射用泰它西普(商品名:泰爱,批准文号:国药准字S20210008)正式获批上市,其适应症为系统性红斑狼疮(SLE)。
值得一提的是,泰它西普是近60年来第二个获批的SLE治疗领域的新药。荣昌生物招股书显示,中国大陆地区SLE患者数量由2015年的99.5万人增加到2019年的102.8万人,年复合增长0.8%,预计到2025年中国SLE患者人数达107.83万人,泰它西普市场前景广阔。
未来,泰它西普还有潜力用于其它多种拥有巨大未满足临床需求的自身免疫适应症,如治疗IgA肾炎、干燥综合征、视神经脊髓炎、多发性硬化症和重症肌无力等领域。目前,这些领域的相关试验已经启动,其中多个适应症还将启动全球多中心临床研究,未来可期。
2. 注射用磷丙泊酚二钠
公司:人福药业
靶点:GABAAR
适应症:全身麻醉时的静脉诱导
化学结构式:
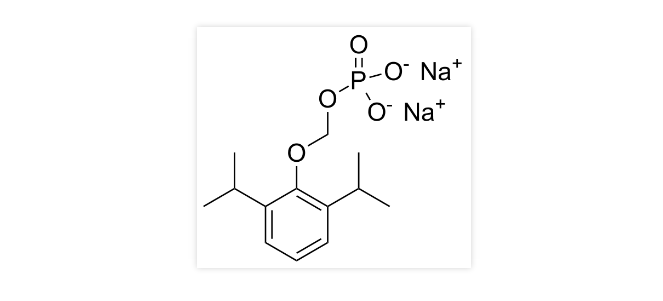
NMPA发布2021年05月24日药品批准证明文件待领取信息发布,其中宜昌人福药业有限责任公司注射用磷丙泊酚二钠1类新药重磅获批!
磷丙泊酚钠是一种新型短效静脉全身麻醉药,它在体内被代谢成活性物质丙泊酚后产生麻醉作用。丙泊酚是目前临床广泛使用的一种静脉全身麻醉药,由于其起效快、半衰期短、清除率高、靶控输注方便,在国内外被广泛地应用于临床麻醉和ICU镇静。但丙泊酚在临床应用中也存在一些不良反应,主要与丙泊酚以脂肪乳为载体的制剂形式有关,如引起注射部位疼痛、血栓性静脉炎、高脂血症、潜在的致命性细菌感染、过敏反应以及严重而少见的丙泊酚输注综合征等。
本产品通过对丙泊酚的化学结构进行修饰,改变其剂型(专利:一种新的前体药物制剂,专利号:ZL200910250194.X),使其具备良好的水溶性,不需要目前常用的丙泊酚制剂的脂肪乳载体,从而在发挥其药理作用的基础上减少上述不良反应的发生。
3. 康替唑胺片
公司:盟科药业
靶点:50S ribosomal subunit
适应症:用于治疗对康替唑胺敏感的金黄色葡萄球菌(甲氧西林敏感和耐药的菌株)、化脓性链球菌或无乳链球菌引起的复杂性皮肤和软组织感染。
分子结构式:
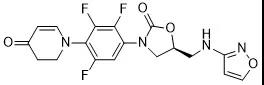
2021年6月2日,国家药品监督管理局通过优先审评审批程序批准上海盟科药业1类创新药康替唑胺片(商品名:优喜泰)上市。该药品是我国自主研发并拥有自主知识产权的创新药,用于治疗对康替唑胺敏感的金黄色葡萄球菌(甲氧西林敏感和耐药的菌株)、化脓性链球菌或无乳链球菌引起的复杂性皮肤和软组织感染。
4. 海曲泊帕乙醇胺片
公司:恒瑞医药
靶点:TpoR
适应症:用于因血小板减少和临床条件导致出血风险增加的既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症(ITP)成人患者,以及对免疫抑制治疗疗效不佳的重型再生障碍性贫血(SAA)成人患者。其中SAA适应症为附条件批准。
分子结构式:
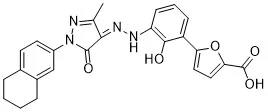
2021年6月17日,NMPA通过优先审评程序正式批准恒瑞医药1类创新药海曲泊帕乙醇胺片以商品名恒曲上市。海曲泊帕乙醇胺片是恒瑞自主研发的口服小分子非肽类促血小板生成素受体(TpoR)激动剂。
同类产品艾曲泊帕(Eltrombopag,PROMACTA®)是葛兰素史克公司研发的非肽类 TPO-R 激动剂,最早于 2008 年获美国 FDA 批准上市。2017 年 12 月 ,诺华的艾曲泊帕在中国获批上市,商品名为瑞弗兰®,用于特发性血小板减少性紫癜(ITP)患者。
据了解,恒瑞医药对艾曲泊帕进行了一系列结构的修饰,研究开发具有自主知识产权的 1 类创新药:高选择性 TPO-R 激动剂海曲泊帕乙醇胺片。目前,国内已获批的TpoR药物有三生制药重组人血小板生成素、诺华的艾曲泊帕乙醇胺片,以及复星医药引进 AkaRx, Inc. 公司的「阿伐曲泊帕片」。
5. 海博麦布片
公司:海正药业
靶点:NPC1L1
适应症:原发性高胆固醇血症
分子结构式:
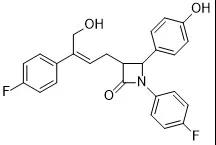
2021年6月25日,NMPA 官网显示,浙江海正药业 1 类新药「海博麦布片」获批上市,用于原发性高胆固醇血症。
海博麦布片(曾用名:海泽麦布片)是一种胆固醇吸收抑制剂,通过作用于肠道和肝细胞表面的NPC1L1蛋白受体,选择性地抑制胆固醇的吸收,从而降低小肠中的胆固醇向肝脏中的转运,降低血胆固醇水平及肝脏胆固醇贮量。目前国内仅依折麦布片及其复方依折麦布辛伐他汀片,和海博麦布片3款原发性高胆固醇血症药物获批上市,海博麦布片市场表现值得期待。





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论