

12月19日,中国专注于眼科疾病的体内基因治疗领导者纽福斯生物科技有限公司(下称“纽福斯”)宣布公司第二款眼科基因治疗药物NFS-02(rAAV2-ND1),用于治疗ND1突变引起的Leber遗传性视神经病变(ND1-LHON),获美国食品药品监督管理局(FDA)的新药临床试验(IND)许可,并将在美国开展临床试验。
NFS-02注射液是一项处于研发阶段的体内眼科基因治疗药物,此前已于2021年1月获得美国FDA孤儿药认证。此次在美国获批的临床试验是一项国际多中心的、单臂开放标签、剂量探索的I/II期临床研究。该研究将在ND1线粒体基因突变引起的Leber遗传性视神经病变(LHON)患者中评价NFS-02注射液基因治疗的安全性、耐受性和有效性。

纽福斯创始人、董事长兼首席执行官
李斌教授
纽福斯创始人、董事长兼首席执行官李斌教授表示:“我们非常高兴NFS-02获得了FDA的IND许可,这标志着纽福斯的第二款药物将进入临床阶段。我们的首个产品旨在治疗ND4突变引起的Leber遗传性视神经病变,此次我们继续推进基因治疗管线进展,开发了针对ND1突变引起的LHON的眼科基因治疗药物,希望每一位患者都能够拥抱光明的未来。”

纽福斯首席医学官
郭晓宁博士
“这项新药临床试验许可是纽福斯的重要里程碑。基于良好的临床前数据,我们相信NFS-02有望安全和有效地治疗ND1突变引发的Leber遗传性视神经病变。”纽福斯首席医学官郭晓宁博士说,“我将带领纽福斯优秀的团队开展NFS-02的临床试验,计划于明年启动美国受试者招募工作,全力推进I/II期临床。”

纽福斯药政注册高级副总裁
陈一元
“这项许可是对纽福斯研发能力的极大认可。”纽福斯药政注册高级副总裁陈一元说,“我们很高兴有机会将中国的基因疗法带给美国的病人和医生,突显公司‘立足中国,放眼世界’的战略。”
关于LHON
Leber遗传性视神经病变(LHON)是一种母系遗传的线粒体疾病,发病率约为1/31000至1/54000,多发于14-21岁的青年男性,患者表现为双目视力受损至失明,这一疾病由德国眼科医生Theodor Leber于1871年首先发现。90%的LHON是由3个线粒体DNA突变所导致的,G11778A(ND4基因)、G3460A(ND1基因)、T14484C(ND6基因),其中ND4的G11778A突变最多,约占50%~80%。由于该突变使细胞线粒体生物呼吸链功能受损,造成ATP生成减少,使患者视神经节细胞产生氧化应激,导致细胞凋亡。目前临床上尚无针对Leber遗传性视神经病变的有效疗法或治愈手段。
关于NFS-02
据药融云数据库显示,NFS-02是一种重组腺相关病毒血清型2载体(rAAV2)的新型体内注射的眼科基因治疗药物,采用了MT-ND1基因刺激剂作用机制,目前正在开发用于治疗与ND1突变相关的Leber遗传性视神经病变(LHON)。NFS-02作用机制为采用基因治疗策略,以重组腺相关病毒作为载体,通过单次玻璃体内注射,将正确的基因通过玻璃体腔注射递送至患者受损的视神经节细胞,修复线粒体生物呼吸链,使视神经节细胞恢复活力与视功能。
NFS-02药物基本信息(部分)
截图来源:药融云全球药物研发数据库
关于纽福斯
纽福斯是中国专注于眼科疾病体内基因治疗行业领导者。纽福斯在武汉、苏州、上海和美国圣地亚哥设有子公司,致力为全球患者研发针对遗传疾病的眼科基因治疗药物。研究者发起的视网膜基因治疗研究的试验数据成功地验证了我们使用的AAV平台,研究结果已经发表在Nature-Scientific Report、Ophthalmology和EbioMedicine上。我们的核心产品NR082,旨在治疗ND4介导的Leber遗传性视神经病变(ND4-LHON),已被美国FDA和欧洲药品管理局(EMA)授予孤儿药称号(ODD),是首个同时获得中国NMPA及美国FDA授予的临床试验IND许可的中国籍基因治疗新药。目前已完成中国III期临床试验首例患者入组给药。公司第二款眼科基因治疗药物NFS-02已被美国FDA授予IND许可。公司管线还包括常染色体显性视神经萎缩,光学神经保护,血管视网膜病变等临床前候选药物。
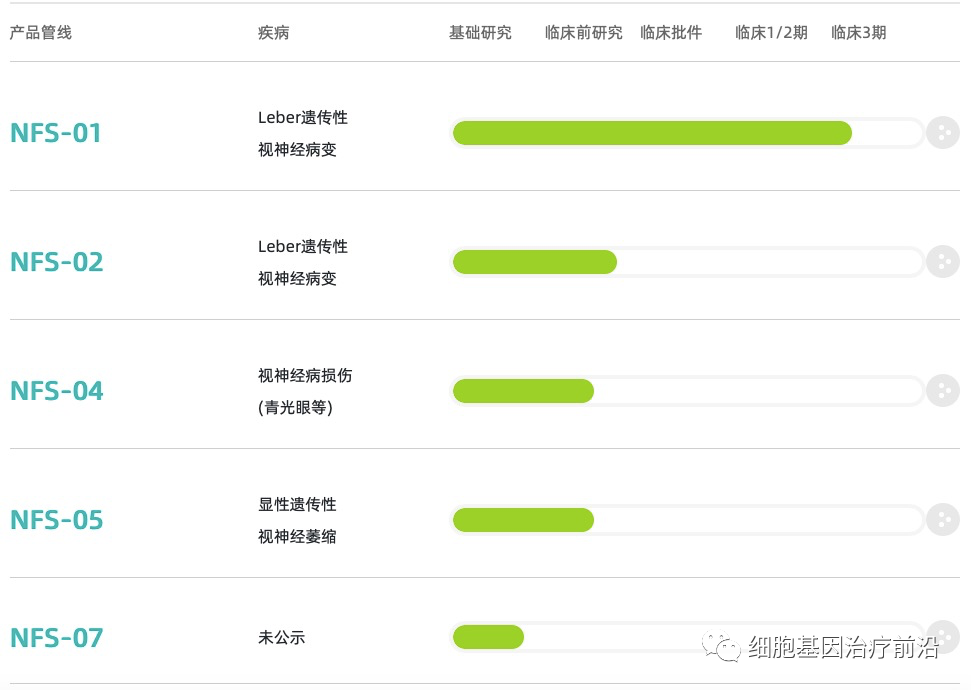
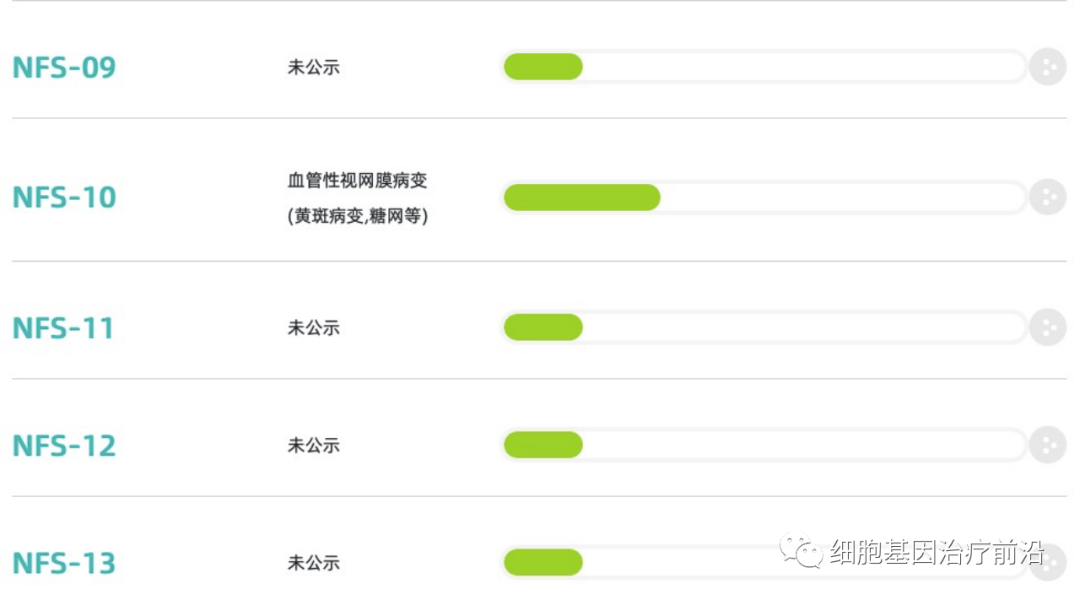
纽福斯研发管线
参考资料:
[1] 纽福斯官网
[2] 药融云数据库vip.pharnexcloud.com/?zmt-mhwz
<END>






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论