
10月20日,Replimune,一家致力于开发新型溶瘤免疫疗法的临床阶段生物技术公司,宣布美国食品药品监督管理局 (FDA) 已接受RP1联合纳武利尤单抗(Nivolumab)用于治疗接受含抗PD-1方案治疗后病情进展的晚期黑色素瘤患者的生物制品许可申请 (BLA),FDA设定的PDUFA日期为2026年4月10日。

该公司股价在盘前交易中一度暴涨127%,冲至10.23美元/股。截至发稿,该股涨超98%,报8.95美元/股,成交额9.82亿美元,总市值6.98亿美元。
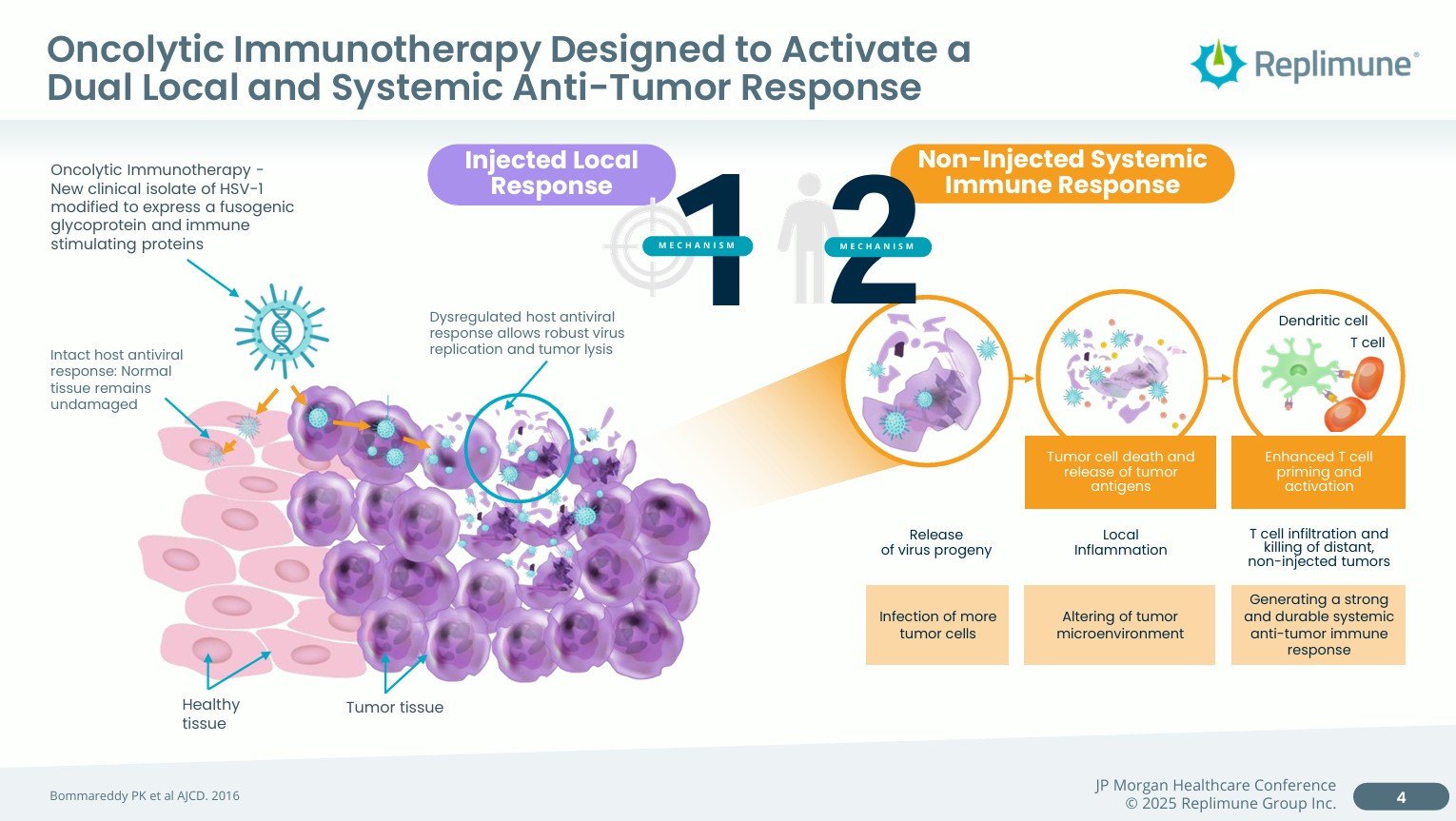
RP1(vusolimogene oderparepvec)是Replimune开发的一款溶瘤病毒,将其专有的单纯疱疹病毒经过融合蛋白(GALV-GP R-)和GM-CSF的改造和基因武装,旨在最大限度地提高肿瘤杀伤效力、肿瘤细胞死亡的免疫原性和全身抗肿瘤免疫反应的激活。
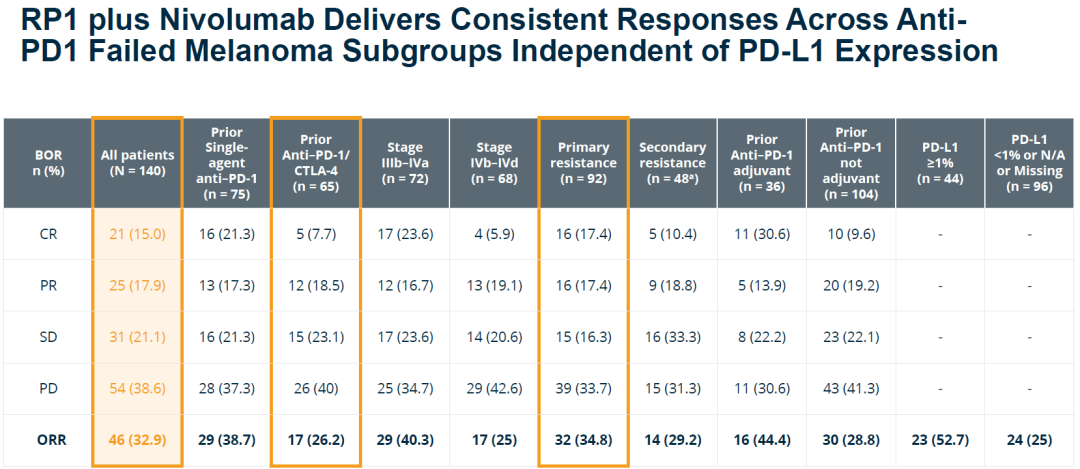
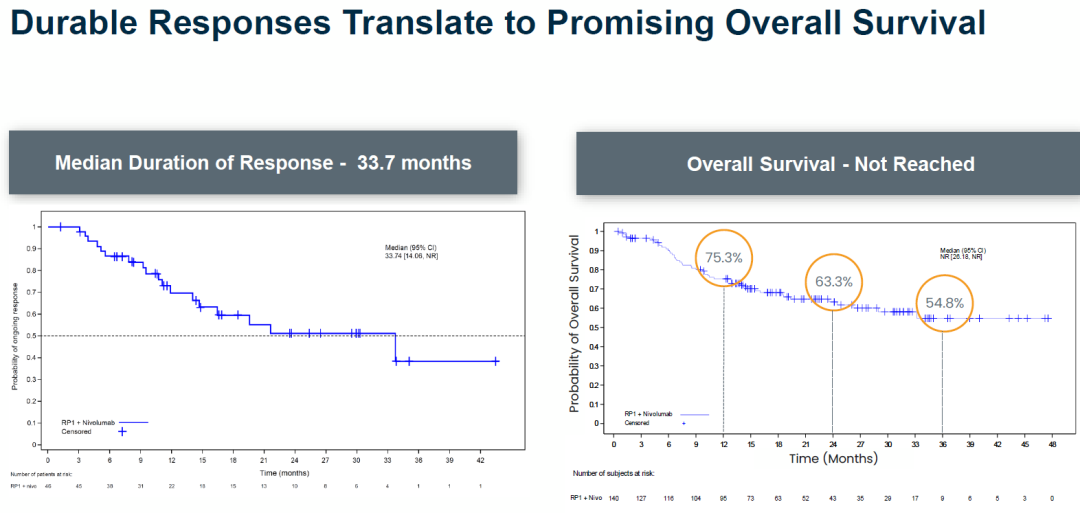
2024年11月,Replimune基于II期IGNYTE研究的结果向FDA递交了RP1的上市申请。该研究纳入了140例既往接受PD-1药物治疗后疾病进展的晚期黑色素瘤患者。结果显示,确认的客观缓解率(ORR)为32.9%,中位缓解持续时间(DOR)为33.7个月,总生存期(OS)达到1年和2年的患者比例分别为75.3%和63.3%。
在2025年7月22日,Replimune宣布溶瘤病毒疗法RP1联合PD-1抗体治疗晚期黑色素瘤的上市申请收到FDA的完全回复函(CRL),FDA认为IGNYTE临床试验未能提供充分的疗效证据,并指出不能完全归因于受试人群的异质性,同时验证临床的设计也存在问题。
受此消息影响,Replimune当时股价大跌77%。

在过去的几个月里,Replimune 一直在努力处理机构的反馈意见。补充信息、数据和分析已包含在重新提交的申请中,该申请将作为生物制品许可申请 (BLA) 审查的一部分。FDA表示,此次重新提交的申请被视为对2025年7月收到的完整回复函的完整回复。
“我们很高兴FDA接受了我们重新提交的RP1生物制品许可申请(BLA),”Replimune首席执行官Sushil Patel博士表示。“RP1联合纳武利尤单抗具有显著的风险收益特征,而对于在PD-1疗法基础上进展的晚期黑色素瘤患者来说,目前几乎没有其他选择。我们期待与FDA密切合作,尽可能加快审查进程,造福患者。”
参考资料:公司公告
想要解锁更多药企信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论