注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及)。因水平有限,错误不可避免,或有些信息非最及时,欢迎留言指出。

全整合型生物制药公司创胜集团,在港上市已经正式排上日程。9月14日,创胜集团-B(06628)开始招股,此次拟发行4033万股,其中90%为国际发售,10%为公开发售,另有最多15%超额配股权。每股发行价15.8-16港元,预期9月29日上市。创胜集团-B(06628)拟将本次香港IPO收取所得款项净额的82%用于集团管线候选产品的研发、为进行中及计划中的临床及临床前试验、筹备注册备案以及其他与商业化集团四款主打产品有关的步骤或活动拨资;所得款项净额的8%用于为扩充管线及开发技术的业务发展拨资,重点用于能够与集团的现有管线形成协同效应并有良好前景的临床证据的肿瘤资产、能够补充集团现有发现及开发平台的技术平台(如ADC)、小分子靶向疗法及其他先进新技术;所得款项净额的10%用作一般营运资金及一般营运费用。
创胜集团于2019年由迈博斯生物(MabSpace)和奕安济世生物药业 (HJB) 合并而来,是一家临床阶段的在生物药研发、临床及工艺开发和生产方面具有全面综合能力的国际化生物制药公司。公司总部位于苏州,在苏州设有药物发现、临床和转化研究中心,在杭州拥有工艺与产品开发中心以及药物生产基地,在北京、上海、广州和美国普林斯顿分别设有临床开发中心,并在美国波士顿、洛杉矶设立了对外合作中心。2021年7月19日,创胜集团宣布位于杭州医药港的工艺与产品开发中心、药物生产基地实现生物制药生产工艺与产能双升级。
截至 2021 年 7 月,创胜集团的融资总额超过 3.42 亿美元。豪华投资者包括:礼来亚洲基金、淡马锡、ARCH Ventures Partners、中国国有企业结构调整基金、Teng Yue Partners、高瓴资本及红杉资本中国基金等,其中红杉资本、礼来亚洲基金等参与了多轮投资,2020年12月交叉轮融资中获得1.05亿美元,由中国国有企业结构调整基金领投,碧桂园创投、卡塔尔投资局及多家机构作为新投资者参与投资。

据悉,2021年9月,创胜集团已与基石投资者订立基石投资协议,基石投资者已同意在满足若干条件情况下,认购或促使其指定实体认购以发售价购买的总金额约6800万美元(约5.28亿港元)的相关数目发售股份。基石投资者包括礼来亚洲基金、淡马锡、卡塔尔投资局、及中国国有企业结构调整基金。
2021年6月22日,香港交易所披露了创胜集团通过聆讯的招股书。从财务基本面上可知,创胜集团已经获得上亿元营收,但暂未实现盈利。在港挂牌上市后,通过资本赋能融资支持下,对目前主要候选药物的开发与商业化将会有所帮助。
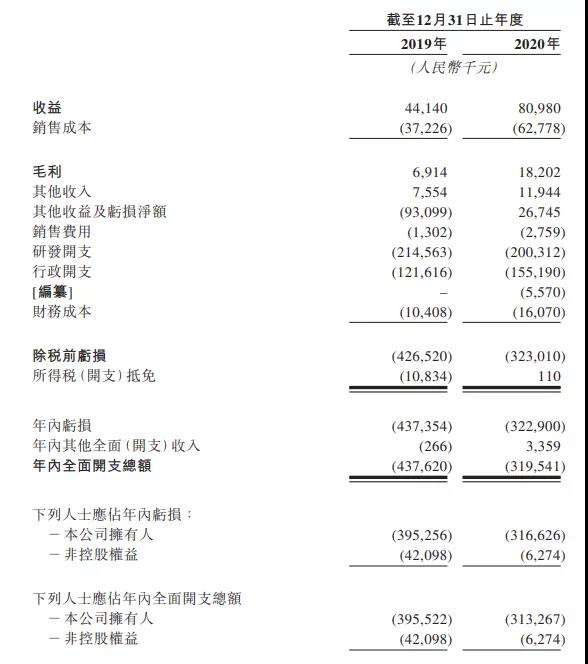
据招股书显示,创胜集团在2019年、2020年的营收分别为4414.0万元、8098.0万元,毛利分别为691万元、1820万元,年内亏损分别为4.37亿元、3.23亿元。支出方面,2019年、2020年公司的研发开支分别为2.15亿元、2.00亿元,占比分别为486.10%、247.36%;销售费用分别为130.2万元、275.9万元,占比分别为2.95%、3.41%;行政开支分别为1.22亿元、1.55亿元。
由于多款新药仍然在临床开发阶段,创胜集团目前大部分收益来自根据CDMO合约向客户(主要为制药及生物科技公司)提供合约研发生产组织(CDMO)服务,2019年及2020年,CDMO服务所得收益分别为人民币4414万元及人民币8098万元,CDMO服务所得毛利分别为人民币690万元及人民币1820万元。
公司预计未来将进一步加大研发投入,继续进行候选药物的临床开发并寻求监管批准,启动管线产品的商业化,并增加必要人员运营囊括先进临床候选产品管线的一体化平台。
潜力靶点,扩张管线
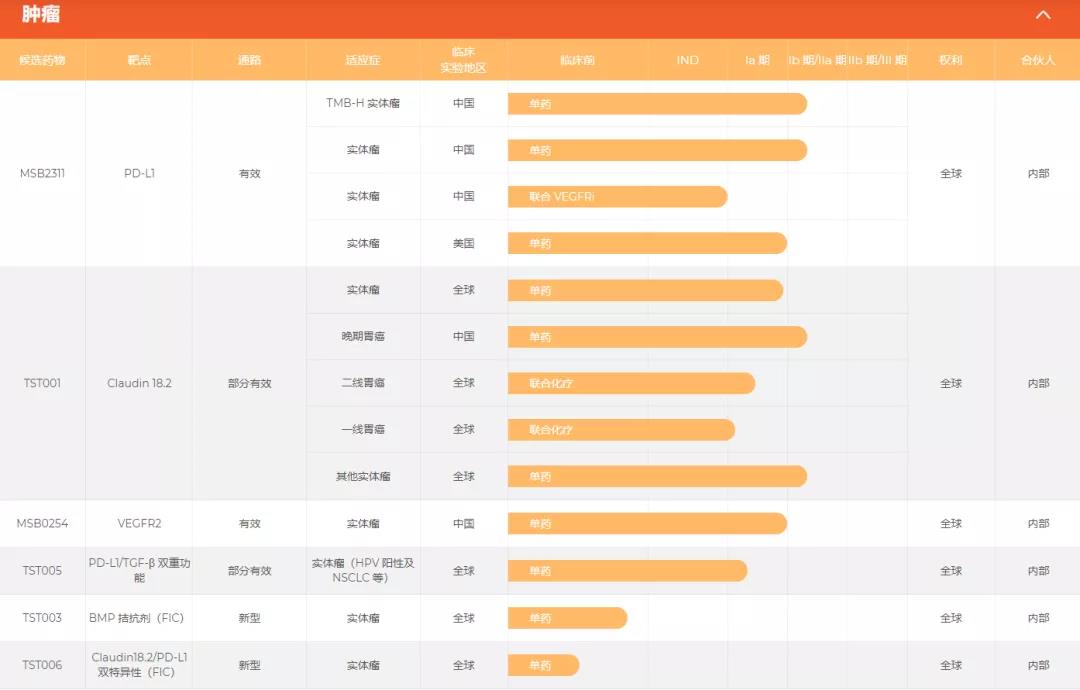
肿瘤治疗领域,创胜集团有6个在研药物,包括PD-L1、Claudin18.2、VEGFR2等热门靶点。在港股IPO之前,创胜集团已自主发现及开发九种候选药物中的八种,其中有1种核心产品——MSB2311,它是一种针对TMB-H实体瘤的人源化PD-L1单克隆抗体(单抗)候选药物,与其他PD-(L)1抗体相比具有独特性,MSB2311乃借助IMTB平台及内部抗体库自主发现及开发,基于其pH依赖性PD-L1结合特性,为首个且唯一一个「再循环」PD-L1抗体,可极大延长药物在肿瘤的停留时间及提高体内对肿瘤的杀伤活性。此外,作为pH依赖性PD-L1抗体,MSB2311具有很强的IP地位,并在美国及大中华区获授专利。

(创胜集团MSB-2311信息,来源于药融云数据库)
关键候选药物:TST001,它是一种针对胃癌等实体瘤的人源化Claudin 18.2单抗候选药物。研究表明,Claudin 18.2在正常组织中的表达受到高度限制,其异常表达发生在胃癌、胰腺癌、食管癌和卵巢癌等癌种中,它参与肿瘤的发生发展并且位于外细胞膜,可与单克隆抗体、双特性抗体、CAR-T细胞等结合,以上特性都表明Claudin 18.2作为当前极具前景的肿瘤靶向治疗靶点已然成为了研究的热点。

2021年7月28日,创胜集团宣布,FDA授予抗Claudin18.2单抗TST001孤儿药资格认定,用于治疗胃癌及胃食管连接部癌。2021年8月18日,创胜集团启动Claudin18.2单克隆抗体TST001的Ⅱa期临床试验,TST001的Ⅱa期临床为一个开放性、单臂、多中心的研究,旨在进一步评估TST001在Claudin18.2表达的包括胃癌的多个实体瘤病人中的安全性、耐受性、抗肿瘤疗效。Claudin18.2靶点风云际会,创胜集团TST001单抗临床速度中国领先!
根据药融云数据库www.pharnexcloud.com显示,当前全球范围内靶向Claudin18.2靶点的产品类型涉及单克隆抗体、双特异性抗体、CAR-T以及ADC,其中以单克隆抗体在研数量最多。国内布局Claudin 18.2靶点的企业除了创胜集团,还包括奥赛康、北京天广实、恒瑞医药、明济生物、南京传奇生物等多家药企,可谓是玩家诸多。
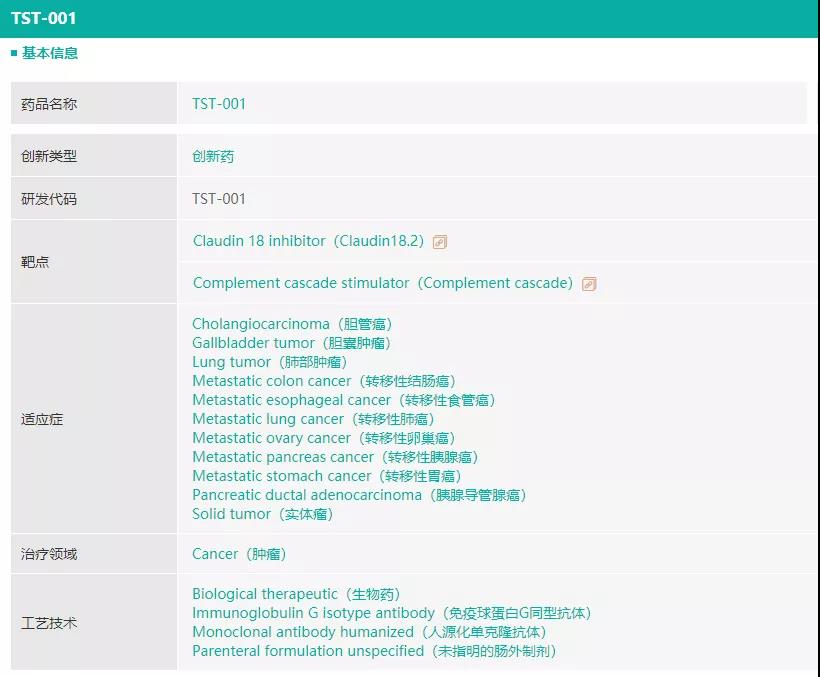
(创胜集团TST001信息,来源于药融云数据库)
TST005,一种针对肺癌等实体瘤的PD-L1/TGF-β(转化生长因子β是一种多功能生长因子,影响细胞分化、增殖、凋亡及基质产生)双重功能抗体候选药物,设计为同时靶向两个免疫抑制通路,即转化生长因子-β(TGF-β)及程序性细胞死亡配体-1(PD-L1),其通常被癌细胞用于逃逸免疫系统作为多种癌症适应症的治疗方案具有巨大市场潜力。
2021年7月15日,公司宣布TST005 的全球 I 期临床研究已顺利完成美国首例患者给药。
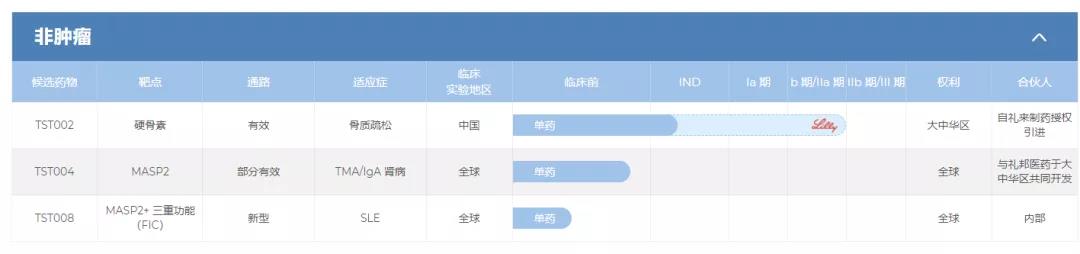
在非肿瘤治疗领域,公司有三种候选药物,其中TST002 (Blosozumab)是一种针对骨质疏鬆的人源化硬骨素单抗候选药物,礼来于美国和日本完成对Blosozumab的Ⅱ期研究后,创胜集团在2019年自礼来授权引进Blosozumab以在大中华区进行开发及商业化。
TST004,一种针对IgA肾病的人源化MASP-2(甘露聚糖结合凝集素丝氨酸蛋白酶2,一种激活补体凝集素途径的关键酶)单抗候选药物,公司计划开发TST004用于IgA肾病(IgAN)——一种患病率高且治疗选择非常有限的慢性肾脏疾病。目前,创胜集团正与礼邦医药合作在大中华区开发及商业化TST004用于治疗与TMA、肾脏疾病及血液疾病有关的若干适应症(不包括眼科及传染病适应症),并保留世界其他地区的权利。计划于2022年上半年前在美国及中国提交TST004的IND申请。
此外还有TST008,一种结合MASP2抗体并与截短的跨膜激活剂及CAML相互作用分子(TACI)蛋白融合的三重功能抗体,具有治疗自身免疫性疾病(如系统性红斑狼疮(SLE))的潜力。
除上述候选药物外,创胜集团亦正在开发多种前期创新生物候选药物。例如TST003,它是一种全球潜在同类首款靶向由肿瘤相关成纤维细胞或具有间充质表型的肿瘤细胞产生的新型免疫调节蛋白的抗体候选药物。在临床前研究中,TST003作为单药或与靶向药物联用时在靶标表达的人源肿瘤异种移植(PDX)模型已表现出抗肿瘤活性。此外,TST003作为单药显示出抗肿瘤活性及在多个同基因肿瘤模型中增强了检查点抑制剂的抗肿瘤活性。目前,TST003的IND筹备研究正在进行,并计划于2022年上半年提交用于治疗多种实体瘤的IND申请。
此外处于临床前阶段的还有TST006(一种双特异性Claudin 18.2/PD-L1抗体),在临床前研究中显示比单独的Claudin 18.2抗体更强效阻止表达Claudin 18.2及PD-L1的异种移植模型中肿瘤细胞的生长。
工艺产能,双重升级

IMTB
创胜集团开发了功能独有的抗体发现平台,即免疫耐受突破(IMTB)技术平台,使公司能够生成针对难以在啮齿动物中生成的非保守及保守蛋白质的抗体及透过使用传统平台发现难以发现的隐藏表位,这些使得他们能够获得具有经扩展的表位多样性、差异化的生物特性及强大的 CMC 特性的先导候选抗体,从而甄选具有增强的成药性及知识产权地位的候选分子。利用IMTB技术平台,已生成TST001,TST005和 MSB2311。
T-BLOC
创胜集团位于杭州医药港的工艺与制剂开发中心、药物生产基地总面积13,000平方米,建设有完整的CMC实验室和200L的中试车间及采用自主知识产权的模块化理念进行设计的GMP工厂T-BLOC。目前生产基地拥有2条500L及1条2,000L一次性生产线。截至2021年一季度,公司已经完成了30余批200-2000L规模的GMP生产。今年底生产基地还将新增一个500L和一个2000L的一次性生物反应器用于满足更多的管线产品开发和生产的需求。
ICB平台
2020年6月29日,创胜集团与默克订立合作协议,以进行生物加工制造行业的设备及技术开发,从而实施一体化连续制造。在合作的第一阶段,双方将重点进行相关硬件系统及软件程序的设计及交付,以实现符合GMP制造的连续精度纯化(包括病毒灭活后深度过滤、精纯层析及病毒过滤)。在合作的第二阶段,双方将重点进行完全连续制造生态系统(包括利用默克的Bio ContinuumTM技术平台进行GMP制造所需上游、下游及数字技术)的开发及交付。该平台可以用最低的商品成本获得最大的设施产量,提高工艺的稳健性,尽量降低运营风险。利用其先进的连续化生产工艺和T-BLOC工厂未来年产蛋白质产品超过一吨(1,000千克/年),完全可支持多个产品如治疗胃癌的Claudin18.2 抗体TST001和治疗骨质疏松的Sclerostin抗体TST002的商业化生产。
结 语
2018年港交所18A新规实施以来,众多未盈利的创新药企投奔港股市场,生物医药领域投资永远与风险相伴,因此这对于市场和这些企业来说既是机遇又是挑战。创胜集团诸多管线产品已然进入了临床试验关键阶段,在公司独特技术平台及团队的推进下,未来可期。
发展历程
- 2010年8月
- 于英属维尔京群岛成立Mabspace International Limited
- 2012年10月
- 成立迈博斯生物医药(苏州)有限公司
- 2013年6月
- 建立免疫耐受突破(IMTB)技术平台
- 2015年10月
- 迈博斯生物完成1500万美元A轮融资
- 2016年2月
- 奕安济世生物药业成立
- 2016年8月
- 奕安济世完成1000万美元A轮融资
- 2017年8月
- 奕安济世完成3700万美元B轮融资
- 2018年2月
- MSB2311的IND申请获FDA批准
- 2019年1月
- 迈博斯生物与奕安济世生物药业合并成立了创胜集团
- 2019年8月
- Claudin 18.2抗体提交PCT专利申请
- 2020年4月
- TST001的IND申请先后获得NMPA和FDA批准
- 2020年11月
- 与礼邦医药成立合营企业,在中国针对肾病共同开发TST004
- 2021年3月
- TST005向FDA提交IND申请
- 2021年7月
- TST002的IND申请获国家药监局受理;TST005全球一期临床试验完成美国首例患者给药
参考资料:
创胜集团官网;
创胜集团招股书;
NMPA/CDE;
药融云数据,www.pharnexcloud.com;
FDA/EMA/PMDA;
相关公司公开披露;
一图看懂创胜集团-B(6628.HK)IPO,格隆汇;
等等。
<END>






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论