
上周,全球减重药物市场迎来双重突破:中国国家药品监督管理局(NMPA)于6月27日正式批准信达生物与礼来制药联合研发的全球首款胰高血糖素(GCG)/胰高血糖素样肽-1(GLP-1)双受体激动剂「玛仕度肽」上市。

截图来源:NMPA官网
而诺和诺德则在6月26日举行的第85届美国糖尿病协会(ADA)科学年会上公布了其新型GLP-1/胰淀素受体双重激动剂「Amycretin」的Ⅲ期临床试验数据,相关结果同步发表于《柳叶刀》。

两大创新药物的同期亮相,标志着全球减重治疗正式迈入“双靶点时代”。
一、玛仕度肽:全球首款GCG/GLP-1双靶点药物
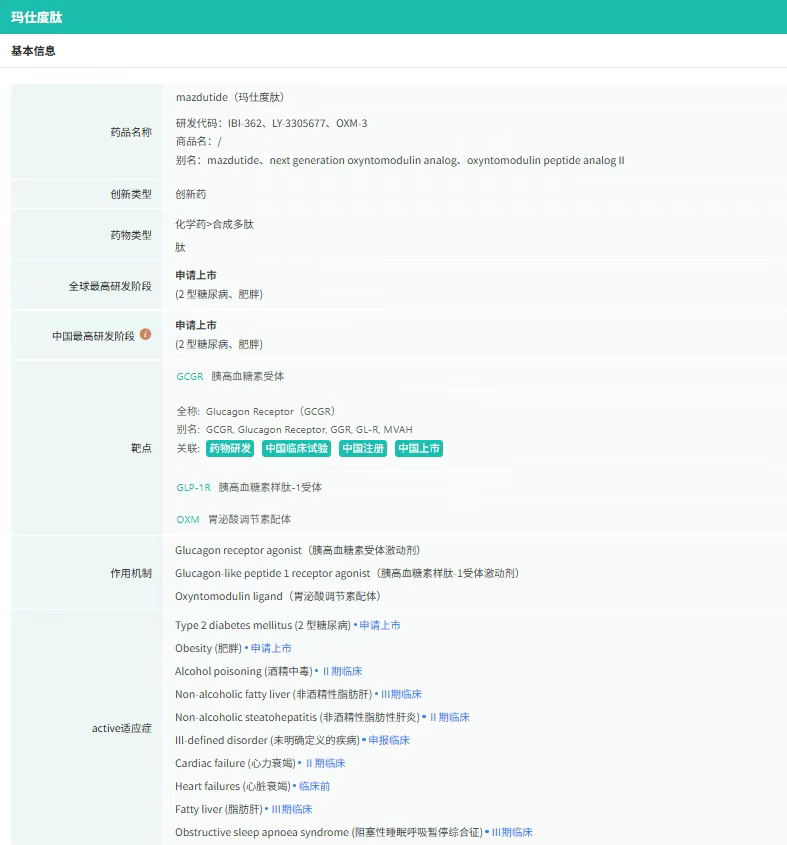
截图来源:摩熵医药全球药物研发数据库
玛仕度肽是全球首个获批的GCG/GLP-1双受体激动剂,其独特的作用机制通过双重路径实现代谢调控:
- GLP-1受体激活:抑制食欲、延缓胃排空、促进胰岛素分泌,辅助降低血糖;
- GCG受体激活:增加能量消耗,直接促进脂肪分解,并改善肝脏脂肪代谢。
这种“节流+开源”的协同作用,使玛仕度肽在减重效果上显著优于传统单靶点药物。Ⅲ期GLORY-1研究显示,治疗48周后:6mg剂量组平均减重14.8%,近半数患者体重降幅超过15%;4mg剂量组平均减重12.0%,体重降幅≥5%的患者比例达73.5%;安慰剂组仅减重0.5%。
玛仕度肽的疗效不仅体现在体重数字上,更通过多维度代谢指标改善为患者带来长期健康获益:
- 肝脏脂肪代谢:6mg剂量组治疗48周后,肝脏脂肪含量(LFC)平均相对降幅达80.24%,77.3%的患者实现脂肪肝消退(LFC<5%);
- 心血管风险因素:显著降低血压、血脂、血尿酸及转氨酶水平,改善胰岛素抵抗;
- 身体形态优化:腰围平均减少11cm,颈围减少3cm,体脂率下降明显。
玛仕度肽的获批标志着中国在减重药物创新领域迈入全球第一梯队。此前,全球减重市场由诺和诺德的司美格鲁肽和礼来的替尔泊肽主导,而玛仕度肽凭借其独特的双靶点机制和卓越的疗效,有望打破现有竞争格局:在疗效上,玛仕度肽6mg剂量组48周减重14.8%,优于司美格鲁肽(2.4mg剂量组44周减重9.9%),直逼替尔泊肽(15mg剂量组52周减重22.5%);在安全性方面:玛仕度肽严重不良事件发生率与安慰剂组相当,因副作用停药率(6mg组0.5%)显著低于司美格鲁肽(约4%)和替尔泊肽(约3%)。
二、Amycretin:GLP-1/胰淀素双靶点新星崛起
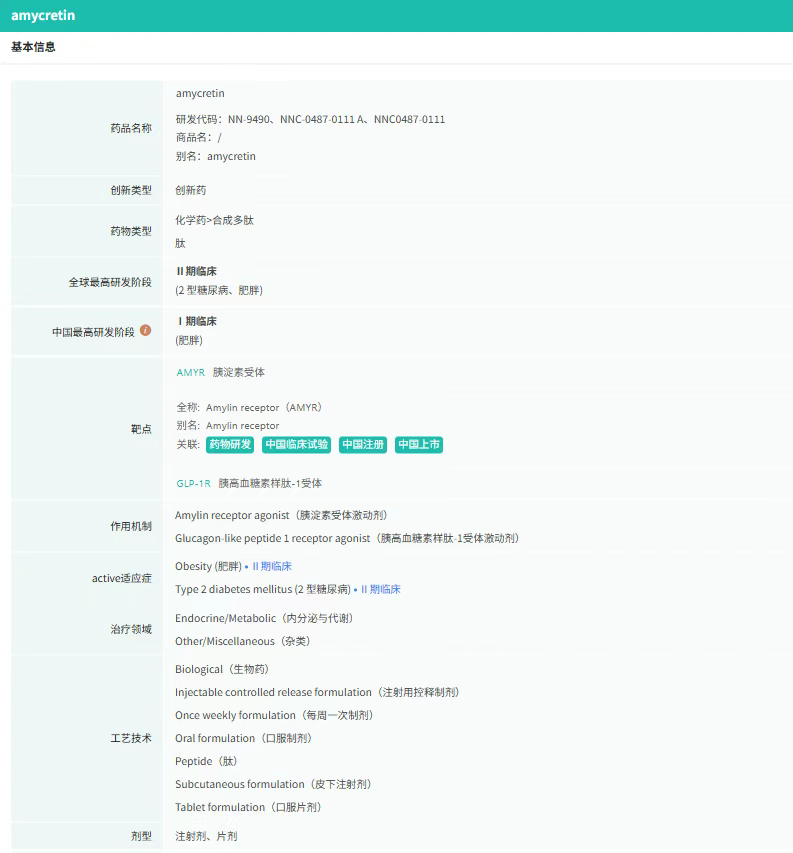
截图来源:摩熵医药全球药物研发数据库
Amycretin是诺和诺德研发的一种单分子长效GLP-1和胰淀素受体激动剂,其作用机制通过同时激活两种受体实现减重:
- GLP-1受体激活:延缓胃排空、促进胰岛素分泌,降低血糖;
- 胰淀素受体激活:直接作用于中枢神经系统,抑制食欲,减少能量摄入。
这种双重作用机制在临床试验中展现出显著的减重效果。Ⅰb/Ⅱa期研究显示,治疗36周后:高剂量组(60mg)平均减重24.3%,校正安慰剂效应后减重23.2%;低剂量组(20mg)平均减重23.9%,效果略优于高剂量组;安慰剂组仅减重1.1%。
Amycretin的减重效果显著优于现有GLP-1类药物。口服制剂的Ⅰ期研究显示,治疗12周后高剂量组(100mg)平均减重13.1%,校正安慰剂效应后减重11.9%,安慰剂组仅减重1.2%。
安全性方面,Amycretin的不良反应以轻中度胃肠道症状为主(如恶心、呕吐、腹泻),多数出现于用药初期,且随时间推移逐渐减轻。研究期间未报告严重不良事件,停药率低于5%。
根据中国诊断标准,中国约有5亿成人超重或肥胖,且肥胖相关并发症(如糖尿病、脂肪肝、心血管疾病)的患病率持续上升。玛仕度肽和Amycretin的出现,将为患者提供更安全、更有效的治疗选择。
尽管全球已有多款三靶点减重药物进入临床开发(包括礼来、诺和诺德等MNC布局),但玛仕度肽和Amycretin凭借其First-in-Class地位和已验证的临床疗效,仍将在未来3-5年内保持领先优势。信达生物已启动玛仕度肽高剂量版本(15mg)与替尔泊肽的头对头研究,进一步巩固其市场竞争力。
小结
2025年6月,玛仕度肽与Amycretin的同期亮相,标志着全球减重药物市场正式迈入“双靶点时代”。无论是信达生物的“中国智造”,还是诺和诺德的“后发制人”,这场双雄争霸的背后,是数亿肥胖患者对更健康生活的渴望。未来,随着更多创新药物的上市和适应症的拓展,减重治疗将不再局限于“减重”本身,而是向代谢综合征的全病程管理迈进。
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论