
世界上最残酷的战争,往往发生在身体内部。
当原本负责抵御外敌的免疫大军突然“倒戈”,将自身的关节、皮肤甚至脏器视为仇敌进行疯狂围剿,患者面临的是一场无法逃离的浩劫:晨起的僵硬锁住四肢,无休止的炎症侵蚀骨骼,生活质量在日复一日的剧痛中崩塌。在很长一段时间里,面对这种“由于过度防御而导致的自我毁灭”,医学界几乎束手无策。
正是这种巨大的临床痛点,催生了人类医药史上最波澜壮阔的征程。科学家们如何从死神的镰刀下抢回控制权?一款药物又是如何凭借对这种“免疫背叛”的精准阻断,登顶全球“药王”宝座,创下2200亿美元的销售神话?
这不仅是一个关于疾病的故事,更是一部关于人类如何破解自身免疫密码、在商业博弈中重塑生命尊严的史诗。让我们从免疫系统的双重面孔开始,揭开这场跨越世纪的医疗革命。
👀 免疫系统的双重面孔与自身免疫性疾病的溯源
1. 免疫稳态的生物学基础
在探讨现代生物医药的辉煌成就之前,我们必须首先回归到人体最精密、最复杂的防御网络——免疫系统。免疫一词,在现代医学语境中,早已超越了简单的“防御”概念,它代表了一种识别“自我”与“非我”的深刻生物学智慧。当病毒、细菌等外源性病原体入侵,或体内细胞发生癌变等异常时,免疫系统会启动一系列精密调控的级联反应。这一过程涉及固有免疫与适应性免疫两大系统的协同作战:免疫细胞(如T淋巴细胞、B淋巴细胞、巨噬细胞、树突状细胞等)作为冲锋陷阵的士兵,而免疫分子(如抗体、补体、细胞因子)则作为传递指令和执行攻击的武器,共同构建起捍卫机体健康的防线。
然而,这种强大的攻击能力必须受到严格的调控,以维持一种被称为“免疫稳态”的动态平衡。在健康状态下,免疫系统能够精准地清除威胁,同时对自身组织保持耐受。一旦这种稳态被打破,免疫细胞将无法区分敌我,将矛头错误地指向自身组织,导致持续的炎症反应和组织损伤,这便是自身免疫性疾病的病理基础。
2. 自身免疫性疾病的病理谱系与分类
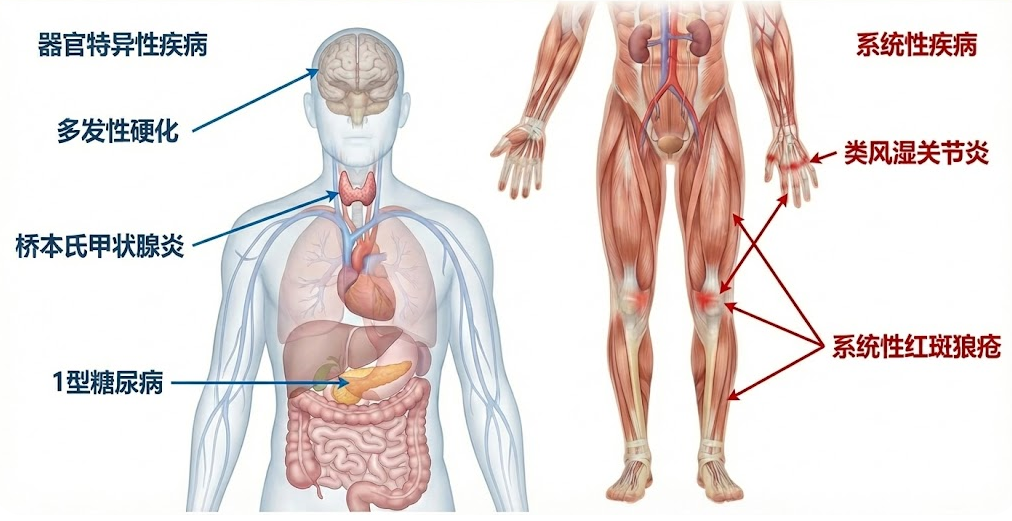
目前已知的自身免疫性疾病种类繁多,超过80种,其临床表现千差万别,但病理本质均为免疫耐受的崩溃。根据攻击目标的范围,这些疾病主要分为两大类:
第一类是器官特异性自身免疫病。在此类疾病中,免疫系统的攻击目标局限于特定的器官或细胞类型。例如,在1型糖尿病(T1DM)中,效应T细胞特异性破坏胰腺中的β细胞,导致胰岛素分泌枯竭;在特发性膜性肾病中,攻击目标则是肾小球足细胞,引发蛋白尿和肾功能损害。此外,皮肤科常见的白癜风、内分泌系统的Graves病(毒性弥漫性甲状腺肿)以及神经系统的重症肌无力等,均属于此类。
第二类是系统性自身免疫病。这类疾病反映了免疫网络的系统性崩溃,自身抗体和免疫复合物攻击全身多个组织和器官。最为典型的如类风湿关节炎(Rheumatoid Arthritis, RA),其病理特征不仅是关节滑膜的慢性炎症和骨质破坏,还可累及心血管和肺部系统;系统性红斑狼疮(SLE)则被称为“自身免疫病的各种模型”,可导致肾脏、皮肤、神经系统等多脏器受损。此外,强直性脊柱炎(AS)、干燥综合征(SS)、系统性硬化症等也属于此类严重影响患者生活质量的疾病。
自身免疫性疾病的分类与受累器官分布
3. 发病机制深探:遗传易感性与环境触发的共谋
自身免疫性疾病的发生并非单一因素所致,而是遗传易感性与环境触发因素在时间维度上复杂交互的结果。
- 遗传因素的多维解析
遗传学研究表明,虽然单基因突变(如AIRE基因突变导致的APECED综合征)可导致自身免疫病,但绝大多数病例属于多基因遗传病。人类白细胞抗原(HLA)等位基因的多态性与多种自身免疫病高度相关。例如,HLA-DRB1特定等位基因与类风湿关节炎的风险密切相关,而HLA-B27则是强直性脊柱炎的强遗传标志物。除了基因序列本身的差异,表观遗传学机制也在其中扮演关键角色。研究发现,环境因素可能通过改变DNA甲基化或组蛋白修饰来调控基因表达。例如,1型糖尿病患者的胰岛素相关基因启动子区域呈现异常的高甲基化状态,导致基因表达失调,从而破坏了免疫耐受。
- 环境触发与分子模拟假说
环境因素往往是点燃自身免疫反应的“导火索”。
- 外源化合物与生活方式:吸烟、重金属暴露、药物使用等均可诱发免疫异常。特别是香烟烟雾,含有大量脂多糖和自由基,能够诱导肺部蛋白发生瓜氨酸修饰。在遗传易感个体中,这种修饰蛋白被识别为新抗原,刺激机体产生抗瓜氨酸蛋白抗体(ACPA),这是类风湿关节炎发病的核心机制之一。
- 分子模拟:这是解释感染诱发自身免疫病的最经典假说。该理论认为,当外源病原体(如病毒、细菌)的抗原表位与宿主自身蛋白的结构(线性序列或空间构象)高度相似时,免疫系统在攻击病原体的同时,产生的交叉反应性抗体或T细胞会“误伤”自身组织。
👀 肿瘤坏死因子(TNF)的发现史:从抗癌毒素到炎症核心的科学跨越
TNF的发现史是医学史上“歪打正着”的经典案例,它始于对癌症治疗的执着探索,却最终在自身免疫性疾病的治疗中引发了一场革命。
1. 威廉·科利与“科利毒素”的传奇
这一科学征程的起点可以追溯至19世纪末。1890年,年仅28岁的哈佛医学院毕业生、纽约医院外科医生威廉·科利(William Bradley Coley)经历了一次职业生涯的顿悟。他目睹了一名17岁女性骨肉瘤患者虽然接受了截肢手术,但仍因癌症转移而在极度痛苦中离世。深受触动的科利开始翻阅医院的陈旧病历,试图寻找治愈癌症的蛛丝马迹。
他在档案中发现了一个奇异的病例:七年前,一位颈部患有无法手术切除的恶性肉瘤的患者,在术后意外感染了丹毒(一种由链球菌引起的严重皮肤感染)。患者经历了高烧不退的生死考验,但随着感染的痊愈,他颈部的肿瘤竟然奇迹般地消失了,并且在随后的七年里未见复发。这一发现促使科利提出了一个在当时极具前瞻性的假设:感染过程中产生的某种反应(发热或免疫激活)可能具有抗肿瘤作用。
科利开始了大胆的临床尝试。起初,他直接向肿瘤患者注射活体链球菌,试图人为诱导丹毒感染。虽然部分患者的肿瘤确实缩小了,但活菌注射带来的感染风险极高,甚至导致了患者死亡。为了提高安全性,科利改进了配方,使用灭活的化脓性链球菌和粘质沙雷氏菌混合制备成疫苗。这种制剂后来被称为“科利毒素”。
在随后的几十年里,科利及其继任者使用这种毒素治疗了上千名晚期癌症患者,取得了令人瞩目的疗效,部分患者生存期甚至超过了20年。然而,当时的科学界对免疫系统的认知尚处于蒙昧阶段,科利无法解释其作用机制;加之放疗和化疗技术的兴起,这种疗法因其效果的不可预测性和严重的副作用(高热、寒战)而逐渐被主流医学边缘化。尽管如此,科利留下的科学火种——即“通过激活机体自身防御机制来对抗癌症”——为后来的肿瘤免疫治疗奠定了思想基础,他也被后世尊称为“肿瘤免疫治疗之父”。
2. 洛伊德·奥尔德与TNF的实体化
时光流转至20世纪中叶,科利毒素背后的科学谜题终于迎来了破解者。1958年,洛伊德·奥尔德(Lloyd John Old)加入了纽约斯隆-凯特林研究所,重启了对科利毒素机制的探索。
奥尔德团队发现,注射了卡介苗(BCG)或细菌内毒素(LPS)的小鼠,其血清具有一种特殊的能力,能够导致移植的肉瘤发生出血性坏死。关键的血清转移实验表明,这种抗肿瘤活性并非来自内毒素本身,而是内毒素刺激宿主免疫系统产生的一种内源性蛋白质。1975年,奥尔德团队成功分离出这种物质,并根据其在小鼠体内导致肿瘤坏死的现象,将其命名为“肿瘤坏死因子”(Tumor Necrosis Factor, TNF)。
3. 临床挫折与赛道转换:从肿瘤到自身免疫
TNF的发现曾在肿瘤学界引起巨大轰动,被视为攻克癌症的“魔法子弹”。随着基因工程技术的发展,80年代初,科学家利用重组DNA技术制备了大量高纯度的TNF,并迅速投入临床试验。
然而,现实给了科学界沉重一击。在人体临床试验中,TNF不仅未能展现出在小鼠模型中那样的神奇抗癌疗效,反而引发了灾难性的副作用。患者在接受TNF注射后,出现了类似严重感染的剧烈炎症反应,包括高烧、低血压休克甚至多器官衰竭。这表明,TNF在人体内扮演的角色远比“杀死肿瘤”要复杂得多,它更像是一个强效的炎症介质。
正当TNF在肿瘤治疗领域折戟沉沙之时,费尔德曼(Sir Marc Feldmann)和迈尼(Sir Ravinder Nath Maini)——却凭借敏锐的直觉,从另一个角度审视了这一分子。他们在类风湿关节炎(RA)患者的滑膜液中检测到了高浓度的细胞因子混合物。通过精巧的体外细胞培养实验,他们发现了一个惊人的现象:虽然滑膜液中存在多种促炎因子(如IL-1, IL-6, GM-CSF),但只要加入TNF的中和抗体阻断TNF的活性,其他炎症因子的水平也会随之大幅下降;反之,阻断其他因子对TNF的水平影响甚微。
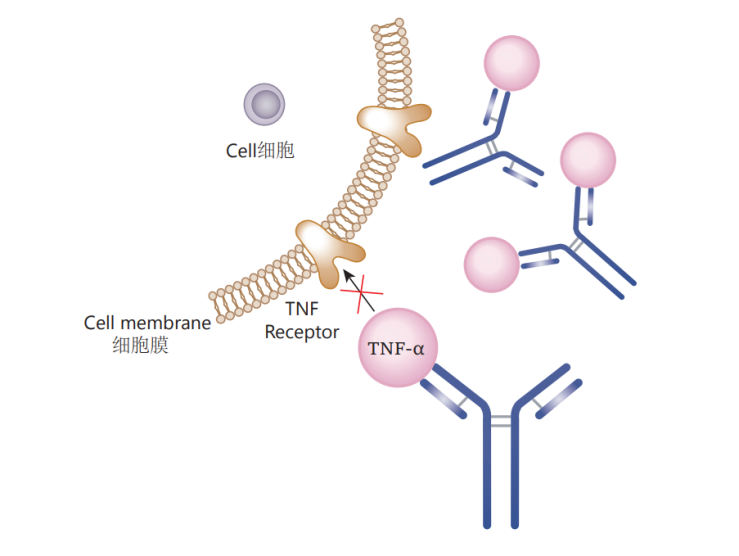
这一发现确立了TNF在炎症级联反应中的“主帅”地位。如果说炎症是一场大火,IL-1、IL-6等因子是燃烧的火焰,那么TNF就是最初的火种。费尔德曼和迈尼推测:阻断TNF,或许就能从源头上控制类风湿关节炎的病情。随后的临床试验取得了惊人的成功,许多瘫痪在床、传统治疗无效的患者在接受抗TNF治疗后重新站立。这一突破性发现彻底改变了自身免疫性疾病的治疗范式,也为后续重磅药物的研发奠定了坚实的理论基础。
TNF抑制剂
👀 抗体技术的进化革命:从鼠源杂交瘤到全人源噬菌体展示
要实现对TNF的有效阻断,必须依赖高特异性的抗体药物。抗体技术的发展史,本质上是一部人类不断克服免疫排斥、追求“全人源化”的技术斗争史。
1. 单克隆抗体的诞生与“人抗鼠”困境
1975年,米尔斯坦(César Milstein)和科勒(Georges Köhler)发明了杂交瘤技术,他们将产生抗体的B淋巴细胞与无限增殖的骨髓瘤细胞融合,创造出了既能产生特定抗体又能无限扩增的杂交瘤细胞。这一技术使得在体外大量制备性质均一的单克隆抗体成为可能,两人因此获得了1984年诺贝尔生理学或医学奖。
然而,早期的单抗大多来源于小鼠(鼠源抗体,通用名后缀为-omab)。当这些鼠源蛋白进入人体后,会被人体免疫系统识别为异物,产生强烈的免疫排斥反应,即“人抗鼠抗体”(HAMA)反应。HAMA不仅会中和药物活性,导致药物被迅速清除、半衰期极短,还可能引发严重的血清病甚至过敏性休克。第一款上市的鼠源单抗Muromonab-CD3商业化表现惨淡,正是受制于此。
2. 基因工程改造:嵌合与人源化的过渡
为了降低免疫原性,科学家开始利用基因工程技术对抗体结构进行改造,试图“骗过”人体免疫系统:
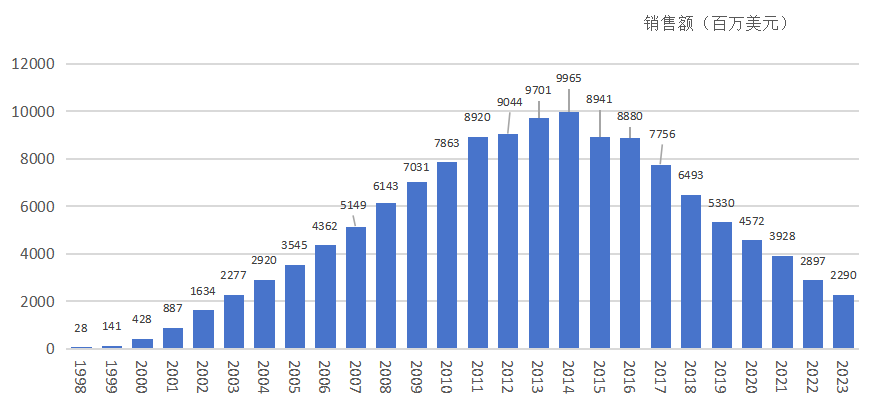
① 人-鼠嵌合抗体(Chimeric Antibody,后缀-ximab):保留鼠源抗体中识别抗原的可变区(V区),将约65%的恒定区(C区)替换为人源序列。例如,第一代TNF抑制剂 英夫利昔单抗(Infliximab, 商品名:类克)就是典型的嵌合抗体。虽然其半衰期有所延长,但在部分患者中仍会产生抗药抗体(ADA)。
类克历年销售额
② 人源化抗体(Humanized Antibody,后缀-zumab):进一步将鼠源成分压缩。仅保留与抗原直接接触的互补决定区(CDR),其余骨架区全部替换为人源序列。人源成分可达90%-95%。罗氏的抗癌药赫赛汀(Herceptin)便是此技术的杰作。
尽管已有显著进步,但嵌合抗体和人源化抗体仍含有少量鼠源序列,仍存在免疫原性风险。开发100%人源序列的“全人源抗体”成为了生物制药界的终极圣杯。
3. 噬菌体展示技术:全人源时代的开启钥匙
如何不经过小鼠免疫,直接在体外筛选出全人源抗体?噬菌体展示技术(Phage Display Technology)给出了完美的答案。
- 技术原理:基因型与表型的物理连接
噬菌体是一种专门感染细菌的病毒。1985年,乔治·史密斯(George Smith)发现,如果将外源基因插入噬菌体外壳蛋白(如丝状噬菌体M13的pIII蛋白)的基因序列中,该外源基因编码的多肽或蛋白就能“展示”在噬菌体颗粒的表面,同时其编码基因仍包裹在噬菌体内部。这种“表面展示蛋白(表型)”与“内部编码基因(基因型)”的物理连接,是该技术的核心逻辑。
- 筛选过程:生物淘洗
格雷戈里·温特(Gregory Winter)将这一技术应用于抗体工程。他将人类抗体的基因库导入噬菌体,构建了包含数十亿种不同抗体片段的“噬菌体抗体库”。筛选特定抗体的过程被称为“生物淘洗”,其流程如下:
① 结合:将庞大的噬菌体抗体库与固定在固相载体上的靶抗原(如TNF分子)孵育。只有表面展示了能识别TNF的抗体的噬菌体才会结合上去。
② 洗涤:通过严格的洗涤步骤,洗去那些未结合或结合力弱的噬菌体。
③ 洗脱:使用酸性缓冲液或其他手段,将特异性结合的噬菌体从抗原上解离下来。
④ 扩增:将洗脱下来的微量噬菌体感染大肠杆菌进行扩增,使其数量呈指数级增长。
⑤ 循环:重复上述步骤3-5轮。每一轮都相当于一次进化的选择压力,最终富集出亲和力最强、特异性最高的抗体克隆。
这项技术让科学家摆脱了免疫动物的限制,完全在试管中“进化”出高亲和力的全人源抗体。后来,George Smith和Gregory Winter因在噬菌体展示技术方面的卓越贡献,于2018年荣获诺贝尔奖。
👀 修美乐(阿达木单抗)的诞生记:从实验室到药王的蜕变
修美乐的问世,不仅是噬菌体展示技术最辉煌的商业验证,也是一段跨越学术界与工业界、并在资本博弈中重塑格局的传奇故事。
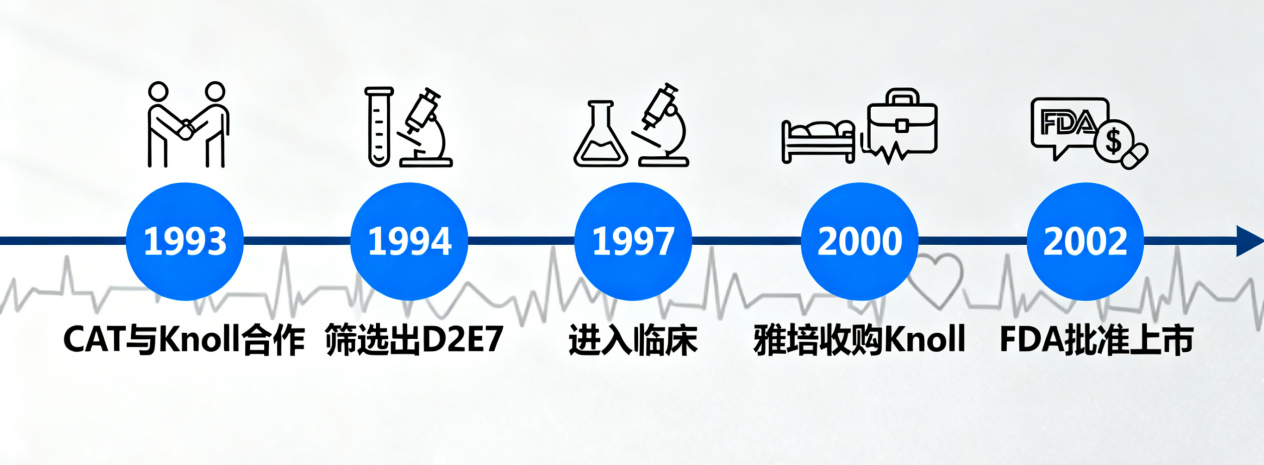
1. 剑桥抗体技术公司(CAT)与BASF的联手
1989年,Winter联合David Chiswell和John McCafferty等人成立了剑桥抗体技术公司(Cambridge Antibody Technology,简称CAT公司),专注于开发具有临床价值的全人源化治疗性抗体。作为一家初创生物技术公司,CAT拥有顶尖的技术平台,但缺乏资金和药物开发经验。
与此同时,德国化工巨头BASF的子公司Knoll制药正在寻找进入生物药领域的切入点。尽管当时已有Centocor(强生前身)的 英夫利昔单抗 在研,但诺尔制药敏锐地预见到,全人源抗体将是未来的主流。1993年,双方一拍即合,签署了合作协议。
CAT利用其噬菌体展示库筛选针对TNF的抗体。经过多轮淘洗,他们首先得到了代号为2SD4的先导抗体,其亲和力约为15nM。虽然这个亲和力已经不错,但作为药物还不够理想。为了获得更好的药效,研究人员利用链替换和随机突变技术,对2SD4进行了体外亲和力成熟,最终筛选出了亲和力高达300pM(0.3nM)的完美分子——D2E7。这就是后来震惊世界的 阿达木单抗。
2. 临床开发的卓越表现与关键试验
Knoll制药接手D2E7后,展开了详尽的临床前与临床研究,这些数据奠定了其成为药王的基础。
- 临床前数据:在转基因小鼠关节炎模型中,D2E7完全阻止了关节炎的发生,治疗组小鼠的关节组织未见任何病理改变,这与对照组严重的软骨破坏和骨质侵蚀形成了鲜明对比。
- I期临床(安全性与药代动力学):在120例RA患者的试验中,D2E7展现了惊人的起效速度。部分患者在注射24小时后,关节疼痛即明显缓解。相比安慰剂组,D2E7组的疾病活动评分(DAS)显著下降。更重要的是,作为全人源抗体,其免疫原性极极低,半衰期长达10-20天,支持两周一次皮下注射,这极大地提高了患者的依从性。
- 关键临床研究(ARMADA、STAR、DE011和DE019):
ARMADA试验:这是一项针对甲氨蝶呤(MTX)反应不足患者的随机双盲试验。结果显示,在MTX基础上加用阿达木单抗,24周时患者的ACR20(美国风湿病学会20%改善标准)应答率显著高于安慰剂组,且起效迅速。
DE019试验:这项为期52周的研究不仅关注症状缓解,还首次通过X射线评估了关节结构的破坏情况。结果证明,阿达木单抗能显著抑制关节结构的影像学进展,即它不仅能止痛,还能真正阻断疾病进程,防止致残。
3. 资本博弈与雅培的入局
就在D2E7临床试验高歌猛进之时,其母公司BASF却面临战略调整。作为传统化工巨头,BASF发现制药业务的高风险与长周期与其核心化工业务的商业模式格格不入,且面临巨大的法律诉讼压力,遂决定剥离诺尔制药。
这一决定引发了制药界的争夺。最终,急需扩充产品线、并在单抗领域寻找立足点的雅培制药有限公司于2000年以69亿美元的天价收购了诺尔制药。
2002年12月31日,FDA正式批准阿达木单抗上市,商品名 Humira(取自HUman Monoclonal Antibody In Rheumatoid Arthritis,意为治疗类风湿关节炎的人单克隆抗体),中文名修美乐。
👀 二代“药王”的进击:商业神话的铸就与专利丛林策略
修美乐上市后,迅速展现出统治级的市场表现。2012年,它超越辉瑞的 立普妥(Lipitor),登顶全球药物销售榜首,并连续十年蝉联“药王”宝座。截至2022年,其累计销售额突破2200亿美元,成为人类历史上最赚钱的药物。其成功秘诀在于适应症的疯狂拓展和精密的专利布局。
修美乐历年销售额
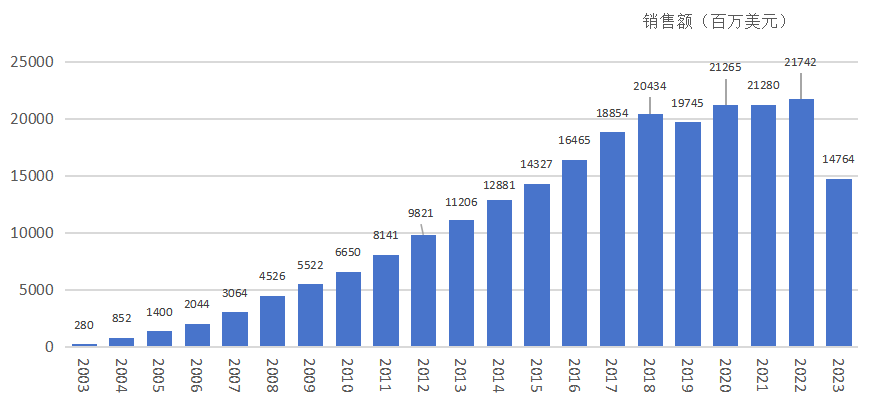
1. 适应症拓展:从单一突破到全能覆盖
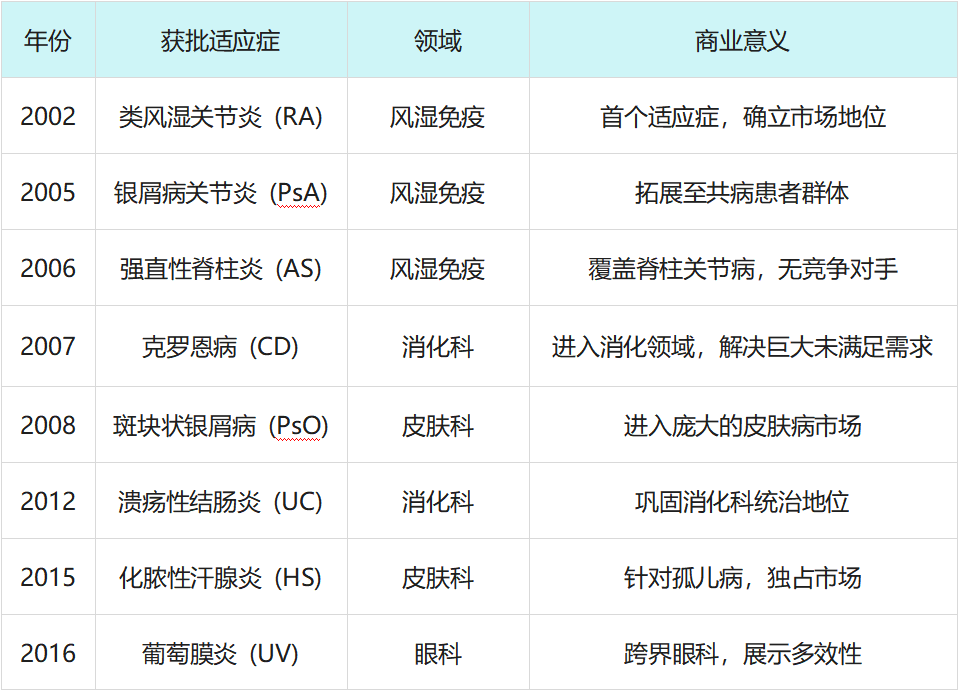
这种“滚雪球”式的适应症拓展,使得修美乐的患者群体呈几何级数增长。每一个新适应症的获批,都伴随着数十亿美元销售额的增长。
图源:摩熵医药-全球药物研发(修美乐适应症)
2. 专利丛林:坚不可摧的法律护城河
除了持续拓展适应症,雅培制药有限公司(2013年分拆出艾伯维制药公司)通过布局大量专利,显著延长了阿达木单抗的产品生命周期。实际上,阿达木单抗的结构专利早在2016年便已到期,但艾伯维制药公司凭借在制剂、制备方法、适应证等多方面(尤其是适应证和制备方法领域)的专利布局,构建了“专利丛林”,成功延续了对阿达木单抗产品的保护。
- 什么是专利丛林?
专利丛林是指原研药企围绕同一款药物,申请大量外围专利,形成密集的专利网络。艾伯维为修美乐申请了超过250项专利(美国授权约130项),形成了一个令竞争对手窒息的防御网:
制剂专利:开发新的缓冲液配方、无柠檬酸盐配方(减少注射疼痛)、高浓度配方(减少注射体积)。这些改进虽小,但均申请了专利保护。
生产工艺专利:对细胞培养的温度、pH值、补料策略,以及纯化过程中的层析步骤申请专利。这使得仿制药企即使知道药物结构,也难以绕过艾伯维的生产方法。
给药方案专利:针对不同适应症的特定剂量和给药间隔申请专利。
适应症专利:针对新开发的适应症的治疗方法。
- “专利舞蹈”与诉讼和解策略
美国《生物制剂价格竞争与创新法案》(BPCIA)规定了一套复杂的“专利舞蹈”程序,要求生物类似药申请人与原研厂进行信息交换和专利清单谈判。
艾伯维利用其庞大的专利库,对所有试图进入市场的竞争对手(如安进、三星Bioepis、勃林格殷格翰)发起猛烈的专利诉讼。例如,针对安进,艾伯维主张了多达61项专利侵权。
面对旷日持久且昂贵的诉讼(可能长达数年,耗资数百万美元),绝大多数竞争对手选择了和解:同意推迟在美国市场的上市时间(通常推迟至2023年),以换取在欧洲市场的提前准入或艾伯维的专利授权。这种策略成功地将修美乐的美国市场独占期延长了整整7年(从2016年延至2023年),为艾伯维带来了数百亿美元的额外收入。
👀 2023-2025:大坝决堤与市场格局的剧烈重构
尽管专利丛林延缓了竞争,但2023年成为了修美乐命运的转折点。随着与各家药企的和解协议到期,美国市场迎来了生物类似药的集中爆发,一场史无前例的市场围剿战正式打响。
1. 2023年:生物类似药的集中涌入
2023年1月,安进的 Amjevita 作为首款修美乐生物类似药在美国上市,打破了长达20年的独占局面。随后,山德士(Sandoz)的 Hyrimoz、勃林格殷格翰的 Cyltezo(首个获批可互换的类似药)、三星Bioepis的 Hadlima 等近10款产品相继涌入市场。
然而,在2023年,修美乐的市场份额并未立即崩塌。这主要归因于美国独特的支付体系。艾伯维通过与保险公司和药品福利管理者(PBM)签订高额回扣协议,保住了修美乐在处方名录中的优先地位。即便有廉价的类似药,医生和患者在短期内仍倾向于使用原研药。
2. 2024-2025年:PBM的决定性一击与价格战
真正的转折点发生在2024年。掌握美国药品定价和处方权的核心力量——药品福利管理者(PBM)开始大规模调整策略,利用类似药的低价优势来倒逼原研药降价,甚至直接剔除原研药。
CVS Caremark的重磅举措:2024年4月,美国最大的PBM之一CVS Caremark决定将 修美乐 从其主要商业处方名录中剔除,转而推荐山德士的生物类似药 Hyrimoz(通过Cordavis联合品牌)。这一决定导致修美乐在CVS系统内的处方量瞬间归零,转化为生物类似药的份额。
价格战与双重定价策略:为了争夺市场,生物类似药厂商采取了激进的定价策略。有的推出了比修美乐标价低85%的低标价版本(如Mark Cuban的Cost Plus Drugs销售的Yusimry),直接吸引现金支付或高自付额患者;有的则维持高标价但提供高回扣,以迎合PBM的盈利模式。
2025年展望:随着更多PBM(如Express Scripts, Optum)跟进剔除修美乐或实施更严格的优先处方政策,分析师预测修美乐的市场份额将进一步萎缩至20%以下,销售额将继续断崖式下跌。Navitus等PBM已宣布在2025年将修美乐移出处方集。
3. 财务数据的直观反映:艾伯维的阵痛与转型
艾伯维的财报清晰地记录了这一冲击。
- 2023年:随着类似药上市,修美乐全球销售额开始下滑,降至144亿美元。
- 2024年:根据艾伯维财报,修美乐全球收入同比下降超过30%,美国市场降幅更为剧烈,达40%以上。
- 2025年:根据艾伯维最新财报(2025第三季度),下降超过50%。
艾伯维财报(2025Q3)

- 市场份额预测:据Coherent Market Insights预测,到2025年,生物类似药在北美市场的份额将达到45.2%,欧洲市场将超过30%。修美乐的统治时代宣告终结。
👀 后修美乐时代:下一代免疫疗法的研发前沿
虽然修美乐的王者地位不再,但TNF作为治疗靶点的价值依然存在,且新的技术正在重塑这一领域。同时,针对TNF以外新靶点的药物正在崛起,试图接棒成为新的重磅炸弹。
1. 新一代TNF抑制剂的差异化竞争
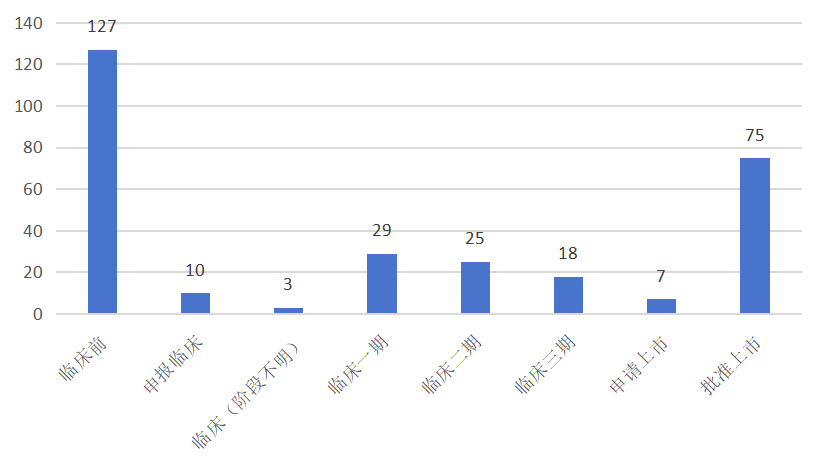
依据摩熵数科医药科技有限公司的摩熵医药数据库-全球药物研发数据库数据,截至2025年1月20日,全球范围内处于研发进程中的TNF抑制剂(涵盖创新药、改良型新药以及生物类似药)总计达294款。在这当中,已经获得批准并成功上市的有75款;另有7款已提交上市申请,正处于审批流程中;处于三期临床研究阶段的有18款;处于一期临床和二期临床阶段的数量合计为54款;尚处于临床前研究阶段的则有127款。
全球在研的TNF抑制剂开发阶段分布
自修美乐上市以来,截至2025年1月22日,全球范围内总计有3款TNF抑制剂创新药获批上市,其具体信息如下表所示:
修美乐上市后全球范围内获批上市的TNF抑制剂创新药
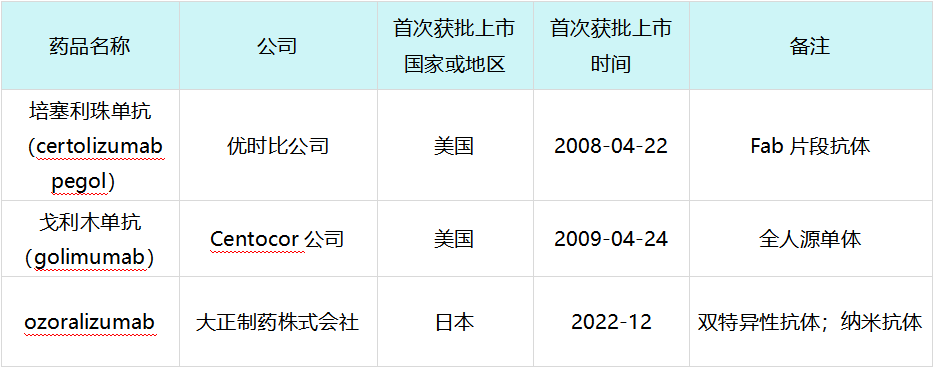
培塞利珠单抗(Certolizumab pegol):这是一种结构独特的抗体片段,去除了Fc片段并进行聚乙二醇化修饰。无Fc片段意味着它不会与新生儿Fc受体结合,因此不会通过胎盘屏障。这使其成为妊娠期和哺乳期女性的首选TNF抑制剂,完美解决了育龄期女性患者的用药痛点,获得了多国指南推荐。
戈利木单抗(Golimumab):作为新一代全人源抗体,其亲和力更高,且每月仅需注射一次,相比修美乐的两周一次更加便捷,显著提高了患者的生活质量。
Ozoralizumab:大正制药株式会社研发的双特异性纳米抗体。它含有两个抗TNF结构域和一个抗人血清白蛋白结构域。纳米抗体分子量小,组织穿透力强,且双特异性设计显著延长了半衰期。在治疗对甲氨蝶呤反应不足的RA患者中,展现了优异疗效。
2. 艾伯维的自我革命:Skyrizi与Rinvoq的接棒
面对修美乐的专利悬崖,艾伯维并未坐以待毙,而是提前布局了接班产品,构建了被称为“免疫学双子星”的组合:
Skyrizi(利生奇珠单抗):靶向IL-23的单克隆抗体。在银屑病治疗上,头对头试验显示其皮肤清除率显著优于TNF抑制剂,且给药频率更低(每12周一次)。
Rinvoq (乌帕替尼):口服JAK抑制剂。作为小分子药物,它在类风湿关节炎、特应性皮炎、溃疡性结肠炎等多个适应症中展现了极强的疗效,甚至在某些指标上优于修美乐。
根据2024年财报,这两款药物的合计销售额已迅速攀升至176亿美元,有望完全弥补修美乐留下的收入缺口,延续艾伯维在免疫学领域的霸主地位。
这项技术让科学家摆脱了免疫动物的限制,完全在试管中“进化”出高亲和力的全人源抗体。后来,George Smith和Gregory Winter因在噬菌体展示技术方面的卓越贡献,于2018年荣获诺贝尔奖。
3. 研发管线中的新星:口服与双抗
全球范围内,针对炎症通路的创新仍在继续。
口服TNF抑制剂:如TNF Pharmaceuticals正在开发的MYMD-1。作为一种口服小分子TNF抑制剂,它能够穿过血脑屏障,且有望避免注射剂型的免疫原性副作用。目前正处于临床试验阶段,针对肌肉减少症和类风湿关节炎,具有巨大的市场潜力。
双特异性抗体:赛诺菲等公司正在研发同时靶向TNF和其他炎症因子(如IL-17, IL-6, OX40)的双特异性抗体。这些药物旨在克服单一靶点耐药的问题,为难治性自身免疫病患者提供新的希望。
👀 结语与启示
回顾修美乐二十余年的传奇历程,我们不仅看到了一款药物的兴衰,更看到了现代生物医药产业发展的核心逻辑与未来趋势。
第一,基础研究是创新的源头活水。 无论是科利对细菌毒素的执着,还是奥尔德发现TNF,抑或是温特爵士发明噬菌体展示技术,每一个里程碑都是科学家在实验室中数十年如一日的探索成果。没有这些看似枯燥的基础研究,就没有后来的千亿级产业。这启示我们,对基础科学的长期投入是生物医药创新的基石。
第二,产学研转化的关键作用。 剑桥抗体技术公司(CAT)与BASF/Knoll的合作,是高校技术与工业界资源结合的典范。高校负责从0到1的技术突破(噬菌体展示),企业负责从1到100的工艺放大和临床开发,两者缺一不可。
第三,知识产权战略即是商业战略。 修美乐之所以能成为“药王”,除了过硬的临床疗效外,艾伯维构建的专利丛林和精妙的法律诉讼策略功不可没。这提醒中国药企,在出海过程中,必须建立完善的专利布局意识,既要学会用专利保护自己,也要学会在国际专利丛林中寻找生存空间。
第四,生物类似药是不可逆转的历史潮流。 2024年修美乐市场份额的崩塌再次证明,任何重磅药物终将面临专利悬崖。对于患者和医疗系统而言,这不仅意味着治疗成本的大幅降低(节省数百亿美元),更意味着优质医疗资源的可及性提升。
修美乐的时代或许正在落幕,但全人源单抗技术与免疫治疗的黄金时代,才刚刚开始。随着双特异性抗体、口服小分子、甚至mRNA疗法的兴起,人类对抗自身免疫性疾病的武器库将变得更加丰富和强大。
扩展阅读:
1. 《自然》子刊综述:“癌症之王”难对付 免疫疗法从哪里获突破
想要解锁更多药品信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论