
如果说基因是生命的源代码,那么蛋白质就是执行代码的底层硬件。理解这套硬件的架构逻辑,是人类干预生命过程、设计革命性药物的必经之路。
回望过去两个世纪,我们对蛋白质的认知经历了几次震撼的范式转移。1902年,费歇尔用“锁与钥匙”模型开启了分子互补性的认知大门,奠定了现代药物设计的基石;上世纪中叶,X射线晶体学赋予了我们“上帝视角”,让α-螺旋和β-折叠从理论预测变为原本可见的原子实体;随后,PDB数据库的建立更是将结构生物学推向了大数据时代。
然而,经典的“安芬森热力学假说”和静态的晶体结构,是否就是真理的全部?
当我们将目光投向更真实的细胞环境,会发现教科书上的模型正在被改写。今天的文章,我就想帮大家把这些陈年的知识点“翻翻新”。搞懂了这些底层逻辑的演变,你才会明白,为什么现在的药越来越难做,而未来的机会又藏在哪里。
👀 一级结构
蛋白质分子建模始于一级结构,从氨基(氮端)开始,以羧基结束。蛋白质的一级结构,即氨基酸序列的线性排列,并非简单的积木堆叠,而是蕴含着深刻化学逻辑的信息载体。每一个氨基酸残基的侧链性质、排列顺序以及后续的化学修饰,共同决定了蛋白质折叠的命运和功能的特异性。
1.1 肽键的平面性与骨架限制
一级结构的骨架由重复的氮端(N-端)、α-碳原子(Cα)和碳端(C-端)构成。氨基酸之间通过脱水缩合形成肽键(-CO-NH-)。鲍林在早期的研究中敏锐地指出,由于羰基氧与酰胺氮之间的电子共振效应,肽键具有部分双键性质,这导致连接它们的原子(C-N)不能自由旋转,从而使肽键单元处于一个刚性的平面内。
1.2 氨基酸侧链
20 种常见的蛋白源氨基酸中,除了甘氨酸(Gly)因侧链仅为氢原子而无手性外,其余氨基酸的Cα均为手性中心,且在天然蛋白质中绝大多数呈现L-构型(S-绝对构型,半胱氨酸除外)。
20 种形成肽或蛋白质的天然氨基酸分类
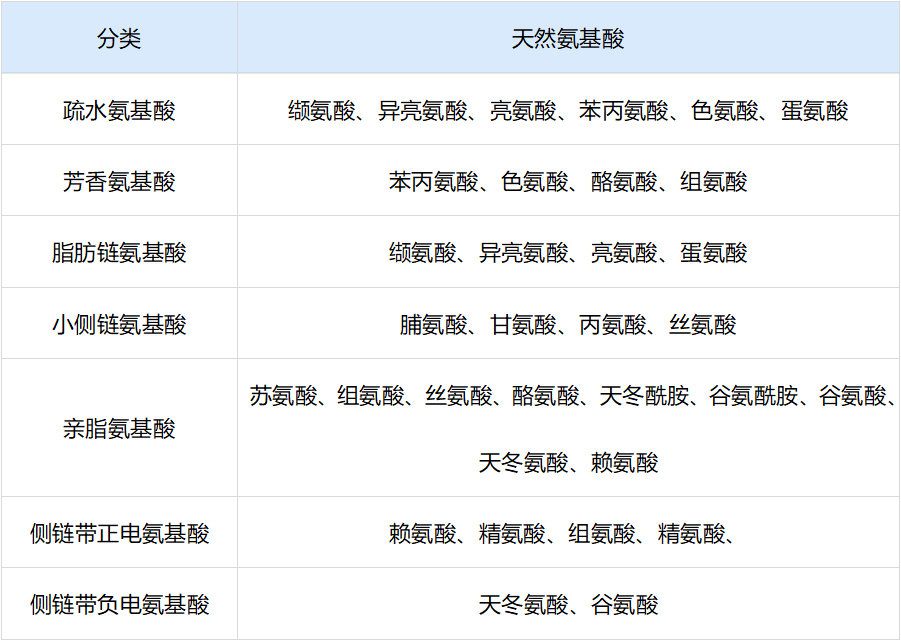
1.3 翻译后修饰(PTM)
一级结构并非一成不变。细胞通过翻译后修饰(PTM)对蛋白质进行化学“编辑”,从而极大地扩展了蛋白质组的功能多样性。这些修饰可以看作是分子开关,调控着蛋白质的活性、定位和寿命。
- 磷酸化:这是最普遍的信号转导机制。激酶将磷酸基团转移至Ser、Thr或Tyr的羟基上。引入的巨大负电荷和体积效应往往会诱导蛋白质发生显著的构象变化,从而激活或抑制酶活性。例如,Tyr的磷酸化可作为SH2结构域的停泊位点,启动下游信号级联。
- 糖基化:在Ser/Thr(O-连接)或Asn(N-连接)上连接糖链。这不仅增加了蛋白质的溶解度,更是细胞识别、免疫应答的关键标签。某些抗生素(如衣霉素)通过阻断糖基化来发挥作用。
- 脂质锚定:如C-端的GPI锚定或半胱氨酸的棕榈酰化,将水溶性蛋白质强行“拉”向疏水的细胞膜,使其成为膜结合蛋白,参与膜信号传导。
- 甲基化与乙酰化:主要发生在Lys和Arg上。在组蛋白中,Lys的乙酰化中和了其正电荷,减弱了其与带负电DNA的结合,从而疏松染色质结构,促进基因转录。这是一种典型的表观遗传调控机制。
- 泛素化:在Lys残基上连接泛素蛋白链,通常作为“死亡之吻”,标记该蛋白质被蛋白酶体识别并降解,是细胞内质量控制的重要环节。
值得注意的是,一些非酶促的化学修饰(如脱酰胺、氧化)往往与蛋白质的老化和病理状态(如白内障、神经退行性疾病)相关。例如,Asn的脱酰胺反应会生成异天冬氨酸,导致蛋白质结构损伤。
1.4 蛋白质序列比对
在生物信息学时代,对一级结构的分析已超越了化学测定,转向了计算比对。由于蛋白质在进化过程中会发生突变、插入或缺失,简单的字符串匹配无法揭示其同源性。
- 成对序列比对:通过动态规划算法(如Smith-Waterman)寻找两个序列的最佳匹配,识别保守位点。
- 多序列比对(MSA):同时比对多个序列,旨在发现共同的进化祖先和保守基序(Motif)。如果在不同物种中某个位置的氨基酸高度保守(如始终为His),则提示该残基对结构稳定或催化功能至关重要。MSA技术结合隐马尔可夫模型(HMM),已成为预测蛋白质二级结构和三级结构的重要辅助手段。
👀 二级结构
蛋白质二级结构是指多肽主链(不包括侧链)的局部空间构象。最常见的两种二级结构元件是α螺旋和β折叠,此外还有β转角和ω环。二级结构元件通常在蛋白质折叠成三维三级结构之前自发形成中间体。二级结构的概念最早由斯坦福大学的Kaj Ulrik Linderstrøm-Lang于1951年提出。
2.1 α-螺旋结构
α-螺旋是蛋白质中最常见的二级结构元件,一般位于蛋白质内核附近,螺旋的内埋面通常由疏水性氨基酸组成, 极性氨基酸朝向溶剂。
- 几何特征:这是一个右手螺旋结构,每圈螺旋包含3.6个氨基酸残基,螺距(Pitch)为5.4 Å。其稳定性的秘密在于主链内部形成了极其完美的氢键网络:第n个残基的羰基氧与第n+4个残基的氨基氢形成氢键。这种n→n+4的连接模式使得螺旋内部几乎所有的极性基团都得到了中和,从而在疏水环境中(如膜内或蛋白核心)极具稳定性。
- 侧链排布与两亲性:所有侧链基团均向外伸展,避免了螺旋内部的空间位阻。在许多球状蛋白中,α-螺旋表现出明显的两亲性:即螺旋的一个面富含疏水残基(面向蛋白内部),而相对的另一面富含亲水残基(面向溶剂)。这种性质使得螺旋能够像“浮标”一样漂浮在蛋白质表面或插入膜中。
- 结构限制:并非所有氨基酸都适合形成螺旋。Pro由于其环状侧链导致N原子无氢可供,且造成空间冲突,被称为“螺旋终结者”。Gly由于侧链过小,构象熵过大,也不利于螺旋的稳定。相反,Ala、Glu、Leu等氨基酸则具有很高的螺旋形成倾向。
2.2 β-链结构
β-链之间通过氢键形成紧密的网,即 β-折叠 (β-sheet)。
- 平行与反平行:当相邻链的N→C方向相同时为平行折叠,方向相反时为反平行折叠。反平行折叠中氢键排列更直、更短,通常比平行折叠更稳定。
- β-桶(β-barrel):这是一种特殊的超二级结构,由β-折叠卷曲闭合形成筒状。其内部通常排列疏水残基,外部为亲水残基,这种“内疏水、外亲水”的模式使其能稳定存在于水溶液中,或以反向模式(外疏水、内亲水)构成跨膜孔道(如孔蛋白)。
2.3 Loop环与无规卷曲
连接螺旋和折叠的区域称为Loop环或无规卷曲(Random Coil)。虽然名称中带有“无规”,但它们并非杂乱无章。这些区域富含极性残基(如Ser, Gly),通常位于蛋白质表面。由于缺乏刚性的氢键网络,Loop区具有高度的柔性,这使得它们常作为酶的活性中心盖子、抗体识别抗原的互补决定区(CDR),或是构象变化的铰链区。甘氨酸(Gly)因其微小的侧链,常赋予Loop区极大的构象自由度。
👀 三级结构
蛋白质三级结构由二级结构侧链间相互作用(如氢键、二硫键等)决定,其折叠受吉布斯自由能最小化(低焓、高熵)驱动。由于存在多种能量相近的构象,三级结构呈动态变化。
3.1 疏水效应
在水环境中,蛋白质折叠的最主要驱动力是疏水效应。根据热力学原理,水分子在疏水表面周围会形成有序的笼状结构,导致系统熵值降低(ΔS < 0),这是热力学上不利的。为了最大化水分子的熵,疏水性氨基酸残基倾向于聚集在蛋白质内部,减少与水的接触面积。这种“油水分离”般的塌缩使得蛋白质迅速形成一个致密的核心,释放出的水分子回到无序状态,增加了溶剂熵,从而降低了整个系统的吉布斯自由能(ΔG)。
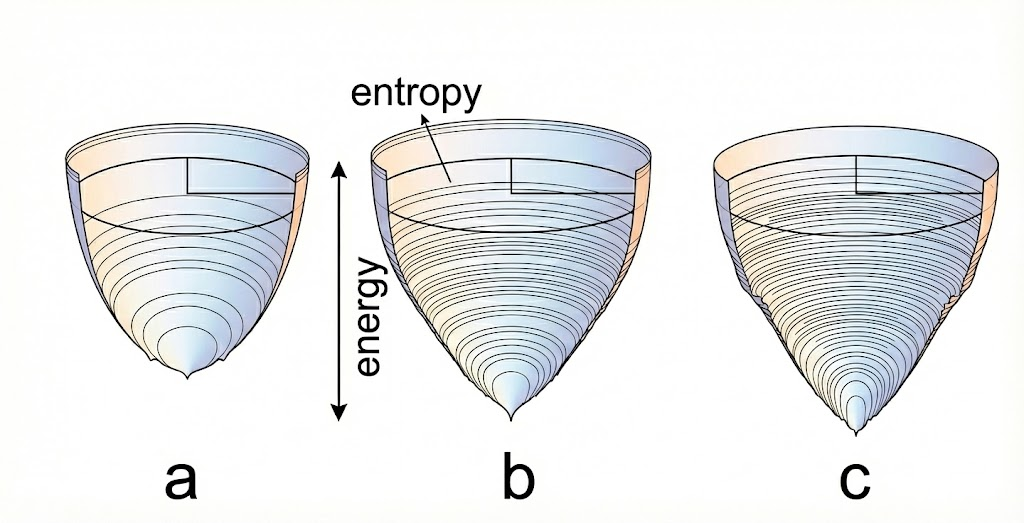
3.2 能量图景
早期观点认为折叠是一条特定的线性路径。然而,莱文塔尔佯谬(Levinthal's Paradox)指出,如果蛋白质随机搜索所有可能的构象,其所需时间将超过宇宙的年龄。现实中蛋白质在毫秒级折叠,这引入了能量图景和折叠漏斗理论。
蛋白质折叠的能量漏斗景观
3.3 分子伴侣
在高度浓缩的细胞环境中,新生蛋白质需要伴侣蛋白的协助才能正确折叠为具有生物功能的天然构象。这类蛋白的作用对象十分广泛,例如GroEL/GroES(原核)及其同源的真核系统Hsp60/Hsp10,就能帮助大多数球状蛋白完成折叠。
👀 四级结构
由两个或两个以上蛋白质链(亚基)组成的复合蛋白质结构,便是四级结构。
4.1 对称性与协同效应
大多数蛋白质复合物表现出高度的对称性(如二聚体、四聚体、六聚体)。这种对称性不仅赋予结构稳定性,还为变构调节提供了几何基础。
血红蛋白是四级结构功能的教科书级案例。它由 两个α亚基 和 两个β亚基 组成。
- 协同结合:当一个亚基结合氧气后,会诱导整个四聚体发生构象扭转,从低亲和力的T态转变为高亲和力的R态,使得剩余亚基更容易结合氧气。这种“牵一发而动全身”的协同效应,只有在四级结构的层面上才能实现。
- 波尔效应:质子(H+)和二氧化碳的结合能稳定T态,促进氧气释放。这一机制完美适配了机体在代谢旺盛组织(酸性环境)需要更多氧气的生理需求。
4.2 共翻译组装
长期以来,教科书认为蛋白质复合物的组装是“后翻译”的(Post-translational),即亚基各自合成、折叠好之后,在细胞质中扩散并随机碰撞组装。然而,德国海德堡大学Matilde Bertolini和Kai Fenzl等人的最新研究颠覆了这一认知,提出了共翻译组装模式,称其为 co-co 组装(co-co assembly)。
(1)机制详情:对于许多专性多聚体,其亚基在未完全脱离核糖体时就开始了组装。
- 分子系绳:两个正在翻译相应mRNA的核糖体在空间上彼此靠近。
- 新生链互动:从核糖体出口通道露出的新生多肽链,在尚未完全合成结束时,就已经在核糖体之间的狭小空间内相互接触、缠绕并形成部分三级/四级结构界面。
(2)生物学意义:
- 防止聚集:许多亚基的结合界面是疏水的,如果完全合成后再寻找伴侣,暴露的疏水面极易导致错误聚集。Co-co组装在“出生”的瞬间就保护了这些界面。
- 提高效率:将三维空间的随机搜索简化为核糖体邻近区域的局部结合,极大提高了组装效率。
- 异构体特异性:这种机制确保了正确的亚基配对(如同源二聚体),防止了与结构相似但功能不同的其他异构体发生错误杂交。
👀 从静态晶体到动态机器:药物设计的新纪元
回顾蛋白质模型的演变史,我们清晰地看到一条主线:从静态到动态。
- 1.0 时代(静态):PDB中的晶体结构被视为蛋白质的唯一形态。药物设计遵循“锁钥模型”,主要寻找能够塞进活性口袋的竞争性抑制剂。
- 2.0 时代(动态系综):认识到蛋白质在溶液中是一组构象的集合。天然态并非单一结构,而是能量图景底部的一簇构象。
- 3.0 时代(分子机器与调控):受人工分子机器(2016年诺贝尔化学奖)的启发,我们开始将蛋白质视为执行复杂机械运动的装置(如驱动蛋白的行走、ATP合成酶的旋转)。
对药物设计的启示:
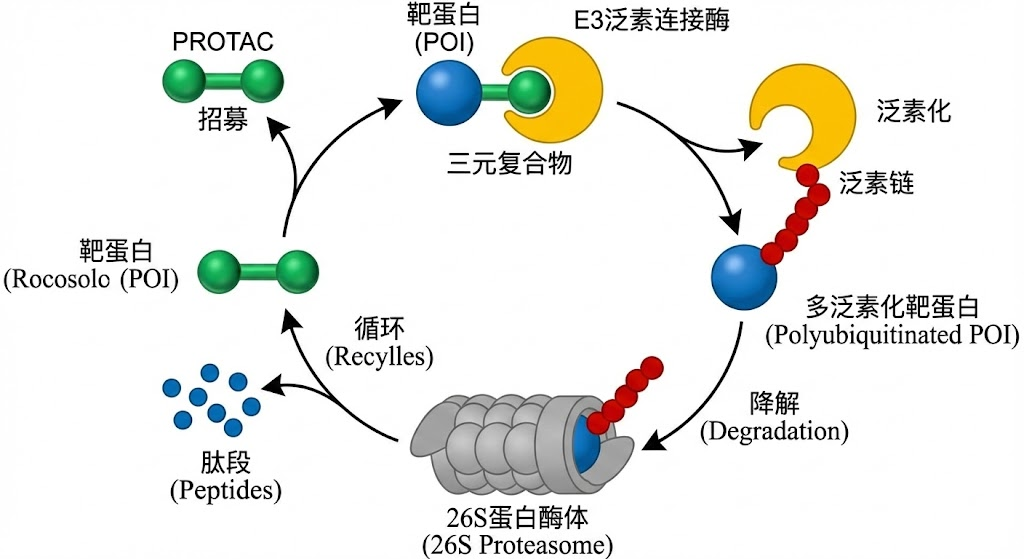
现代药物发现不再局限于正位竞争,而是转向变构调节。通过结合在远离活性中心的变构位点,药物可以“锁定”蛋白质的某种特定构象(如非活性态或特定的功能态),或者改变其构象转换的动力学参数。此外,针对蛋白质组装界面的干扰剂、利用PROTAC技术劫持泛素化降解系统,都是基于对蛋白质动态生命周期深刻理解的产物。
PROTAC 的作用机理
👀 结语
从贝采利乌斯试管中神秘的“首要物质”,到如今冷冻电镜下轰鸣运转的“分子机器”;从安芬森试管中自发的折叠复性,到细胞内精密的共翻译组装流水线。蛋白质模型的演变,本质上是人类对微观世界复杂性认知维度的不断提升。
当我们将视角从原本静止的晶体结构,转向那些在毫秒间完成“共翻译组装”的动态机器时,才真正触碰到了生命的底层逻辑。蛋白质不仅仅是化学键的堆砌,更是能量与信息在微观尺度的完美共舞。只有读懂了这种“动态的语言”,我们设计出的药物才能真正与生命对话。
扩展阅读:
1. hC Bio完成2400万美元A轮融资,开发蛋白质编辑疗法
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论