
回顾药物发现的漫长历史,20世纪70年代以前的岁月虽不乏青霉素等光辉时刻,但在某种程度上仍带有“盲人摸象”的局限性。那时的科学家受限于自然进化的藩篱,只能在天然产物和随机突变中寻找治疗的契机。然而,随着20世纪70年代生物技术革命的爆发,一场从“发现”到“设计”的范式转移彻底改变了医药工业的格局。本文将深入剖析重组DNA、PCR、基因测序、蛋白质组学及单克隆抗体技术如何互为基石,共同构建起现代生物医药的宏伟大厦。
一、重组DNA与转染技术的诞生
在1953年沃森和克里克揭示DNA三维结构后的很长一段时间里,科学家们虽然看清了生命的“源代码”,却苦于手中没有编辑代码的“键盘”。直到20世纪70年代,这一僵局才被打破。
生物技术革命的基石,建立在对酶的掌控之上。早期的研究者在探索中发现了DNA聚合酶、连接酶以及逆转录酶,这些工具使得DNA的合成与修饰成为可能。然而,真正的突破点在于限制性内切酶的发现。这种酶被形象地称为“分子剪刀”,它能在DNA双链的特定位置进行精准切割,通过切割产生的“黏性末端”,使得不同来源的DNA片段能够像拼图一样被重新组合。
重组DNA技术原理
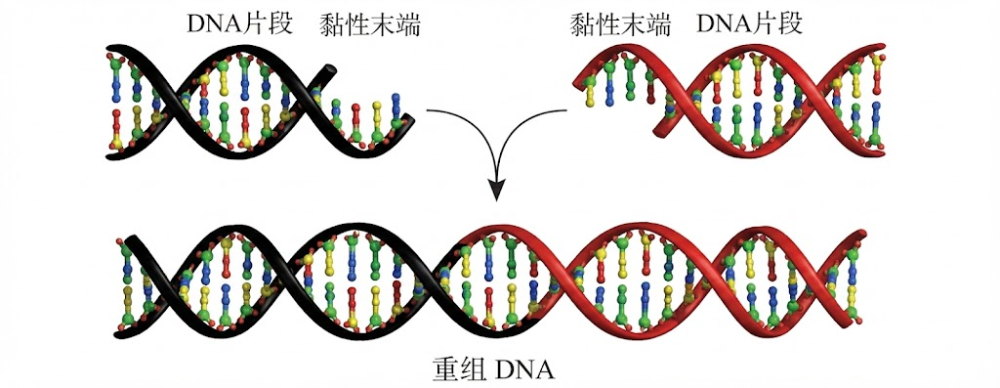
这一发现的意义在于,它赋予了人类上帝般的能力——跨物种的遗传物质转移。
1972年,斯坦福大学的彼得·洛班(Peter Lobban)在其博士开题报告中极具前瞻性地提出,结合病毒生物学与DNA修饰技术,可能实现遗传物质的跨物种转移。这一设想迅速在1974年由斯坦利·N.科恩(Stanley N. Cohen)和赫伯特·W.伯耶 (Herbert W. Boyer)转化为现实,他们申请了著名的重组DNA专利,核心思想是:利用基因改造的微生物(如细菌)作为微型工厂,生产人类所需的蛋白质。
这项技术彻底颠覆了药物生产的逻辑。过去,我们要获取胰岛素,必须从屠宰场的牛胰腺中提取,纯度低且易引起过敏。而通过重组DNA技术和转染技术,科学家可以将人类胰岛素基因导入细菌或细胞系中,让这些细胞源源不断地分泌高纯度的人源蛋白。
基因泰克(Genentech)与安进(Amgen)等生物技术巨头的崛起,正是基于这一技术的商业化应用。重组人胰岛素 的上市,不仅宣告了生物药时代的来临,也验证了通过基因工程手段解决临床未满足需求的巨大潜力。
二、聚合酶链反应技术(PCR)的自动化之路
如果说重组DNA解决了“质”的问题,那么PCR技术则解决了“量”的瓶颈。在20世纪80年代以前,获取足够数量用于分析的DNA样本是一项耗时费力的苦差事。
2.1 寻找耐热的“复制机器”
DNA复制的原理虽然简单——加热解链、引物结合、酶催化延伸,但在早期操作中,每经过一轮高温解链,普通的DNA聚合酶就会失活,研究人员不得不手动在每一轮循环中添加新的酶。这种低效的人工操作严重限制了DNA分析的普及。
转折点出现在对极端环境微生物的研究中。科学家在黄石公园的滚烫热泉中发现了一种名为水生栖热菌(Thermus aquaticus)的微生物,它进化出了一种能够在高温下保持活性的DNA聚合酶——Taq聚合酶。
聚合酶链反应(PCR)的循环机制
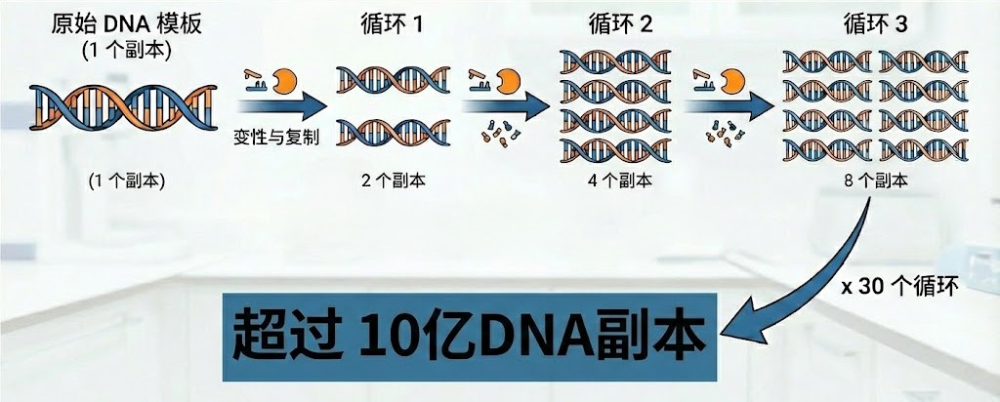
2.2 自动化的胜利
1983年,Cetus公司的凯瑞·穆利斯(Kerry Mullis)天才地将Taq酶应用于PCR技术,开发出了自动化的热循环仪。这一技术的问世,使得DNA片段的扩增变得像复印文件一样简单。仅仅经过30个循环,原本微量的DNA就能被扩增10亿倍以上。
PCR技术的普及不仅加速了药物研发中的基因克隆过程,更引发了法医学(DNA指纹)、遗传病诊断以及传染病检测的革命。穆利斯也因此获得了1993年的诺贝尔化学奖,这一殊荣实至名归,因为他将分子生物学的操作门槛从“手工作坊”提升到了“工业自动化”水平。
三、从桑格测序到人类基因组计划
拥有了制备和扩增DNA的能力后,科学家的野心进一步膨胀:我们能否读懂由A、T、C、G组成的生命天书?
弗雷德里克·桑格(Frederick Sanger)是这一领域的灯塔。他先是提出了“加减法”测序,随后在1977年确立了更为经典的“链终止法”。
桑格法的核心在于使用双脱氧核苷酸(ddNTPs)。这些特殊的核苷酸缺少链延伸所需的3'-OH基团,一旦被整合进DNA链,复制就会立即终止。通过四个反应体系分别加入四种不同的ddNTPs,再结合凝胶电泳分离不同长度的片段,科学家就能像拼图一样读出DNA的序列。
随后的技术进步,特别是胡德(Hood)等人引入的荧光标记技术和自动化毛细管电泳,彻底淘汰了危险的放射性同位素,并将测序速度提升了数个数量级。
测序技术的成熟直接催生了生物学史上最宏大的工程——人类基因组计划(HGP)。这是一场政府与商业资本的博弈与协作。
- 政府队:由美国能源部(DOE)和国立卫生研究院(NIH)牵头,旨在建立人类基因组的完整图谱。
- 商业队:以克雷格·文特尔(J. Craig Venter)创立的Celera Genomics为代表,试图通过“鸟枪法”测序更快地完成任务并寻求商业变现。
这场竞争最终在2001年画上句号,双方共同发表了人类基因组草图。但这仅仅是开始,随后流感嗜血杆菌、酵母、大肠杆菌、果蝇等模式生物的基因组相继被破译。
对于药物研发而言,基因组计划是一座巨大的金矿。它从根本上改变了靶点发现的逻辑——我们不再需要盲目筛选,而是可以通过基因数据挖掘潜在的疾病相关位点。然而,拥有了基因组数据,我们很快发现了一个尴尬的现实:基因并不直接等同于功能。
四、蛋白质组学的崛起
随着 依伐卡托(ivacaftor)、克唑替尼(crizotinib)等基于基因组信息开发的药物上市,人们意识到“后基因组时代”的挑战更为艰巨。基因只是蓝图,蛋白质才是执行生命功能的建筑工人和砖块。
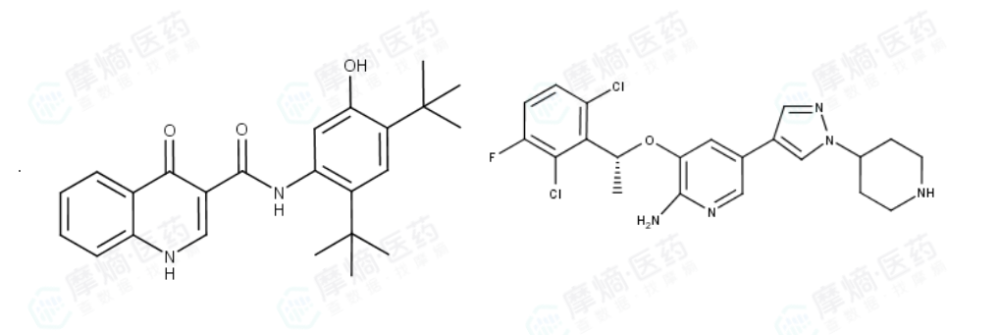
左:依伐卡托;右:克唑替尼
细胞表型的多样性远超基因的数量。转录后的修饰、翻译后的加工、蛋白质之间的相互作用,这些动态的过程是静态的基因组无法描述的。因此,蛋白质组学应运而生。
蛋白质组学的发展依赖于两大核心技术的进步:
1. 分离技术:从早期的双向凝胶电泳(2D-PAGE),发展到高效液相色谱(HPLC),实现了对复杂蛋白混合物的高效分离。
2. 鉴定技术:电喷雾电离质谱(ESI-MS)的引入是革命性的。芬恩(John Fenn)发明的这项技术,使得大分子蛋白质能够被温和地离子化并进入质谱仪检测,而不会被打碎。
结合生物信息学数据库(如Yates开发的算法),科学家现在可以快速将质谱产生的海量数据与基因组数据库进行比对,从而精准鉴定蛋白质的身份。这让药物研发人员能够直观地比较健康与疾病状态下的蛋白表达差异,寻找真正的药物靶点。
五、单克隆抗体与杂交瘤技术
在生物技术革命的浪潮中,单克隆抗体(Monoclonal Antibodies, mAbs)无疑是最耀眼的明星之一。它实现了保罗·埃尔利希(Paul Ehrlich)在一个世纪前预言的“魔法子弹”——精准打击病灶而不伤害正常组织。
5.1 永生的细胞:杂交瘤技术
虽然F. M.波奈特的“克隆选择学说”早已指出每个B细胞只产生一种特异性抗体,但当时的技术还不足以创建稳定的可生成抗体的细胞系。
1975年,治斯·科勒(Georges Köhler) 和 瑟赛·米尔斯坦(César Milstein)通过一个巧妙的实验解决了这个问题:他们将短命但能产生抗体的B细胞与长寿但不能产生抗体的骨髓瘤细胞(癌细胞)融合。这种融合后的细胞——杂交瘤细胞,兼具了双亲的优点:既能像癌细胞一样在体外无限增殖,又能像B细胞一样分泌单一特异性的抗体。
杂交瘤技术流程图
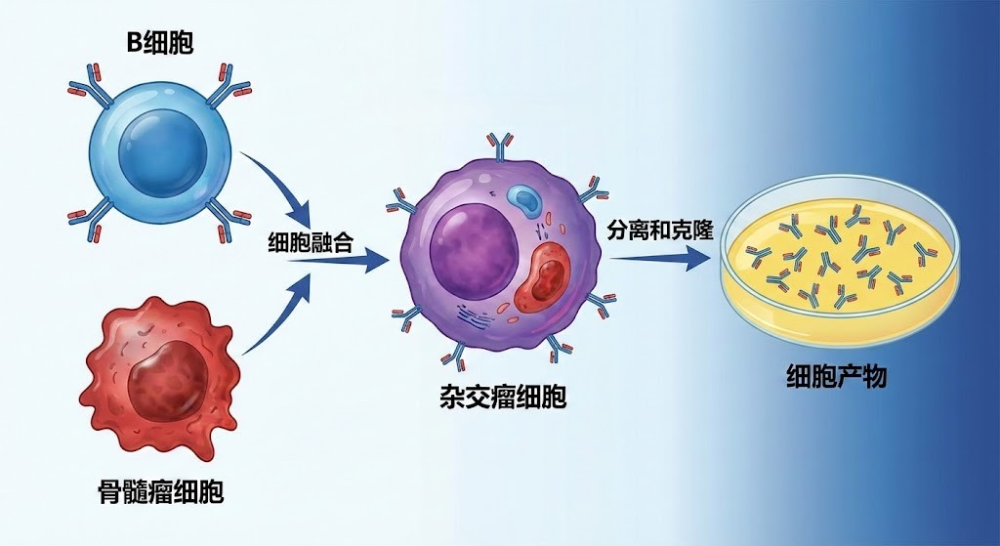
5.2 从实验室到重磅炸弹
杂交瘤技术让抗体的规模化生产成为可能。然而,早期的鼠源性抗体在人体内会引发免疫排斥(HAMA反应)。随着基因工程技术的介入,人源化抗体(Humanized antibodies)乃至全人源抗体逐渐成为主流。
如今,单克隆抗体已成为制药皇冠上的明珠。从治疗乳腺癌的曲妥珠单抗(Herceptin),到治疗类风湿关节炎的 英夫利西单抗(Remicade),再到各类免疫检查点抑制剂,单抗药物凭借其极高的特异性和疗效,彻底改变了癌症和自身免疫疾病的治疗图景。这种临床价值的爆发,也直接转化为了惊人的商业价值。以自身免疫领域的标杆药物 英夫利西单抗(Infliximab)为例,据摩熵医药数据库收录的历年销售数据显示,该药物的全球累计销售额已超过 1000亿美元。
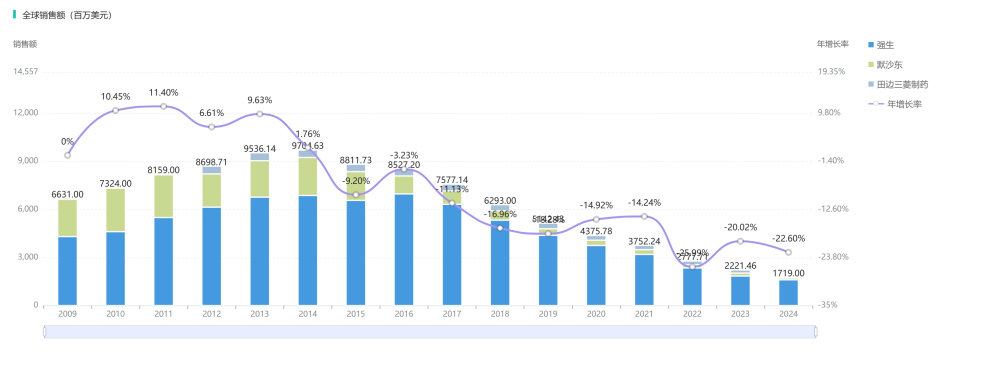
查数据,找摩熵!图源:摩熵医药数据库
六、大分子药物的黄金时代
生物技术革命并非孤立技术的堆砌,而是各种技术手段的有机融合。重组DNA、PCR、基因测序、杂交瘤技术,这些工具共同催生了一个全新的药物类别——生物制剂(Biologics)。
6.1 超越天然:融合蛋白的设计
科学家不再满足于模仿天然蛋白,而是开始通过基因工程创造自然界不存在的分子。例如,受体构建融合蛋白(Receptor construct fusion protein)技术,将受体的特异性识别结构域与免疫球蛋白(Ig)的Fc片段融合。
这种设计极其精妙:受体部分负责精准捕捉体内的致病因子(如炎症因子),而Fc片段则赋予了药物极长的半衰期和稳定性。阿巴西普(Orencia)和 阿柏西普(Eylea)就是此类设计的杰出代表,前者用于关节炎,后者用于眼底病变,均取得了巨大的临床成功。
6.2 产业格局的重塑
这一系列技术进步也重塑了全球医药产业的版图。曾经专注于小分子化学药的传统制药巨头(Big Pharma),为了不被时代抛弃,纷纷斥巨资收购生物技术公司(Biotech)。罗氏收购基因泰克、赛诺菲布局生物药,都是为了抢占这一高技术壁垒、高附加值的市场。
结语
回顾这短短几十年的历史,我们不禁感叹:如果缺乏上述任何一项生物技术的突破,现代药物发现都将寸步难行。
生物技术革命不仅提供了工具,更提供了一种全新的思维方式——从理解生命信息的底层代码(DNA)出发,向上解析功能的执行者(蛋白质),最终利用工程化的手段(抗体、重组蛋白)去修正错误的生命过程。
虽然目前生物大分子药物仍面临诸如无法穿透血脑屏障等挑战,但随着技术的迭代,这些壁垒终将被打破。我们正处于一个药物研发最好的时代,一个从“寻找偶然”迈向“理性创造”的辉煌时代。
往期精彩:
1. 动物模型进化史:揭秘Wistar大鼠、裸鼠与转基因技术,如何成为AI时代前药物研发的“活体显微镜”
2. 新药研发全景图:从分子发现到临床确证,再到上市后监测的挑战
3. 药物研发“经典靶点”大揭秘:GPCRs、离子通道、酶、转运体、核受体全解析
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论