
共线生产需要满足的一个硬指标就是清洁验证,清洁验证通过的产品可以顺利共线生产。但是因为清洁的限度低、产品的性质差异等对于分析方法的开发存在一定的挑战。清洁验证的分析方法开发的思路和方式直接关系方法的验证通过性,本文通过实例分享来助力同行对清洁验证分析方法开发的一般了解。
01、清洁限度的确认
一、清洁限度的常用三种计算公式如下:
1.10ppm法:
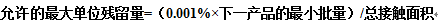
2.基于治疗量的1/1000法:

3.PDE法:
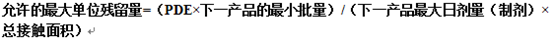
二、待清洁产品的限度计算:
需要根据共线产品的排列组合,并分别采用以上三种计算公式,最后计算出拟进行清洁分析方法开发的产品的限度。
举例:生产线中,共线品种为A和B,其中A为清洁分析方法开发的目标产品,B的最小批量为50L,A的最小日剂量10ml(100mg),B的最大日剂量2ml(50mg),生产中接触配液罐10300cm2,配液管线7700cm2,灌装管线500cm2,A的PDE值为2.5μg/天。
计算A的允许最大单位残留量:
1. 10ppm法为:27.03μg/ cm2
2. 基于治疗量的1/1000法为:0.14μg/cm2
3. PDE法为:3.38μg/ cm2
因此,A的允许最大单位残留量为:0.14μg/cm2
02、方法开发要点
一、方法限度的确定
首先,需要确认的先决条件包括:
擦拭法:拟应用的涂布面积(即擦拭的面积)和提取应用溶剂的量。
举例:擦拭面积为100cm2,提取溶剂为50ml,计算A的清洁验证擦拭限度:
擦拭限度计算得:0.28μg/ml
淋洗法:取样中清洁溶剂的用量。
举例:取样中清洁溶剂的用量为50L,计算A的清洁验证擦拭限度:
擦拭限度计算得:0.052μg/ml
注:一般为了分析方法的检出能力更强,结合预实验中擦拭和淋洗的回收率考察结果,针对于擦拭限度和淋洗限度可以加适当的系数进行校正,如系数为75%,那么本例中的擦拭和淋洗限度分别为0.21μg/ml和0.039μg/ml。
二、方法定量限的考察
清洁验证中产品A的残留量,本质是针对A的含量测定,一般可以首选含量测定的方法,并且于在确定擦拭和淋洗的限度后,采用拟定的含量测定的方法考察定量限,方法的定量限的一般可接受标准为擦拭或淋洗限度(二者较小者)的20%,至少达到50%。
三、擦拭回收率的考察
首先,需要确认的先决条件包括:
清洁溶剂:需确认产品的溶解性,在水中的溶解性和酸或碱中的溶解性。
擦拭溶剂:如水、醇、酸或碱等对待清洁的产品有足够的溶解能力的溶剂。
提取溶剂:如方法条件中的稀释剂、水、有机相或特定的溶剂等,需要根据待清洁的产品的性质有针对性的选择。
擦拭棉签的数量:需要设计不同数量的擦拭棉签考察回收率的变化情况。
擦拭棉签的溶剂浸润体积:不同浸润体积对擦拭回收率的影响较大,可以结合棉签的数量总和设计。
擦拭方法:一般采用的擦拭方法如下图所示:
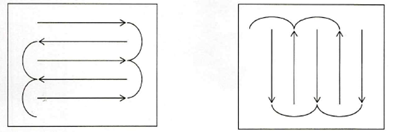
举例:A是由原料A和辅料Ⅰ制成的灭菌水溶液,在清洁验证的分析方法开发过程中,将限度浓度的对照品溶液涂布在10×10cm的不锈钢板后,方法开发的考察项目如下:
1.擦拭溶剂:擦拭溶剂先后采用水、乙醇、碱液,结果在应用水和乙醇时,回收率低于50%,应用一定浓度的碱液之后回收率可达到80%以上。
2.擦拭棉签的数量和浸润体积:2根棉签的回收率为36.3%,4根棉签的回收率为86.4%,5根棉签的回收率为85.9%。
3.进样分析前的供试品制备方法:擦拭棉签加入定量的提取溶剂超声,超声5min的回收率为46.7%,超声8min的回收率为86.2%,超声10min的回收率为86.9%;超声12min的回收率为85.5%。
综上考察:确认擦拭溶剂选择碱液,4根棉签进行擦拭试验,加入提取溶剂后超声10min。
需要注意的几点:①供试品进样分析前供试品的制备需要考虑进行样品中和;②棉签的浸润体积,需要根据棉签的实际选择适量体积的浸润溶剂;
四、淋洗回收率的考察
首先,需要确认的先决条件包括:
清洁溶剂:需确认产品的溶解性,在水中的溶解性和酸或碱中的溶解性。
稀释溶剂:根据淋洗溶剂和待清洁产品的性质选择合适的稀释溶剂,如果淋洗溶剂为酸或碱溶液,需要进行适当的中和后,进行稀释。稀释溶剂避免与待清洁成分发生反应影响样品的检测。
举例:C是由原料C和辅料Ⅰ制成的灭菌水溶液,在清洁验证的分析方法开发过程中,方法开发的考察项目如下:
1.进样前供试品的制备方法:直接用水为稀释剂制备供试品回收率仅为45.8%;更换稀释剂为X后供试品的回收率稳定在90%以上;分别考察了两种不同稀释剂的24小时内的供试品溶液稳定性,水为稀释剂的RSD为20.7%,稀释剂X的RSD为0.8%;
综上考察,淋洗回收率中需要关注供试品的制备方法,稀释剂的选择必须结合待测产品的性质合理筛选,进而提高方法的回收率。
03、方法验证内容
一、验证的项目
专属性、定量限与检测限、线性与范围、精密度、准确度、溶液稳定性
二、可接受标准讨论
专属性:要求空白、空白棉签溶液均不干扰测定结果、擦拭和淋洗的供试品溶液的主峰的测定均不受干扰;
定量限与检测限:按照S/N不小于10和3的要求进行判定,但是同时需要考察方法的定量限和检测限;
线性与范围:要求线性的相关系数不低于0.999,范围包括定量限至擦拭或淋洗限度较大者的200%;
精密度与准确度:可根据待测组分的含量范围按照Chp2020版的附录中要求;
综上所述,清洁分析方法的开发与验证是产品共线生产的前提,一般在开展中试试制之前需要进行本项研发工作,但是清洁分析方法开发的一般思路却又和含量测定方法略有差异,因此,本文结合了实际的案例对清洁分析方法开发的一般思路进行了适当的解析,希望可以与广大同行一起学习和探讨。
<END>




















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论