
在新药研发的漫漫征途中,药物首次进入临床试验,无疑是一个极具意义的重大里程碑。这背后意味着相关靶点已完成了基因表达、蛋白质结构和功能等多方面的生物学功能验证,极有可能在对应疾病的发病机制里扮演着关键角色,为攻克疾病带来新的希望。今天,我们聚焦3月崭露头角、首次进入临床的两个重要靶点——ACK1 和 CD83,看看它们如何引领医药创新。
ACK1:前列腺治疗的新曙光?
ACK1(Activated Cdc42-associated kinase 1),也称为TNK2,是一种非受体酪氨酸激酶,由TNK2基因编码。它能够结合多种受体酪氨酸激酶,如EGFR、MERTK、HER2、PDGFR和胰岛素受体等,并通过磷酸化下游效应分子(如AKT)来传递细胞外信号,可调节多种肿瘤中的各种致病信号传导事件。
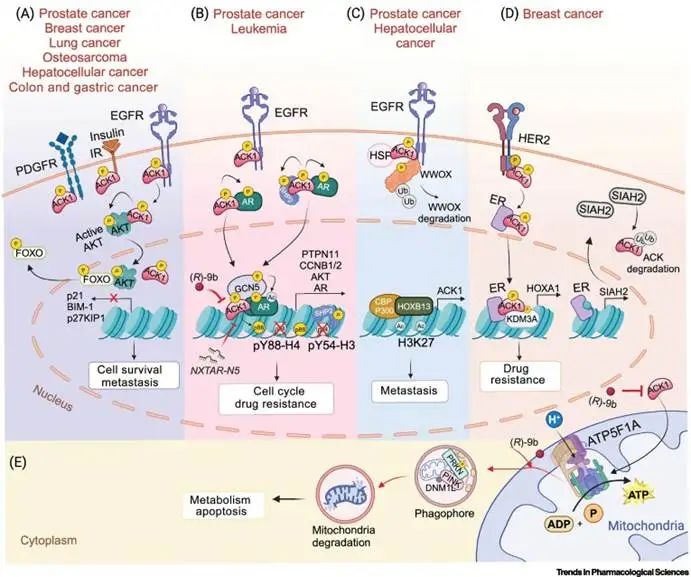
ACK1激酶在多种癌症的发生和耐药性中发挥重要作用。前列腺癌中,ACK1促进AR核转位及转录激活,增强去势抵抗性,并抑制AR抑制性长链非编码RNA(NXTAR),为CRPC治疗提供新思路。乳腺癌中,ACK1促进细胞周期基因转录,导致CDK4/6抑制剂耐药,在TNBC中敲除ACK1可抑制肿瘤生长。肺癌中,ACK1通过STAT3、AKT和MAPK信号促进肿瘤进展和耐药。结直肠癌与胃癌中,ACK1受TNF-α激活,促进AKT信号并调控上皮-间充质转化。血液恶性肿瘤中,ACK1通过SHP2磷酸化调节MAPK信号,与CSF3R突变相关。ACK1在肝癌、骨肉瘤及胶质瘤中亦具促癌作用。
ACK1在多种癌症中过表达或基因扩增,包括前列腺癌、乳腺癌、非小细胞肺癌、胶质瘤、卵巢癌、胰腺癌和结直肠癌等。
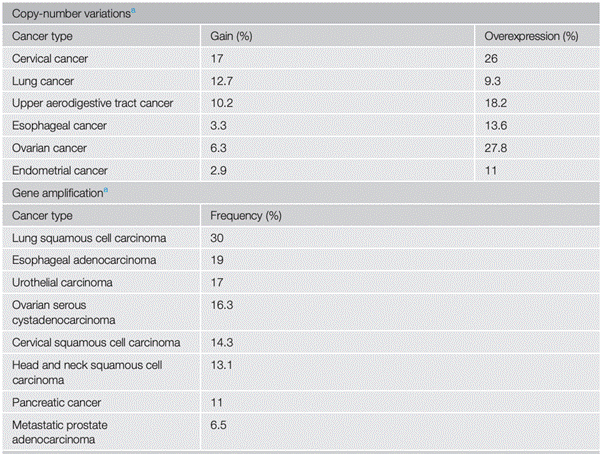
在免疫调节方面,ACK1抑制T细胞活化。ACK1通过磷酸化CSK结合蛋白(CBP/PAG)及CSK(pY18-CSK),增强CSK活性,进而限制T细胞活化。CRPC患者在接受免疫检查点抑制剂(ICB)治疗后,ACK1/pY18-CSK信号通路被重新激活,导致ICB耐药。ACK1的基因敲除或抑制剂治疗可克服ICB耐受,提示ACK1抑制剂可与ICB联合用于治疗耐药性实体瘤。
(R)-9b:前列腺癌治疗新星的研发之路与潜力探索
(R)-9b 正由 TechnoGenesys 紧锣密鼓地进行商业化开发。其研发历程可追溯至 2017 年,莫菲特癌症中心的研究人员在《cancer cell》发表的论文中,首次向世人报道了 (R)-9b。当时的研究揭示了一个关键机制:酪氨酸激酶 ACK1(TNK2)能够通过磷酸化 AR 启动子上游的组蛋白 H4 酪氨酸 88(pY88-H4),促使 WDR5/MLL2 复合体与之结合,引发 H3K4 三甲基化修饰。这一系列反应最终增强了 AR 及其剪切变体 AR-V7 的转录,直接导致前列腺癌向去势抵抗性(CRPC)状态发展,并维持其恶性特征。而 ACK1 抑制剂(R)-9bMS 则如同“刹车”一般,可逆转 pY88-H4 修饰,让 CRPC 细胞重新对雄激素治疗敏感,同时降低 AR/AR-V7 水平,有效抑制肿瘤生长。这一发现明确了 ACK1 介导的表观遗传回路在 CRPC 发展中的核心作用,为后续治疗指明了新方向。
2022年6月,莫菲特癌症中心研究人员再次在《science translational medicine》发表重磅研究,聚焦去势抵抗性前列腺癌(CRPC)对恩杂鲁胺耐药的关键机制。原来,AR 在锌指 DNA 结合结构域的赖氨酸 609(K609)发生乙酰化(acK609-AR),这使得 AR 即便面对恩杂鲁胺的抑制,仍能进入细胞核并激活特定转录程序,实现“逃逸”。深入探究发现,ACK1(TNK2)激酶介导的 AR Y267 磷酸化是 AR K609 乙酰化的必要前提,二者形成正反馈回路,不断推高 AR 和 ACK1 的表达水平,加速 CRPC 进展和耐药性发展。令人欣喜的是,ACK1 小分子抑制剂(R)-9b 能够精准阻断 AR Y267 磷酸化,进而抑制 K609 乙酰化,显著遏制恩杂鲁胺耐药 CRPC 肿瘤的生长,为 CRPC 患者带来新希望。
2022年12月,研究人员在《nature communication》又有新突破。他们发现 ACK1 通过磷酸化 C-terminal Src 激酶(CSK)的酪氨酸 18(pY18)增强 CSK 功能,抑制 T 细胞激活,致使实体瘤对免疫检查点阻断(ICB)治疗产生耐受。Tnk2 基因缺失小鼠呈现出 CSK Y18 磷酸化减少,CD8 + 和 CD4+ T 细胞自发激活的现象,ICB 耐药肿瘤生长得到抑制。在接受 ICB 治疗的去势抵抗性前列腺癌(CRPC)患者中,ACK1/pY18-CSK 信号通路被重新激活,进一步证实该通路在 ICB 耐受中的关键作用。值得一提的是,ACK1 小分子抑制剂(R)-9b 对 ICB 耐药肿瘤同样具有抑制效果,这一发现为克服 ICB 耐药性开辟了新路径,有望拓展 ICB 疗法的应用边界。
来到当下,TechnoGenesys 于 2025 年 3 月正式启动 (R)-9b 的 1 期临床试验。此次试验旨在评估 (R)-9bMS 对转移性去势抵抗性前列腺癌患者的安全性和耐受性,计划招募 30 名患者,患者需每日口服两次 (R)-9b,最长持续 6 个月,试验预计于明年 3 月公布数据,届时 (R)-9b 的临床潜力将进一步明晰。


前列腺癌在全球男性癌症中占据显著地位,是全球男性中第二大常见癌症。2022 年,全球范围内约有 146 万例新诊断病例,这一庞大数字凸显了该疾病对男性健康的严重威胁。在前列腺癌的病程发展中,去势抵抗性前列腺癌(CRPC)是一个极为棘手的阶段。10 - 20% 接受雄激素剥夺疗法(ADT)的前列腺癌患者,通常会在 2 - 3 年内疾病复发,进展为 CRPC。这不仅极大地增加了治疗难度,也严重影响了患者的预后。
从市场规模来看,根据 grand view research 的测算,2024 年全球 CRPC 市场规模达到 129 亿美元,并且预计在未来 5 年将以 8.7% 的复合年增长率(CAGR)持续增长。这一增长趋势反映出 CRPC 治疗领域存在着巨大的市场需求,随着人口老龄化的加剧以及前列腺癌发病率的上升,对更有效的 CRPC 治疗手段的需求愈发迫切。
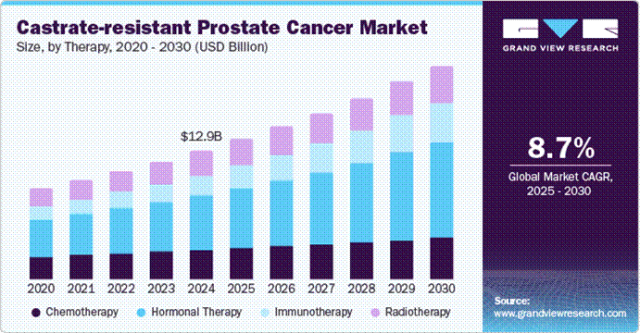
当前,CRPC 的治疗方式呈现多样化格局。化疗作为一线疗法,多西他赛是常用药物,使用多西他赛后患者的中位总生存期(mOS)为 19.2 个月。然而,化疗往往伴随着诸多副作用,对患者生活质量影响较大。雄激素受体(AR)靶向疗法常作为二线疗法,以恩杂鲁胺为例,在治疗使用多西他赛后进展的患者时,mOS 为 18.4 个月。但令人遗憾的是,几乎所有患者最终都会对恩杂鲁胺产生耐药性,使得治疗效果大打折扣。在其他靶向疗法中,PARP 单药作为 AR 进展后的单药三线疗法,奥拉帕尼的 mOS 为 18.5 个月;当与 AR 疗法联合作为一线疗法时,阿比特龙联合奥拉帕尼的 mOS 可达 42.1 个月。这些数据表明,现有治疗手段虽在一定程度上延长了患者生命,但仍存在诸多局限性,急需新的治疗药物来突破困境。(R)-9b 作为一种极具潜力的新型治疗药物,要在竞争激烈的 CRPC 治疗市场中脱颖而出,需要在临床试验中展现出比现有药物更优异的疗效。
目前,针对 ACK1 靶点的特异性抑制剂主要有两款,分别是 TechnoGenesys 公司研发的 (R)-9b 以及四川大学研发的 21-a。其中,(R)-9b 在该领域处于领先地位,市场竞争态势相对缓和。

CD83:白血病潜力靶点
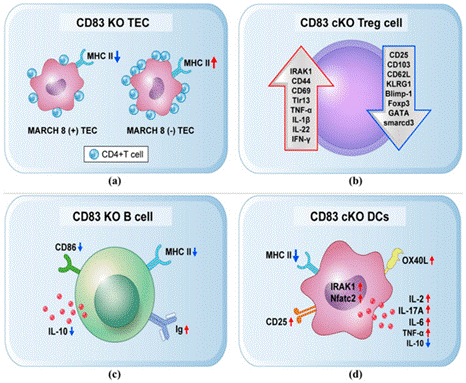
CD83是一种免疫球蛋白超家族成员,主要表达于成熟的树突状细胞(DCs)、激活的B细胞和T细胞等免疫细胞表面。它有两种形式:膜结合型(mCD83)和可溶型(sCD83),其中mCD83是成熟DCs的标志物。CD83在免疫应答中发挥重要作用,不仅作为共刺激分子促进T细胞和B细胞的活化,还参与调节炎症反应和维持免疫耐受。此外,sCD83在一些疾病模型中显示出治疗潜力,如在类风湿关节炎和炎症性肠病模型中,sCD83可通过调节细胞因子水平和诱导调节性T细胞来减轻炎症。
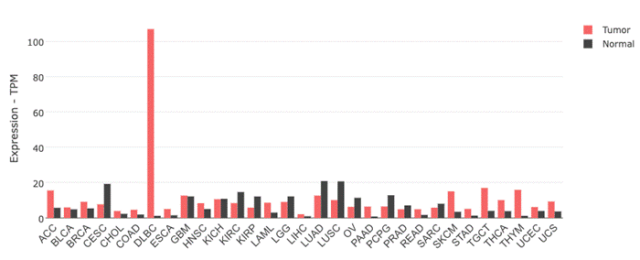
基于 GEPIA 数据,CD83 在弥漫性大 B 细胞淋巴瘤(DLBC)中呈现出较高的特异性表达。此外,在近些年的研究里,CD83 在急性髓系白血病(AML)以及乳腺癌(BC)中同样具有特异性表达。
CD83 CAR-T 疗法:急性髓系白血病治疗的新希望
在癌症治疗领域,CAR-T 细胞疗法正逐渐崭露头角,成为攻克癌症的有力武器。其中,针对 CD83 靶点的 CAR-T 疗法近年来备受关注,特别是在急性髓系白血病(AML)的治疗研究上取得了令人瞩目的进展。
罗斯威尔帕克癌症研究所作为该领域的先锋,已经将自体抗 CD83 CAR-T 推进至 1 期临床试验阶段,用于治疗复发或难治性急性髓系白血病。此次临床试验计划招募 26 名患者,旨在评估该疗法的安全性和初步疗效。这一举措为那些传统治疗手段无效的 AML 患者带来了新的希望。
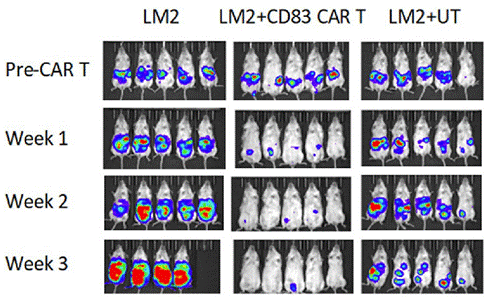
今年2月,罗斯威尔帕克癌症研究所还发表了关于 CD83 CAR-T 治疗乳腺癌的临床前研究成果。研究显示,CD83 CAR-T 细胞在输注后第1周,成功根除了 NSG 小鼠体内的 LM2 肿瘤。与仅接受 UT(未处理)或仅植入 LM2 肿瘤的小鼠相比,接受 CD83 CAR-T 治疗的小鼠,其 LM2 BLI 辐射度显著降低。这一临床前研究结果,不仅展示了 CD83 CAR-T 在乳腺癌治疗方面的潜力,也为其在其他癌症类型中的应用研究提供了有力的理论支持。
急性髓系白血病是一种严重的血液系统恶性肿瘤。据统计,2021 年全球急性髓系白血病新发病例约为 14 万,其复发率高达 35%-85%。复发难治性 AML 具有高度的异质性,患者预后极差,5 年生存率仅约 10%。当前,临床指南推荐的治疗药物主要包括 FLT3 抑制剂、IDH 抑制剂和 BCL-2 抑制剂等,但这些药物仍无法满足所有患者的治疗需求,开发更有效的治疗手段迫在眉睫。

截图来源:白血病药物——市场研究专题报告
从市场前景来看,急性髓系白血病治疗市场呈现出良好的增长态势。2024 年,全球急性髓系白血病治疗市场规模估计达到 34.7 亿美元,预计在 2025 年至 2030 年期间,将以 10.6% 的复合年增长率持续增长。这一增长趋势,一方面反映了 AML 患者群体对有效治疗方案的巨大需求,另一方面也为相关治疗技术和药物的研发提供了强大的市场驱动力。
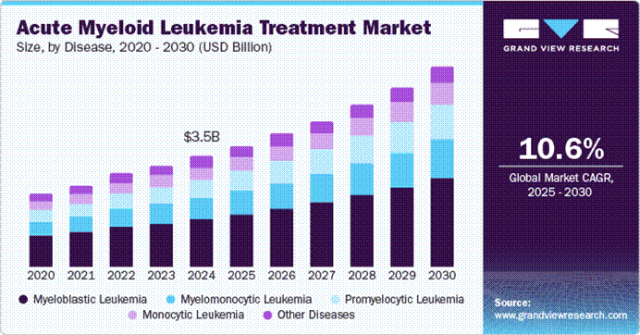
在竞争格局方面,CD83 靶点的布局目前相对较少,且参与者以非营利性组织为主,其中包括重庆大坪医院和墨菲特研究中心等。在这场角逐中,罗斯威尔帕克癌症研究所凭借其领先的临床试验进度,在 CD83 CAR-T 治疗领域占据了优势地位。随着研究的深入和临床试验的推进,CD83 CAR-T 疗法有望打破现有的 AML 治疗格局,为患者带来更为有效的治疗选择。

结语
在新药研发的征程中,3 月首次进入临床阶段的 ACK1 和 CD83 靶点备受瞩目。ACK1 在多种癌症中发挥着关键作用,其抑制剂(R)-9b 从基础研究迈向 1 期临床试验,若疗效理想,有望变革癌症治疗,打破去势抵抗性前列腺癌(CRPC)的困境。而 CD83 作为免疫调节的关键靶点,罗斯威尔帕克癌症研究所已将其 CAR-T 疗法推进至 1 期临床试验,若成功,将改写急性髓系白血病(AML)的治疗版图。这两个靶点承载着患者的希望,有望引领医药创新,推动行业迈向新的高度。
对于后来者而言,存在以下核心机会点:ACK1 的优势在于机制深度与联合价值,CD83 的优势在于靶点的新颖性与临床急需性。药企可基于自身管线优势,选择快速临床转化(如 CD83 CAR-T)或长线多维开发(如 ACK1 跨癌种 + 联合疗法),抢占细分领域的制高点。
参考来源:
1. ACK1/TNK2 kinase: molecular mechanisms and emerging cancer therapeutics
2. ACK1/TNK2 Regulates Histone H4 Tyr88-phosphorylation and AR Gene Expression in Castration-Resistant Prostate Cancer
3. Inhibiting ACK1-mediated phosphorylation of C-terminal Src kinase counteracts prostate cancer immune checkpoint blockade resistance
4. grand view research
5. GEPIA
6. CD83 Expression By Human Breast Cancer Mediates Effective Killing By CAR T
7. 摩熵咨询报告《白血病药物——市场研究专题报告》
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论