
小分子药物&基因治疗,PTC Therapeutics这个标题,其实是为了哗众取宠,疫情尚未过去,谈何“后疫情”呢,只是想回溯GMP的发展,在回顾历史的过程中,展望探讨在这个VUCA时代,GMP应该选择什么打法。
GMP,在制药、疫苗行业(包括人药&兽药,下同),从来不是新的名词,药品生产质量管理规范,GMP是指导药品、疫苗生产的方法论,也促进了国内外大量的相关行业,比如GMP咨询、制药行业相关的软硬件、GMP审计等。世界上第一版GMP诞生于美国FDA,1963年,迄今已有接近60年历史了,按照中国古代的说法,“六十而耳顺”,很多人在这个年纪到了写回忆录的时候了,那我们就在这个时刻回忆一下
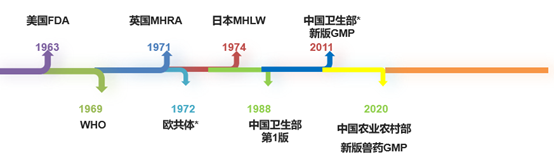
*:欧共体、卫生部几经更名,以当时名称体现。
浮沉六十载,任何法规的形成往往都源于沉痛的教训,在此,我们不回顾记者辛克莱的《丛林》,不回顾震惊寰宇的药害事件,我们看下GMP的发展壮大,最初众说纷纭,现在人人均在遵守,以至于做一件事情,都在想“GMP有么有规定,GMP检察官会不会挑战?”,暂且不讨论这个思路是否让大家“忘却初心”,至少侧面反映出目前GMP体系的日趋完善。
GMP发展迄今,可以分为3个阶段,以下的三个阶段不以时间为顺序。
第一个阶段,以2006年美国FDA颁布《Guidance for Industry Quality Systems Approach toPharmaceutical CGMP Regulations》为代表,截止目前世界公认的GMP体系概念依然采用该指南的六大体系,下图的体系圆球已经深入人心。包括后面陆续完善的质量管理概念和工具,GMP的主体结构已经搭建完毕,质量体系中文件管理、偏差&OOS管理,CAPA管理,变更控制,验证管理,投诉,内外审,趋势分析&管理评审,均与GMP其他体系深度融合,成为了坚实的堡垒。

第二个阶段,ICH发布相关指南~关于药物开发的Q8和关于质量风险管理的Q9,即QbD和质量风险概念的提出和数据完整性(目前统一翻译为数据可靠性,由于该名称以及深入人心,故仍称之为数据完整性)的概念为代表。尤其是质量风险管理的两条铁律,原则性与灵活性相统一,大力促进了GMP对业务的支持和嵌入。数据完整性,既为质量风险管理提供了真实稳定的依据,又进一步保证了GMP体系堡垒的“固若金汤”,可以说,质量风险管理可以使GMP这艘大船走得更快,是引擎;后者,数据完整性使GMP走得更稳,是边界;而QbD,以可靠的科学知识作为基石,对药品质量的风险进行科学合理的评估和控制,并强调对产品与工艺的深刻理解,最终达到理想的质量目标,这是一个系统的研发方法,这是方向。
质量风险管理的2个原则:
· 质量风险的评估应基于科学知识以及根本上和对患者/消费者的保护相联系;
· 风险管理过程程度、形式、记录应和风险水平相适宜
至此, GMP堡垒完工,一个有方向,引擎和边界,且具备自我优化能力(质量管理中持续改进、生命周期概念等是持续改进的良好工具)的体系,跌跌撞撞的步入到耳顺之年,貌似已经不需要任何的装饰,只需要执行即可。VUCA时代,新冠疫情,都促使我们深思,后面GMP还能采用什么打法,我认为,既然耳顺之年代表可以听得进去各种想法,那么这个阶段,姑且称之为第三阶段,GMP还可以有很多打法:
1,精益生产的瘦身打法。精益生产最早由丰田提出,丰田1962开始导入全面质量控制TQC,这基本也是丰田生产系统TPS的基本构成,可以说精益生产天然是包含质量管理的。特别是4+7带量采购的落地实施,意味着制药企业躺着赚钱的日子已经过去,企业面临生产成本、供货周期及产品质量上的多重竞争与挑战,制药企业精益化生产迫在眉睫。精益生产是否代表着不停的减减减,肯定不是,这是在GMP(仅指生产运营端的精益,其他端口参照GxP)框架内的精益生产,能够给企业带来合规和效益,GMP与精益有很共用的质量管理工具,也为GMP在精益中的实施带来了天然的优势。
2,相关方管理的抱团打法。关联审评,4+7集采,甚至俄乌战争,新冠疫情,中美贸易战,都对供应链的稳定性提出了新的挑战。企业是多元利益相关者相互关系的联结。任何一个企业都有许多利益相关者,如投资者、供应商、员工、第三方,众所周知,制药/疫苗变更主要物料的供应商,一般情况少则几个月,多则数年,因此,在GMP框架下,通过质量协议、互相促进等方式,找到双方、多方共同认可的方式持续合作和经营,是挑战,也是机会。
3,技术尊崇的聚焦打法。GMP成立至今,其依然“初心不改”,目的依然是降低生产过程中污染、交叉污染以及混淆、差错等风险,对于该产品工艺的参数,应该是2.0-3.3抑或5.2-6.5,这不是GMP可以解决的,GMP是方法论,可以提供工具方法加快和更有效的找到解决方案,但是具体的解决方法仍然是技术才能推动。因此,很多GMP检查过程中提出的偏差调查不充分,变更评估不充分,要么是产品在研发过程就带来的病根,要么是产品工艺不稳定等技术研究不充分导致的。因此,如何聚焦技术带来的产品质量的持续改进,也是GMP需要引导的课题。
貌似精益生产、相关方管理、技术改进,与GMP又有关联又没有关联,这让我想起《让子弹飞》张麻子对黄四郎说的那句话“你对我不重要,没有你,对我很重要”,同样对于监管方来说,“运行GMP,我不关注,没有GMP,我很关注。”
<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论