
生物制药蓬勃发展
2002年,全球首个全人源单抗药物阿达木单抗(商品名:修美乐,英文商品名Humira)上市后,全球生物药领域开启了20年的高速发展并仍保有较大增长潜力。修美乐曾连续8年蝉联全球药物销售额榜首,虽然2021年由辉瑞和BioNTech联合研发的mRNA新冠疫苗Comirnaty营收达到了创纪录的367.81亿美元,成为新“药王”,但修美乐的2021年业绩也首次突破200亿美元,达到206.94亿美元。与化药增速相比,生物药市场增长迅速,在全球医药市场中占比持续攀升。
然而新药开发九死一生,业界一直流传着“双十定律”的说法,即开发一款新药平均需要10年、耗资10亿美元,许多企业为了降低风险,节约成本,会选择CDMO企业为其提供工艺研发及生产服务。同时,MAH制度下产、研、销分离,助力CDMO企业获得更多新药合作机会。况且生物药研发热度不减,相对于化药,生物药的复杂性也影响着新药开发的效率,促使生物药CDMO业务乘势而上。
国内生物药CDMO加大布局
随着越来越多的玩家入局,生物药CDMO竞争渐趋激烈,除了本土CDMO企业,少数海外CDMO巨头也已进入中国市场,以期在中国的创新药研发浪潮中发掘机会。除此之外,部分国内生物制药企业也充分利用自身优势,加速CDMO布局;以下为部分举例。
- 1.三生制药,晟国医药
晟国医药是三生制药独立的CDMO服务平台,专注于生物药、基因治疗和细胞治疗的研究、开发、临床样品生产和商业化生产服务,CDMO工厂分布于中国上海、苏州、沈阳、广东以及意大利科莫。
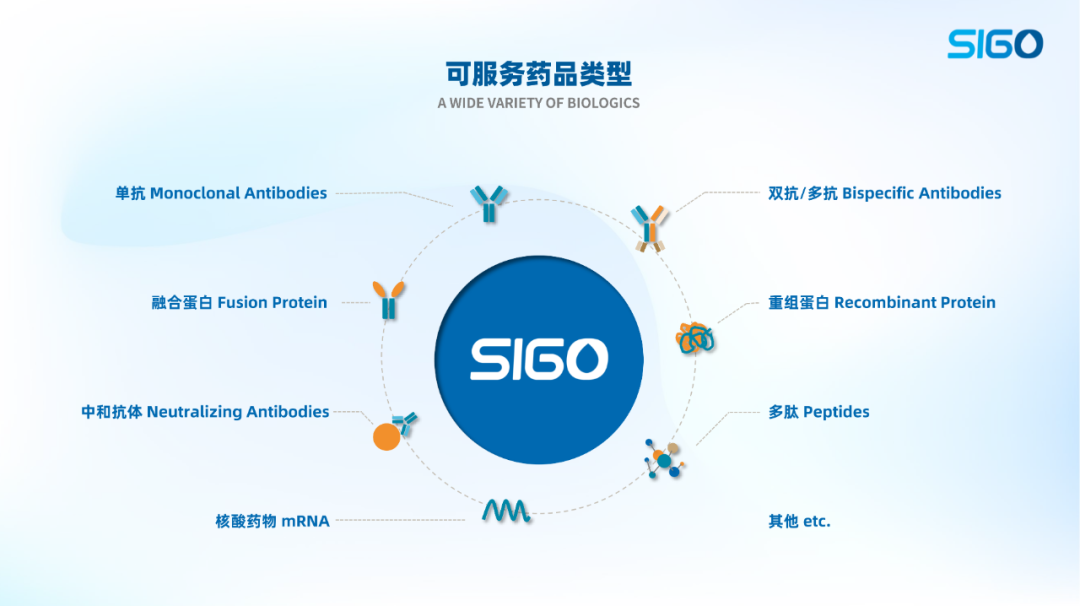
晟国医药拥有卓越的生物药研发和生产技术平台,具备超大规模原液、制剂开发生产经验,自主知识产权的培养基和填料,可服务产品包括单抗、双抗、多抗、融合蛋白、重组蛋白、中和抗体、多肽、核酸药物等,可为客户提供涵盖抗体工程、稳定细胞系建立、工艺开发、制剂配方开发、质量研究、中试生产和灌装、注册申报等,从DNA到IND再到NDA的全流程一站式服务。
- 2.复宏汉霖,安腾瑞霖(ATON)
自2010年成立以来,复宏汉霖已建成一体化生物制药平台,高效及创新的自主核心能力贯穿研发、生产及商业运营全产业链。公司已建立完善高效的全球创新中心,按照国际药品生产质量管理规范(GMP)标准进行生产和质量管控,不断夯实一体化综合生产平台,其中,上海徐汇基地已获得中国和欧盟药品GMP认证,松江基地(一)也已获得中国GMP认证。安腾瑞霖(ATON)是复宏汉霖旗下独立的CDMO版块。

- 3.创胜集团,差异化合并CDMO

奕安济世具有丰富的细胞系开发、工艺开发、临床样品生产及放行、IND/BLA申报的全流程经验。奕安济世在杭州拥有工艺开发中心及 符合cGMP 标准的原液及成品生产车间,通过技术的不断创新及稳定的连续化生产工艺,可极大缩短工艺开发进程和降低生产成本,为生物药创新合作伙伴提供优质、可靠、快速的 CDMO服务。公司已于2022年4月13日顺利通过欧盟质量受权人审计,QP认证声明已于2022年4月21日签发。
- 4.信达生物 ,夏尔巴生物
2022年5月24日,夏尔巴生物技术(杭州)有限公司正式成立。信达生物旗下独立的CDMO版块。

夏尔巴生物专注于提供抗体、融合蛋白、基因治疗、细胞治疗等药物的开发和商业化生产,致力于“帮助优质客户开发出全球老百姓用得起的高质量生物药”。公司已组建了一支具有丰富经验的国际化人才团队,包括众多海归专家;并助力完成了7个产品在国内外上市,满足100多万病人的用药需求,是中国提供商业化生产最多的CDMO公司。目前,夏尔巴生物在苏州已有总计60,000升的产能,生产线的建设标准,同时符合NMPA、FDA和EMA的GMP要求。预计2023年,商业化生产基地产能总计将达230,000升。夏尔巴生物致力于为优质客户提供优质的技术服务,为其提供一站式解决方案,协助客户的创新成果实现商业化,惠及更多患者。“利他以恒,匠心致远”, 协助客户实现共赢,帮助优质客户开发出全球老百姓用得起的高质量生物药,是夏尔巴生物的理想和目标。
- 5.东曜药业,CDMO布局
东曜药业成立于2010年,见证了生物药产业的蓬勃发展,也深知差异化的创新才是发展的关键。与众多药企不同,东曜药业早前就瞄准了具有较高难度的ADC,并在ADC领域深耕多年,不论在产品研发还是商业化产能布局,在国内都位于前列。凭借丰富的实践经验和成熟的平台体系,东曜药业为ADC研发和生产提供一站式CDMO解决方案。
ADC药物是大分子抗体药物和小分子化学药物的结合,兼具两者的复杂性和多样性,在CMC相关的生产及质量控制方面都有诸多挑战;同时,叠加体内作用机制和代谢过程的复杂性,使得非临床、临床研究也同临挑战。

凭借多年ADC药物开发的经验积累,东曜药业已搭建了从药品研发、中试工艺、临床生产到商业化生产的完整产业平台。同时,东曜药业积极布局ADC商业化产能建设,拥有符合GMP标准的ADC中试及商业化生产车间,设计年产能达60,000g,在园区基地就可完成ADC药物的生产。药融云数据(https://www.pharnexcloud.com/?zmt-mhwz)显示:2021年,公司CDMO业务实现营收5369万。

- 6.君实生物,潜在CDMO布局
公司位于临港新片区内的生产基地占地80亩,总建筑面积70,000平米,一期项目生产规模达30,000升,严格按照国际药品生产质量管理(cGMP)进行建造。

- 7.其他CGT CDMO也正在兴起
起源于Biotech公司如:希济生物、行诚生物、浦珠生物等等。
相关阅读:
《CXO赛道:维亚生物稳控CRO基本盘,再打+CDMO组合拳》
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据,https://www.pharnexcloud.com/?zmt-mhwz;
FDA/EMA;
相关公司公开披露;
TOTBIOPHARM;
www.sigobio.com;
www.Henlius.com;
安腾瑞霖(上海)生物科技有限公司,https://e2.sthj.sh.gov.cn/jsxmxxgk/eiareport/action/jsxm_eiaReportDetail.do?from=jsxm&stEiaId=81bf335a-fc4e-44aa-be9e-edd52d4da6b1&type=%E6%8A%A5%E5%91%8A%E4%B9%A6;
信达生物,Altruist Biotechnology;
君实生物临港生产基地有序推进复工复产,已投入商业化生产;等等。
想要解锁更多药企信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息;投融资情况;最新动态;产品布局、药物基本信息、研进展、临床试验信息、市场规模与前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论