
2007年,22岁的Vivek Ramaswamy(以下简称“Ramaswamy”)加入对冲基金QVT Financial,成为生物医药方向投资人。彼时的他,还是初创公司Campus Venture Network的总裁。一边投资,一边创业,一边读书,对于这位毕业于哈佛大学生物学专业的高材生来说,或许并不是难事。在成功出售Campus Venture Network公司的同时,Ramaswamy又成功投资了多家丙肝药公司。单是投资研发出丙肝上市新药Sofosbuvir的Pharmasset公司这一笔交易,就让他在投资界声名鹊起。
此外,他还边工作边读完了耶鲁大学法学博士,顺便领了奖学金。在QVT Financial做投资时,Ramaswamy发现很多大公司会因各种原因放弃的在研药物候选分子,而这些药物本身有潜在的广阔的前景。“为什么不接盘大公司放弃的药物继续研发呢?”Ramaswamy再次燃起创业的想法。2014年,他将这一想法落地,创立了生物技术公司Valor Biotechnology,也就是现在的Roivant Sciences。

在成立Roivant时,Ramaswamy还从前东家QVT Financial及几家投资机构那里募得了1亿美元。就这样,Ramaswamy揣着1亿美元开始缔造自己的“商业帝国”。Ramaswamy看上的第一款药是葛兰素史克的Intepirdine(RVT-101),这是一款用于治疗阿尔茨海默症(AD)的药物。要知道,2014年前后可是众多大公司在阿尔茨海默病药物研发上折戟的时代。
前有强生/辉瑞的Bapineuzumab临床III期试验在2012年惨遭失败,超4亿美元“打水漂”;后有罗氏在2014年宣布放弃单抗药物Gantenerumab,26亿美元心血付之东流。面对这样的残酷现状,虽然Intepirdine在II期临床试验中显示出一些初步疗效,但葛兰素史克还是选择了放弃这款药。此时的Ramaswamy却看好Intepirdine的未来,所以他通过Roivant的第一个全资子公司Axovant Sciences,花了500万美元买下了Intepirdine。
后来不到半年时间,Axovant公司又在2015年5月引进了Arena制药公司用于治疗失眠症的药物Nelotanserin。这款药在临床试验中被证明有效并有良好的耐受性,但由于未达到试验有效性终点,所以在2008年被Arena制药放弃。而Axovant则花了400万美元购得了此药开发权,并启动了针对路易体(DLB)疾病和帕金森病的中期试验。
凭借着两款有希望“变废为宝”的药物、低成本的投入以及Ramaswamy对资本市场的熟悉,Axovant在成立不到一年的时间内便完成了上市。IPO当日,Axovant公司成功融资3.15亿美元,成为当年估值最高的生物科技公司。
就这样,一位29岁的CEO加上7位员工,在没有一款药物上市的情况下打造了一个市值超30亿美元的上市公司,也演绎了一场美国医药造富神话。
高瞻远瞩,旨在打造“Vant帝国”
Roivant Sciences(以下简称“Roivant”)由Vivek Ramaswamy创立于2014年,总部位于瑞士西北部城市巴塞尔。2021年10月,Roivant在纳斯达克上市。2022年11月15日,收盘价$5.16/股,市值$37.43亿。
Roivant采用Hub-and-spoke/中心辐射的模式进行业务版图的构建,以创建公司所描述的“研发中的新型产业组织形式”。Roivant旗下的每个生物制药子公司都作为一个独立的实体运营,以保留初创公司的敏捷灵活性和创新创业精神;同时,每个子公司都可以利用和共享来自母公司和其他由数据驱动的子公司的资源来支持其相关药物的开发和商业化。(Altavant、Enzyvant、Myovant、Spirovant和Urovant于2019年12月转让给日本住友制药旗下子公司Sumitovant)
hub and spoke R&D model
Roivant旨在成为一家为数十家生物制药公司提供服务的大型控股公司,以建立一个“Vant帝国”(Ramaswamy创建的所有公司名后缀均为“vant”)——实现每个子公司都能专注不同疾病领域药物的研发且同时发展先进技术以加速药物的研发进程,提升新药的研发效率。
药融云数据,vip.pharnexcloud.com/?zmt-mhwz显示,Hub-and-spoke(或者Portfolio Model):过去几年,美国医药市场的模式之一。对单个新药项目成立子公司,以便新药资产的管理与流动。母公司可为子公司在成立初期提供专业技术、研发资源和临床运营等支持,助其快速灵活的创造价值。积极抓住子公司新药资产的license-out合作或出售等机会;做出大药厂感兴趣的资产,不失为一种选择 。
自2014年成立以来,Roivant通过自主创建/收购合并了21家子公司,其中4家已成功上市,5家被日本住友制药收购;投入开发了40多种涵盖广泛疾病领域的药物管线,开展了8项积极的药物临床III期研究,其中有3款药物已经获得FDA的批准。其知名开发合作伙伴包括武田、默克、葛兰素史克、阿斯利康、卫材、福泰制药、第一三共等。
旗舰产品VTAMA®:
首个治疗银屑病的外用新型化学药
据药融云数据库显示,Dermavant于2019年在中国市场首次面世,中文名本维莫德,由广东中昊药业授权生产销售。2022年5月24日,Dermavant公司宣布FDA已批准VTAMA®(tapinarof)用于局部治疗轻度、中度和重度斑块型银屑病。这一批准使VTAMA®乳膏成为25年多来在美国推出的第一个治疗银屑病的外用新型化学药。
Dermavant银屑症各国研发现状(部分)
截图来源:药融云全球药物研发数据库
VTAMA®是一种新型的、每日一次的、不含类固醇的外用乳膏。在长达52周的VTAMA®临床研究中显示,大概使用4个月可中度缓解银屑病症状,且改善效果持久,目前没有出现过在治疗期间出现疗法失效的情况。

VTAMA®乳膏的设计易于使用,不油腻,无异味。VTAMA直接靶向皮肤稳态和炎症的关键调节因子AHR,以帮助减少Th17和Th2细胞因子,这两种促炎途径分别涉及斑块型银屑病和特应性皮炎,增加抗氧化活性,并促进皮肤屏障恢复。
另外,Dermavant还在开发用于治疗成人和儿童特应性皮炎的VTAMA®,预计将于年上半年发布其3期临床试验的结果。Dermavant的早期阶段开发管道包括一种新的芳基烃受体(“AhR”)激动剂DMVT-506,其概况与VTAMA®相似。Dermavant正在开发DMVT-506,用于治疗免疫和炎症疾病。
Dermavant在中国正在进行的临床试验
截图来源:药融云中国临床试验数据库
关于银屑病和特应性皮炎
银屑病是一种慢性炎症性疾病,其皮肤病变的特征是带有银色鳞屑的红色斑块和斑块,在美国,大约有800万人受到影响。其最常见的形式是寻常型银屑病或斑块型银屑病,约占所有银屑病病例的80%至90%。银屑病的严重程度通常根据体表面积(“BSA”)的受累程度来分类:轻度(小于3%BSA)、中度(3%至10%BSA)和重度(大于10%BSA的)。根据这一分类,美国大约80%的银屑病患者患有轻度至中度疾病,这通常适用于局部治疗。
特应性皮炎是最常见的湿疹类型,在美国有超过960万儿童和约1650万成人受到影响。这是一种慢性疾病,其特征是皮肤干燥、发痒,通常会变成红色皮疹。特应性皮炎可以在数年或一生中反复出现,并可与其他类型的湿疹重叠。特应性皮炎具有复杂的病理生理学,涉及遗传、免疫和环境因素,最终导致皮肤屏障功能障碍和免疫系统失调。这种情况最常发生在儿童身上(全世界为15%至30%)。大约60%的特应性皮炎患者在出生后第一年出现症状,高达90%的患者在5岁时出现症状。虽然在婴儿期和青春期更为普遍,但十分之一的人会患上特应性皮炎。大约89%的成人患者患有轻度至中度特应性皮炎,而11%的患者患有重度特应性皮炎。
VTAMA®拥有广阔市场
鉴于与TCS、其他外用药、口服药和生物制剂疗法相关的局限性,VTAMA这样的新型每日局部治疗的药物的推出,可满足患者对斑块型银屑病和特应性皮炎的长期治疗选择的需求。VTAMA®有潜力作为生物制剂和口服疗法的补充疗法。
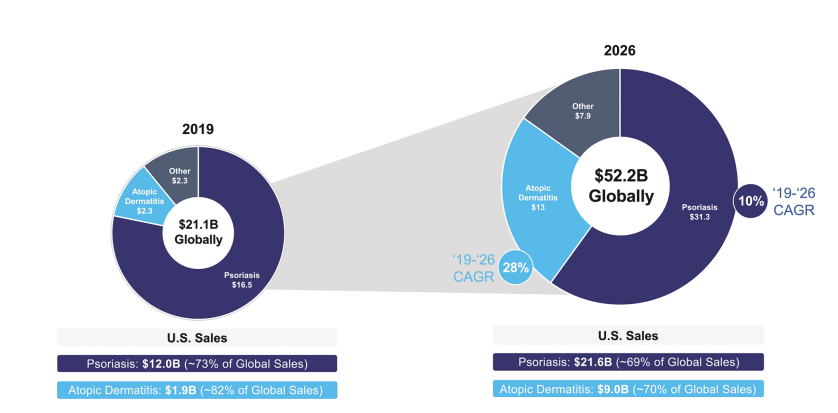
银屑病和特应性皮炎是免疫皮肤病学的两个最大市场,预计到2026年,其在美国的总销售额将达到约310亿美元,在全球的总销售额将达到440亿美元。局部治疗是皮肤病治疗的基础,占2020年美国皮肤科医生处方的83%。
产品自发布以来收益状况
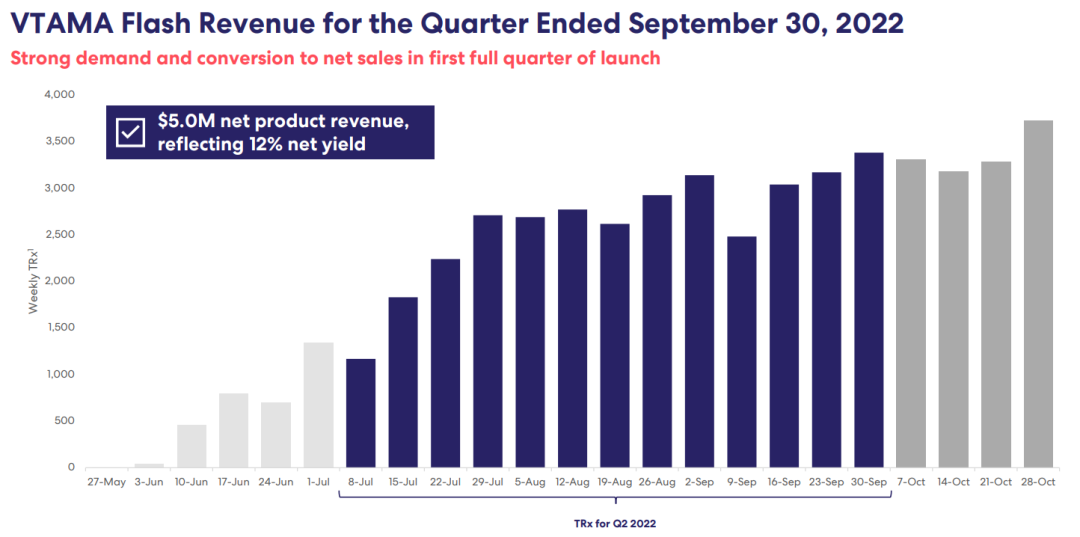
自5月发布以来,截至2022年9月30日,VTAMA®产品净收入为500万美元,净收益率为12%。
财务状况
一、2021年财报
2022年6月28日,Roivant发布公司2021年年度报告(2021年财政年度时间段为2021年4月1日~2022年3月31日)。
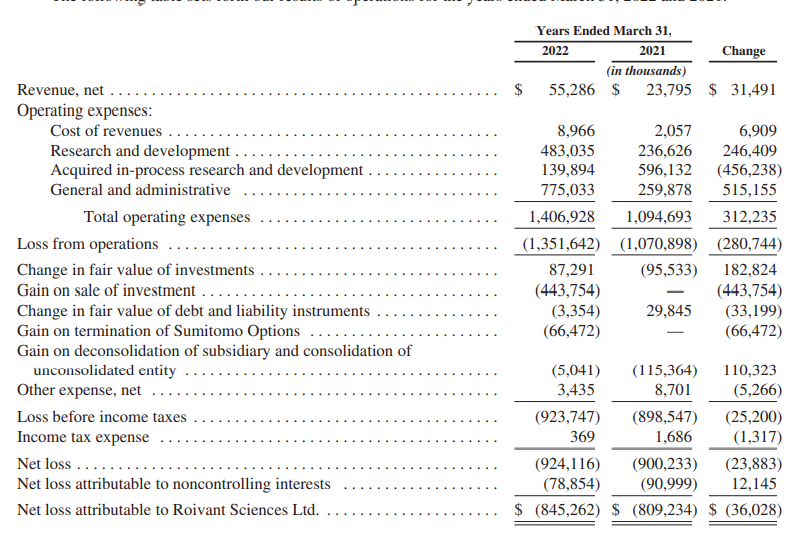
2021年度,该公司净收入增加了3150万美元,达到5530万美元。这一增长主要与收到与许可协议和技术许可有关的付款有关。此外,公司确认了与临床产品销售有关的收入,以及Dermavant公司的里程碑收入。
2021年度该公司未从销售候选产品中获得任何收入,收入主要来自确认收到的与许可协议有关的预付款,还包括一些订阅费和服务费。随着FDA于2022年5月批准VTAMA®乳膏用于治疗成年斑块型银屑病患者,公司在首次推出产品后开始确认产品收入成本。
收入成本增加$690万至$900万,主要涉及因使用开发的技术而确认的订阅和基于服务的收入,主要包括员工、托管和第三方数据成本。2021年度净亏损金额为$9.24亿,2020年度,净亏损为$9.002亿。截至2022年3月31日,该公司现金和现金等价物约为21亿美元,累计赤字约为28亿美元。
研究与开发投入:
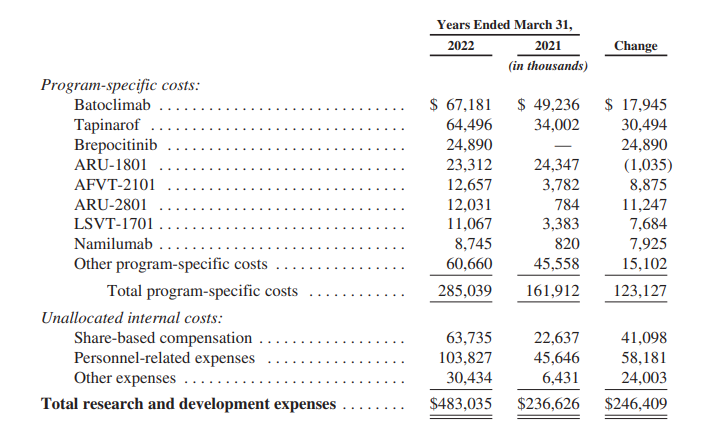
2021年度的研发费用为$4.83亿,与2020年度的研发费用$2.37亿相比增加了$2.46亿。主要是由于特定项目成本增加了$1.23亿,人事相关费用增加了$5820万,股权报酬增加了$4110万。
二、2022年一季度报告
2022年8月15日,Roivant发布2022年第一季度报告。(2022年4月1日~2022年6月30日)2022年第二季度净收入$431.9万,去年同时期公司净收入$773.5万,同比降低44.16%。公司今年第一季度研发费用为$1.36亿,去年同时期研发费用为$7852万,同比增长73.00%。

三、最新财务状况
药融云数据,www.pharnexcloud.com显示:截至2022年9月30日,Roivant拥有现金、现金等价物和限定用途现金约16亿美元。加上2022年10月Immunovant后续预期收益7500万美元,以及因Myovant被SumitomoPharma收购产生的1.15亿美元收益,公司的现金、现金等价物和限定用途现金约为18亿美元。Roivant称其资金储备将足以满足公司至2025年下半年的运营费用和资本支出需求。
产品研发管线
截至2022年11月7日,Roivant产品研发管线进展情况:
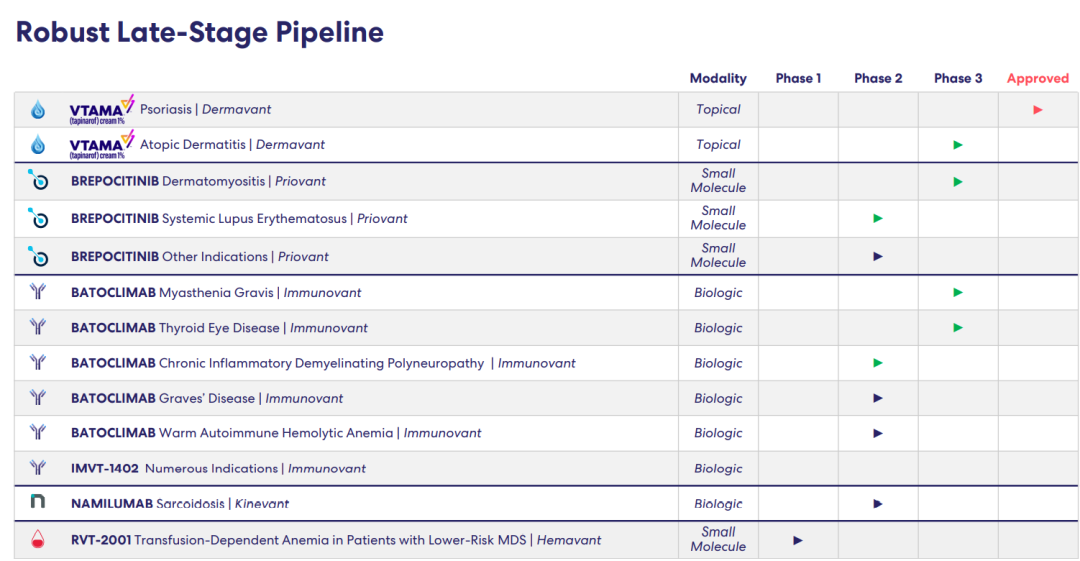
为实现成本优化,Roivant实施了管线优先级重新排序计划,以减少预期运营费用并保留资本资源。公司已经停止了几个项目的开发,包括Aru-1801、LSVT-1701、DMVT-502、DMVT-503、DMCVT-504和CVT-TCR-01,以便将资本集中在管线中潜在的最有价值和最有意义的产品上,包括新推出的Priovant项目。
关于Priovant项目
药融云数据显示:2022年6月28日,Pfizer(辉瑞)和Roivant宣布,两家公司共同创建的PriovantTherapeutics(简称“Priovant”),一家致力于开发和商业化治疗自身免疫性疾病新疗法的公司,正在进行brepocitinib治疗皮肌炎和狼疮的注册研究,目前上述领域几乎没有获批的疗法。Priovant成立于2021年9月,辉瑞公司授予Priovant口服和外用brepocitinib全球开发权以及美国和日本的商业权利,并持有Priovant25%的股权。
brepocitinib药物基本信息
截图来源:药融云全球药物研发数据库
Brepocitinib(PF-06700841)是一种first-in-class的口服酪氨酸激酶2(TYK2/JAK1)选择性抑制剂,TYK2/JAK1双重抑制可能比单独抑制其中一种提供更好的疗效。JAK是一类非受体型酪氨酸激酶,包括JAK1,JAK2,JAK3,和Tyk2四个成员。从20世纪90年代初首个JAK激酶被发现,到2012年第一种JAK抑制剂(托法替布)被批准用于类风湿性关节炎(RA)的治疗,针对JAK抑制剂在自身免疫性疾病的开发始终是热点。JAK在包括造血细胞、淋巴细胞在内的多种类型细胞的分化、增殖和存活中起着重要作用,由于现有的大多数非选择性JAK抑制剂均对JAK2有抑制作用,且容易产生贫血等较大的毒副作用。新一代JAK抑制剂的设计原则是提高对特定JAK亚型的选择性,避免由于抑制JAK2带来的毒副作用,在保持药物对特定疾病疗效的同时降低不良反应。

Brepocitinib已经在五项已完成的对照2期研究中对免疫性疾病(银屑病关节炎、斑块状银屑病、溃疡性结肠炎、脱发症和化脓性皮炎)进行了评估。在所有这五项研究中,使用布雷博西尼治疗与统计学上显著的和有临床意义的疗效有关。
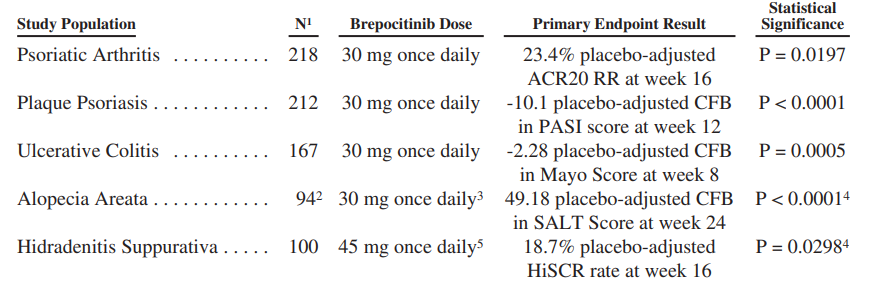
Brepocitinib目前正在对中度至重度活动性系统性红斑狼疮患者进行一项大型随机对照2B期研究的评估。这项研究将总共招募约350名受试者,并将评估15毫克、30毫克和45毫克的布雷博西尼与安慰剂相比的效果,频率每天一次。这项研究的主要目的是得到系统性红斑狼疮反应者指数("SRI-4"),这是一个有效的系统性红斑狼疮改善指数,将在第52周得出结果。Priovant公司预计将在2023年下半年收到这项研究的顶线结果。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据,vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露;
https://www.roivant.com/;
https://www.vtama.com/about/what-is-vtama/;
http://www.rrrry.com/art_52576.htm;
http://k.sina.com.cn/article_5334569296_13df71150001019d6m.html;
https://investor.roivant.com/static-files/d947112d-63e0-467c-90ed-439ac20e6393;
https://investor.roivant.com/static-files/d86da666-36ec-4888-8241-e66731df0ab7;
https://investor.Roivant.com/static-files/81aa0aba-a2d5-4832-a4b8-1df993d4f985;等等。
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发信息、仿制药布局情况、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>




















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论