
据药融云统计,截至目前,国内一共有三款小分子新冠口服药上市,分别是2022年2月11日批准的Paxlovid(奈玛特韦片/利托那韦片组合包装),2022年7月25日获批的阿兹夫定片,以及2022年12月30日应急附条件批准的莫诺拉韦胶囊(商品名称:利卓瑞/LAGEVRIO)。
2023年1月8日,国家医保局发布消息,由国家医保局医药管理司负责人介绍了新冠治疗药品参与2022年医保药品目录谈判有关情况。其中,阿兹夫定片、清肺排毒颗粒谈判成功,Paxlovid因生产企业辉瑞投资有限公司报价高未能成功(《新冠治疗药品医保谈判!2款成功,Paxlovid因报价高未能成功》)。

截图来源:国家医疗保障局
一、被炒疯的新冠“特效药”——Paxlovid(奈玛特韦片/利托那韦片组合包装)
2021年11月,辉瑞的抗病毒口服新药Paxlovid面世,因其临床试验结果惊艳,获得美国食品药品监督管理局(FDA)紧急授权使用。2022年2月12日,中国国家药监局按照药品特别审批程序,应急审评审批,批准辉瑞公司Paxlovid的进口注册。作为第一款在国内上市的新冠口服药,该药被冠以“特效药”之名,寄托了许多人结束新冠疫情的希望(不排除炒作嫌疑)。值得澄清的是,Paxlovid并非真正意义上的“特效药”,最多是特定人群或特定条件下可以使用的某类有效药物。
Paxlovid是由利托那韦(Ritonavir)和奈玛特韦(Nirmatrelvir)组成的复合药。两个药物合力抑制病毒复制,减轻病症的发展和恶化,在患者降低住院率和死亡率方面有着非常不错的效果。Paxlovid在国内批准上市后,一度被炒至数万元一盒的天价。Paxlovid的医保支付价格目前已经从2300元/盒降低至1890元/盒。虽然此次医保谈判失败,但随着之后国产同类靶点新冠口服药上市,该药价格有望降低。
临床疗效得到充分验证
2021年11月5日,辉瑞发布了一项研究,宣称在第二和第三期EPIC-HR(指对高危患者的新冠肺炎的蛋白酶抑制进行评估)临床试验的中期分析中,新型抗新冠口服药Paxlovid将住院或死亡风险降低了89%。此前,顶级期刊《柳叶刀》发布了Paxlovid新冠口服药治疗中国香港奥密克戎感染者的真实研究,研究结果表明,早期使用Paxlovid能有效降低老年患者住院率与死亡率,并减少住院后的疾病进展与死亡风险。上海仁济医院也曾开展相关研究,研究发现,与延迟使用Paxlovid治疗的患者相比,在诊断后5天之内就开始使用Paxlovid的免疫抑制患者,病毒清除时间可以提早约6天。
在2022年10月发表于《柳叶刀》的一项临床研究中,研究团队使用了来自香港医院管理局的数据,以确定在2022年2月26日至6月26日期间被诊断为SARS-CoV-2感染的未住院患者患者,共计1074856人,在此期间,奥密克戎亚型BA.2.2在香港占主导地位。结果显示,在香港的奥密克戎亚型BA.2.2暴发期间,在非住院COVID-19患者早期使用Molnupiravir或Paxlovid治疗,与死亡风险降低和住院后疾病进展风险降低显著相关,Paxlovid治疗还与住院风险降低显著相关。
局限性也明显
2022年6月15日,辉瑞在官网发布公告,新冠口服药Paxlovid一项名为EPIC-SR的II/III期临床研究失败。EPIC-SR是一项评估针对未接种疫苗的成年人、具有一种或多种进展为重症疾病风险因素的已接种疫苗成年人的研究。简单来说,就是对于一般风险人群的研究。由于在标准风险患者群体中观察到的住院率或死亡率非常低,辉瑞决定停止EPIC-SR临床试验。Paxlovid能够显著降低65岁及以上的老年人的住院风险(降低73%)或死亡风险(降低79%),但在更年轻的人群中没有明显帮助。
临床试验中Paxlovid常见不良反应包括味觉改变、腹泻、高血压、肌肉疼痛、腹痛、恶心等,用药组的不良反应低于安慰剂组。该药对肝肾功能会有影响,不建议患有严重肝病和肾病的患者服用。由于Paxlovid会影响很多药物的代谢,所以Paxlovid需要避免和某些药物同时使,服用该药需要严格遵循医嘱,详细参考药品说明书和药物相互作用详细资料。
二、首个国产小分子新冠口服药——阿兹夫定
2022年7月25日,国家药监局根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准河南真实生物科技有限公司阿兹夫定增加治疗新冠病毒肺炎适应症注册申请。
河南真实生物科技有限公司自主研发的阿兹夫定本是一款抗艾滋药物,在2021年7月20日,国家药监局已附条件批准本品与其他逆转录酶抑制剂联用治疗高病毒载量的成年HIV-1感染患者。此次为附条件批准新增适应症,用于治疗普通型新型冠状病毒肺炎(COVID-19)成年患者,成为国产的首个新冠口服药。
早先公布的临床结果
关键Ⅲ期注册临床试验,是采用多中心、随机、双盲、安慰剂对照的临床试验设计,临床试验结果显示:
(1)显著改善临床症状:阿兹夫定片可以显著缩短中度的新型冠状病毒感染肺炎患者症状改善时间,提高临床症状改善的患者比例,达到临床优效结果。首次给药后第7天临床症状改善的受试者比例阿兹夫定组40.43%,安慰剂组10.87%(P值<0.001),受试者临床症状改善的中位时间阿兹夫定组与安慰剂组有极显著统计学差异(P值<0.001)。
(2)抑制新冠病毒作用:阿兹夫定具有抑制新冠病毒的活性,病毒清除时间为5天左右。
(3)安全性方面:阿兹夫定片总体耐受性良好,不良事件发生率阿兹夫定组与安慰剂组无统计学差异,未增加受试者风险。
值得注意的是,阿兹夫定作为新冠口服药,并不具有预防新冠的效果,仅用于治疗普通型新冠感染成年患者;同时,根据此前CDE发布的阿兹夫定片审评报告,阿兹夫定片存在一定用药风险,根据过往动物试验结果显示,阿兹夫定具有高药物浓度下的遗传毒性和生殖毒性。阿兹夫定目前国内定价270-330元1瓶,与Paxlovid相比,价格比较低廉。
三、全球首个上市新冠口服药——莫诺拉韦(Molnupiravir)
默沙东的莫诺拉韦(Molnupiravir)是全球首个获批上市的新冠口服药(口服小分子新型冠状病毒肺炎特效药),是一种高效核糖核苷类似物的口服生物可利用形式。
2021年11月4日,英国药品和保健产品监管局(MHRA)批准Molnupiravir上市,用于治疗重症和住院风险较高的轻至中症新冠肺炎(COVID-19)成人患者。2021年12月23日,Molnupiravir获得FDA紧急使用授权,用于治疗新型冠状病毒(SARS-CoV-2)检测为阳性,且有较高风险发展为重症的轻症或中症新冠肺炎(COVID-19)成年患者。2022年12月29日,中国国家药监局根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准默沙东公司新冠病毒治疗药物莫诺拉韦胶囊(商品名称:利卓瑞/LAGEVRIO)进口注册。
临床数据
在一项III期MOVe-OUT临床试验(NCT04575597)中,共有1433例轻症或中症新冠肺炎成年患者(18岁及以上)被随机1:1接受800 mg Molnupiravir或安慰剂治疗。在基线时,所有随机受试者的中位年龄为43岁;17%的受试者年龄在60岁以上,3%的受试者年龄在75岁或以上;49%为男性。48%的受试者在COVID-19症状出现3天内接受了Molnupiravir或安慰剂。最常见的危险因素是肥胖(74%)、60岁以上(17%)和糖尿病(16%)。在792例具有可用基线SARS-CoV-2变体/分支鉴定结果的受试者中(占随机总人群的55%),58%的人感染了德尔塔(Delta)病毒、20%感染Mu变异毒株、11%的人感染了Gamma毒株,其余感染了其他变异/进化支。
试验的主要终点是在第29天因任何原因住院或死亡的患者百分比结果。有效性结果基于18岁及以上未接种疫苗的成年人,并具有一种或多种预先定义的疾病进展危险因素:60岁以上、糖尿病、肥胖(BMI≥30)、慢性肾病、严重心脏病、慢性阻塞性肺疾病或活动性癌症。试验结果显示,该新冠口服药治疗组VS安慰剂治疗组的第29天因任何原因住院或死亡的患者百分比为6.8%VS 9.7%。此外,在29天的随访中,全因死亡率为0.1%VS 1.3%。
总结来说,数据显示Molnupiravir可以将患者的住院或死亡风险降低约30%。但是随着对该新冠口服药临床研究的不断加深,也伴随了更多争议。2022年12月22日,英国牛津大学在《柳叶刀》上发表论文,报道一项在英国奥密克戎感染期间的莫诺拉韦临床数据,证明莫诺拉韦不能降低新冠相关的住院和死亡!不过,试验还是发现了莫诺拉韦的有益的次要目标:与对照组相比,接受莫诺拉韦治疗的患者恢复得更快。
默沙东曾在2022年10月6日发布消息,针对具有疫苗高接种率,且年龄大多数小于65岁的人群,常规治疗加莫诺拉韦与常规治疗对比,截至第28天在降低住院率和死亡率方面没有统计学差异,没有达到主要终点。
2022年11月,默沙东与国药控股分销中心有限公司就莫诺拉韦在中国的进口和经销事宜签署经销协议。此外,该药在国内的商业化定价还没有确定,其在美国市场是700美元一个疗程,高于辉瑞新冠口服药的政府采购价(每疗程约530美元)。
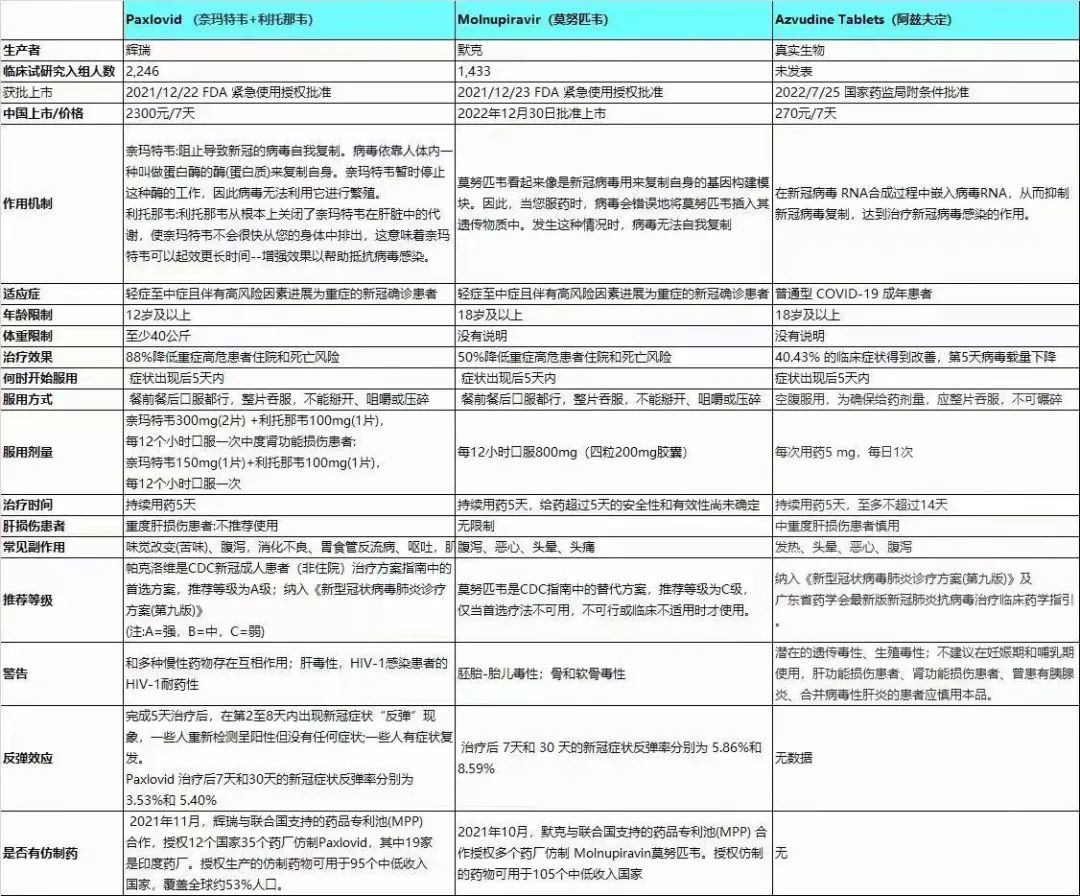
数据总结
四、结语
目前国内新冠疫情正处于高峰期,新冠口服药的陆续上市为抗击疫情增添了许多保障。除了真实生物之外,一批国内制药企业纷纷开展了新冠口服药的研发,包括君实生物、先声药业、众生药业、广生堂、前沿生物、海正药业等。其中君实生物的VV116的三期数据登上NEJM,疗效不劣于Paxlovid,给该药上市增加更多可能性。期待国内能有更多安全有效对抗新冠的药物上市,为广大民众的生命健康保驾护航。
参考来源:
[1] NMPA官网
[2] 相关公司官网
[3] 药融云数据库
想要解锁更多疾病领域药物信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握相关疾病涉及药物情况、已上市药物、销售情况与各维度分析、市场竞争格局、审评审批情况、最新进展、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

—END—



















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论