
在经历了PD-1“内卷”、创新药靶点同质化时期、创新药“寒冬”后,创新药企在二级市场的消极情绪迅速被传导至一级市场。多位投资界人士承认,至少2021年四季度以来,某些知名美元基金暂时对中国创新药投资“躺平”。那些在疫情期间融了B轮、C轮的创新药企正要走向IPO,有些突然就在资本市场上“失宠”。
“越是后端的项目越艰难。”据企查查数据,2022年我国药物研发领域一级市场的投融资事件数量为290起,主要集中在A++轮之前(184起),占事件总数比例高达63%。并且随着轮次上升,投融资事件数量递减,分别为64、28、13、1。没错,D轮及以后的事件仅14起,占比只有4.8%。
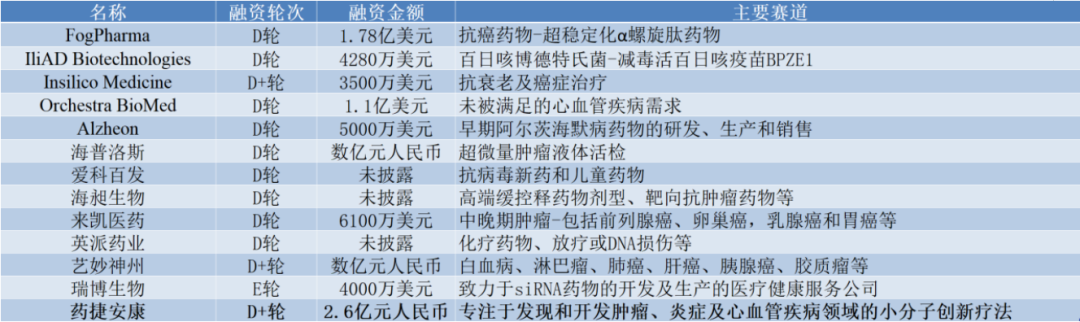
2022年药物研发领域一级市场发生D轮及以后轮次融资的企业
具体来看,14起投融资事件涉及的12家药企细分属性都很强,显然到了后期还能融到资的药企,已经不再迷恋过去me-too类同质化打法。当大潮褪去,才知道谁在裸泳,如今的创新药行业亟需更加差异化、真正创新的产品出现,才能吸引资本为其买单,药捷安康顺利的D+轮融资无疑再次证实了这一点。
据药融圈旗下药融云数据库显示,近日,药捷安康披露完成2.6亿元人民币D+轮融资,该轮融资由国鑫投资领投,三一创新投资、国联金投启源、南京江北国资、中银资本、百益德投资、瑞桐创投、敦行资本跟投。
药捷安康融资情况
截图来源:药融云投融资数据库
穿越寒冬的药捷安康,现如今之所以成为资本宠儿,与公司具有竞争力的创新技术平台和长期经验积累息息相关。在创新药平台基础上,公司能够源源不断地创造差异化管线,特别是其首个重点品种,吸引了投资界人士的关注。
一、Tinengotinib:差异化产品造就小分子药物领跑者,覆盖多个肿瘤潜在市场
药捷安康专注于发现及开发肿瘤、炎症及心血管疾病小分子创新疗法,布局于高度差异化的肿瘤与非肿瘤领域。通过多年小分子核心技术平台的积累,药捷安康以中国及全球临床研究为动力引擎,成为根植于中国的国际化创新药孵化平台。根据公开资料显示,药捷安康共有7款处于全球不同临床研发阶段的产品,其中Tinengotinib(TT-00420)、TT-01688、TT-01488、TT-00973及TT-01025等小分子产品均表现亮眼。
药捷安康产品管线(临床期)
截图来源:药融云全球药物研发数据库
尤其是其首个重点品种Tinengotinib,是一款全球首创、细分市场唯一的MTK激酶抑制剂,可精准靶向具有生物标记物的泛肿瘤,也能通过多个靶点的协同作用,治疗更广泛的复发性或难治性的肿瘤,目前在中美两地已有针对多个肿瘤的多项临床正在或者即将开展。经药融云全球药物研发数据库查询,目前Tinengotinib针对胆管癌、转移性乳腺癌、胆囊肿瘤、胆道癌、转移性膀胱癌、小细胞肺癌等适应症的临床试验已推进到2期阶段。
Tinengotinib适应症研发现状(部分)
截图来源:药融云全球药物研发数据库
Tinengotinib基于其与FGFR2独特的结合方式,使得该化合物能够克服胆管癌患者的FGFR获得性耐药和原发耐药。进一步研究表明,其对于FGFR1及FGFR3变异(也包括可能的耐药突变位点有效),由此为相关突变的多种实体瘤都带来了治疗希望。
公司以FGFR抑制剂经治耐药的胆管癌(CCA)为全球进展最快的第一适应症。根据Frost&Sullivan报告,2021年全球CCA新发病人数超过26万人(2017年至2021年年复合增长率达3.6%),其中存在FGFR突变的患者比例高达25.2%。FGFR作为目前“不限癌种”疗法聚焦的热门靶点之一,带来了富有想象的巨大的泛肿瘤市场。据了解,FGFR畸变在实体瘤患者中普遍存在,约占全部实体瘤患者的7.1%。在此基础上,有机构预测,全球泛FGFR抑制剂市场规模将于2035年增至215亿美元。但目前在全球能够克服FGFR抑制剂经治耐药的市场尚存巨大空白,FGFR信号通路的抑制容易产生多基因突变,新一代FGFR药物必须同时对所有突变有效,因此药物开发难度指数级增加,而Tinengotinib抑制多基因突变的性质,对有效性和克服耐药性展现了其独特性的价值,正在细分赛道全球领跑。
此外,Tinengotinib作为激酶抑制剂,选择性地抑制与肿瘤密切相关的靶点通路,从而起到协同作用,使其在许多末线、且高度异质性的肿瘤方面展现出独特的治疗潜力,如转移性去势抵抗前列腺癌(mCRPC)、转移性Her2阴性乳腺癌等,使其适应症扩展至除FGFR以外的多个百亿级市场。
据悉,Tinengotinib目前正在美国、中国同步开展II期临床试验,根据Frost&Sullivan的资料,与多数其他国内Biotech不同,药捷安康是中国致力于创新小分子的开发者中最早建立全球研发与临床开发平台的公司之一。
2022年,公司先后在ASCO、ESMO、AACR等国际学术会议上发布Tinengotinib的临床II期、临床I期、临床前亮眼的研究数据;并在百份入选ASCO的壁报中脱颖而出,进入壁报讨论(poster discussion)环节。在刚刚结束的ASCO GI会议上,公司公布了精准针对FGFR经治耐药病人的初步有效性数据吸引了业内专家关注。
此外,Tinengotinib还分别在2019年及2021年获得了FDA授予的用于治疗胆管癌的“孤儿药认证”(ODD)及“快速通道资格认证”(FTD)。“孤儿药”即用于预防、治疗、诊断罕见病的药品,罕见病患病人群少、市场需求少、研发成本高,很少有制药企业关注其治疗药物的研发。根据FDA规定,一旦被认证为孤儿药,药品可加速审批上市,且在该适应症上可享受为期7年的市场独占期,企业也可获得相关的税务抵免、费用减免等优惠。
截图来源:药融云全球药物研发数据库
而在非肿瘤管线,药捷安康专注于大量未获满足的医疗需求以及难治性炎症和心血管疾病,目前包括四种小分子产品,即TT-00920、TT-01688、TT01025及TT-RIAN。其中,TT-01688 作为特异性皮炎领域中国进展最快的S1P1抑制剂,已在中国开展临床II期试验;心衰新药TT-00920已完成I期临床试验;TT-01025已完成I期临床且即将在美国由合作伙伴开展II期临床试验。
二、向内钻研,向外合作:国际化领先的药捷安康
对于创新药企而言,2022年被谈及最多的话题,除了“资本寒冬”就是创新药“出海”了。从2015年中国药政改革带来的产业界与资本界的创新热潮发展至今,走出国门、走向海外,是不少创新药企新势力与头部传统药企的愿景。
仅在2022年12月份,科伦药业和康方生物就接连爆出两期license-out交易,总金额分别为93亿美元和50亿美元。据不完全统计,截至2022年结束,我国药企至少达成44项跨境License-out交易,其中超半数(30项)围绕肿瘤和自身免疫疾病。在这之前,2020年8月,药捷安康临床前创新药TT-01025总价值3.5亿美元的license-out案例打破了当时的中国小分子对外许可交易金额记录。
古人云:“有一定之略,然后有一定之功。”药捷安康始终以自主研发与合作创新为驱动,致力于打造丰富的First-in-Class和全球竞争力的Best-in-Class产品。
通过多年技术积累,药捷安康已形成了完善的小分子全链条研发平台。同时,通过对外授权、联合研究、临床合作及授权引入等多种方式,在生物制药公司中建立了广泛的全球合作网络,与韩国LG Chem、罗氏制药、日本帝人制药纷纷达成不同模式的,国际水准的商务合作,成为行业中的佼佼者。
2021年,药捷安康与美国顶级基因检测公司Foundation Medicine进行伴随诊断合作,探索Tinengotinib对于FGFR耐药后新变异患者的Biomarker。2020年,药捷安康与日本Teijin签订两份战略合作协议,利用优势互补、风险共担,以在肿瘤及炎症性疾病的目标领域联合研发探索两个完全创新的靶点。
另外值得注意的是,2020年药捷安康向LG Chem授权其NASH领域临床前在研产品TT-01025的国际权利,同时保留中国及日本权益。南京生物医药谷称,该战略合作具有特殊意义,本次交易是小分子创新药领域由中国生物技术企业自主研发产品向国际品牌公司授权转让为数不多的,且截至当时为小分子项目金额最大的交易案。
业界普遍认同的是,衡量一家企业的国际化程度,不能仅仅看其海外产业销售带来的营收,而要扩展到从研发、到全球多中心临床试验、到生产、到销售的每一个环节。从这一点出发来看药捷安康,其药品的临床从初期就扎扎实实在美国申报、实施,尽管一定程度上提高了临床费用,但自身高度本土化、国际化的属性,使其到了FDA审核的环节压力预计就会小很多。
“作为一个中国本土成长起来的生物医药企业,我们多维度、多广度、多深度地与国际和国内领先企业开展合作,为公司未来的国际化道路打下了良好的基础。”药捷安康董事长吴永谦说。药捷安康开展的多层次、多维度的全球研发合作,不仅数量和质量在国内较为领先,而且特色鲜明,战略思维清晰,也是公司打造国际一流的生物医药公司的基石。
这些全球合作一方面平衡研发风险,加强了药捷安康自身的全球管线及加速临床开发的能力,提高了国际知名度,一方面也为中国Biotech公司的全球合作探索了新路径。而与海外企业授权合作既能在研发端实现优势互补、降低新药研发风险,又能在销售端借助国际大药企的销售网络,使创新药更快地打入国际市场。
License-in是拉动中国创新药行业发展的硬通货,而License-out是中国创新药企业成功“出海”、走向国际化的敲门砖。药捷安康已实现了自主研发创新药对海外授权(license out),并且成功实现里程碑收入。从中国创新到全球合作,药捷安康深耕差异化的细分赛道,在全球战略布局的策略渐入佳境,这也许是打动投资界的“芳心”的原因之一吧!
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论