
注册申报中的质量研究占有举足轻重的地位,因为本部分内容直接关系药品的质量可控性。质量研究的核心是药物的质量标准,质量标准中拟定的项目以产品的关键质量属性为基础,质量标准中对应的分析方法除非通用性的如干燥失重,水分,pH值等有药典通则的项目外,均需要进行对应分析方法学验证,其中验证的难度和复杂度相对较高的当属有关物质的方法学验证。
方法学验证无论是从众多的文章阅读,还是从指导原则方面都有大量的参考,可是为什么还会在验证开始后出现接二连三的偏差,甚至严重时出现重新开发方法的现象呢,如何获得一个高效能的有关物质方法学验证,本文将从七个设计点进行详细的阐述。

设计一:专属性的强制降解程度宜控制在5%左右
专属性在分析方法验证中占首要位置,若方法的专属性不强,存在测不准的问题,方法验证的其他项目恐怕无法进行。于有关物质而言,验证待测药物中存在杂质等情况下,主峰位置是否有共出峰的情况,一般采用DAD验证主峰纯度。
专属性中需要对主成分进行强制降解考察,一方面对药物稳定性进行考察,另一方面对方法的生命周期加以延长,在讨论本设计点之前,首先需要明确的本部分验证内容的可接受标准,即:物料平衡和降解程度,物料平衡一般规定90%-110%,关于降解程度的设置却是众说纷纭,一般会建议专属性中主峰的降解程度控制在10-20%,实际上在强制降解过程中主成分会发生一些二级降解,导致无法在拟定方法的检测波长下有效检出,进而造成物料平衡超出90%-110%,但是如果将主成分的降解程度维持在一定的水平,如5%左右,不但可以体现分析方法对降解杂质的分析,还可以保证物料平衡。因此,专属性中控制主成分的降解程度在5%左右,不仅能有效的验证方法的专属性,还能提高验证效率。
设计二:系统适用性的分离度合理设计
有关物质的系统适用性溶液的几种情况一般为规定浓度的特定杂质和主成分的混合溶液;供试品浓度下的主成分与限度浓度的杂质溶液或者某个降解条件下的供试品溶液。系统适用性的要求一般为主峰的保留时间,各特定杂质的相对保留时间,还有就是分离度,分离度的要求一般是规定系统适用性溶液中最难分离的两个色谱峰之间的分离度为基线分离或者分离度不低于如1.2等这样的固定数值。
如果色谱峰形都相对对称,那么拟定一个分离度1.1这样的系统适用性要求也是相对可以的,但是一旦有峰形不好的杂质峰存在,就需要提高分离度的要求,避免出现线性和回收率不通过的情况发生。如下图所示,二者的分离度需要达到2.0以上,才能保证线性和回收率的验证符合要求:
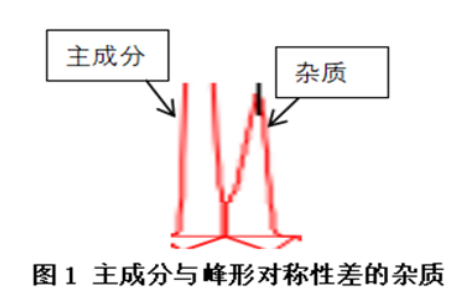
设计三:响应较低的组分宜选用仪器精密度1%以内的仪器设备
以API为例,根据日最大剂量,按照ICH指导原则杂质的限度一般为0.1%,某个特定杂质在制定依据充分的前提下,可以设置杂质的限度大于鉴定限度,但是一般很少达到1%的水平,在0.1%附近的杂质按照指导原则要求,RSD需要不大于3%,对于响应较低的组分,限度水平的峰面积也许只有10000左右,如果选用的仪器性能相对老旧,通常在1000左右有波动,即RSD在2%左右,那么如果某一针偏离2%范围很容易连续5针的RSD超出可接受标准。如下图所示:
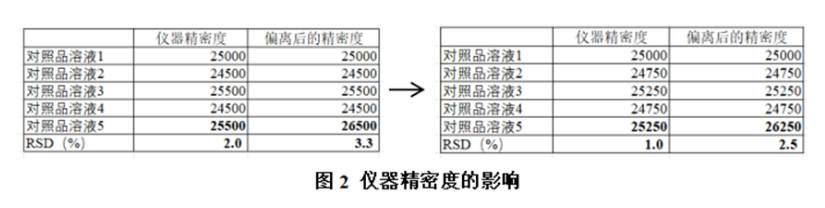
设计四:定量限浓度的选择以本底值为参考
方法学验证中定量限也是审评重点关注的,方法的定量限需要不小于报告限,并且需要满足准确度和精密度的要求,定量限以信噪比不低于10为评价标准,但是实际验证中真正的信噪比10附近很难保证定量限浓度点的回收率是符合指导原则的要求的,特别是有本底值的杂质的回收率更是需要考量定量限浓度的合理选择,比如有关物质方法学验证中杂质I的定量限水平S/N约10(相当于供试品的0.02%)的峰面积为1000,而供试品中杂质I的本底值为10000,如果回收率定量限浓度样品发生正偏差,那么回收率很容易为120%,那么提高定量限浓度,使其S/N约25(相当于供试品的0.05%),峰面积约增加一倍为2500,此时如果回收率定量限浓度样品发生正偏差,那么回收率约为108%,仍在规定的回收率限度85%-110%的范围内。
所以针对本底值比较大的特定杂质的定量限度拟定尤其需要关注,拟定的定量限浓度的峰面积仅仅为本底值的10%,定量限浓度的回收率是很难符合方法学验证要求的。如果某个杂质的校正因子很大,与主峰的响应值相差悬殊,在提高定量限浓度水平后,定量限为报告限仍然在本底值的10%以下,可以考虑提高供试品浓度,供试品浓度也无法提高的情况下,考虑弱化本底值,即对供试品进行处理后再进行回收率试验。
设计五:供试品溶液稳定性考察
以API的有关物质方法学验证为例,在方法学验证中需要应用供试品的项目包括重复性,中间精密度,回收率,耐用性等,在验证这些项目之前,先验证供试品的溶液稳定性很关键,为了提高验证效率,一般在验证过程中,样品都是制备之后24小时连续进样分析的,所以供试品如果不稳定,那么以上涉及的验证项目均会出现偏差,一旦供试品溶液不稳定,考虑几种解决方式更换供试品制备溶剂考察稳定性,或者制备条件加上临用新制,或者在进样室控温,但是即使进样室控温之后,仍需要重新考察供试品的溶液稳定性。
设计六:溶剂的选择兼顾溶解度和组分的溶剂效应
以API为例,有关物质拟定的特定杂质可能包括中间体和降解杂质,如果合成路线比较长,那么杂质之间的极性差距比较大,同时检出这些杂质,在方法开发中,梯度洗脱是必要的,供试品的溶剂选择一般考虑对其溶解较好的梯度系统中的两相溶剂的适当比例混合,如果供试品的极性较小,采用有机相比例比较高的溶剂溶解,很容易发生极性较大的杂质出现色谱峰形异常的溶剂效应。杂质的色谱峰对称性很差,线性项目容易验证失败,所以在溶剂的选择中需要兼顾溶解度和组分的溶剂效应,结合设计五,还需要考虑对供试品的稳定性的影响。
设计七:供试品浓度的选择兼顾进样残留和检测灵敏度
以API为例,方法验证中的供试品浓度并非通用的1mg/ml等,是根据各杂质的限度和仪器检测灵敏进行设计的,但是即使在供试品的溶解性很好的前提下,也不能将供试品的浓度设置的过高,因为可能存在进样残留,即便洗针的溶剂对供试品的溶解度最佳,洗针的时间设置的最长,仍然存在进样残留,那么需要考虑供试品的浓度设计是否合理,必要时需要降低供试品浓度,避免在专属性验证结束后,定量限和检测限验证前需要大量时间去处置系统。
综上,看似方法学的验证是循规蹈矩的,但是里面暗藏玄机,如果没有细心的分析和精心的设计,在验证过程中很容易出现接连不断的偏差,必要的预验证和合理的设计是实现有关物质高效能验证符合方法验证要求的有效途径,希望本文的讨论可以给方法学验证路上的同仁一点启发,欢迎同仁们一起讨论。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论