
据药融云监测显示:此前在2023年10月9日,Supernus pharmaceuticals公司宣布,其皮下注射阿扑吗啡输注装置组合(SPN-830)已重新提交新药申请(NDA),用于持续治疗帕金森病(PD)的运动波动。
如果SPN-830在美国获得监管批准,Supernus需要进行有力的营销,使其在竞争激烈的市场中脱颖而出。
其竞争对手包括艾伯维的Vyalev/Produodopa(Foslevodopa/Foscarbidopa)和Neuroderm的ND0612(Levodopa/Carbidopa)。目前,艾伯维和NeuroDerm都在冲刺美国首次皮下注射左旋多巴(Levodopa)的商业化。据GlobalData预测,到2029年,Vyalev和ND0612在美国的销售额将达到6.17亿美元。

Supernus Pharmaceuticals, Inc.是美国的一家生物制药公司,成立于2005年,当时从母公司Shire Plc剥离出来,2012年上市,截至2024年1月30日,股价每股28.35美元,市值约15.5亿美元。截止2月28日,公司市值约16.98亿美元。
该公司专注于开发和商业化治疗中枢神经系统(CNS)疾病的产品,其多样化的神经科学产品组合包括已获批准的治疗癫痫、偏头痛、注意力缺陷多动障碍(ADHD)、帕金森病(PD)患者的运动功能低下、颈部肌张力障碍、慢性流涎、接受左旋多巴治疗的PD患者的运动障碍以及成人患者的药物诱导的锥体外系反应。
Supernus的主要专利技术平台包括:Microtrol、Solutrol和Ensotrol。这些技术已被用于创建新颖的、定制的产品方案,旨在增强疗效,减少给药频率,以提高患者的依从性和耐受性。该公司正在开发一系列新型中枢神经系统候选产品,包括治疗帕金森病、癫痫、抑郁症和其他中枢神经系统疾病的新的潜在疗法。目前该公司共销售八种商业产品:Qelbree®、Gocovri®、Trokendi XR®、Oxtellar XR®、Apokyn®、Xadago®、Osmolex ER®和Myobloc®。
 图片(▲Supernus在CNS和ADHD领域拥有超过30年经验,有4款治疗ADHD的产品,图源Supernus官网)
图片(▲Supernus在CNS和ADHD领域拥有超过30年经验,有4款治疗ADHD的产品,图源Supernus官网)
● Qelbree®(维洛沙嗪缓释胶囊)是一种新型非刺激性产品,适用于治疗成人和6岁及以上儿童患者的ADHD(多动症,注意缺陷多动障碍)。美国食品和药物管理局(FDA)于2021年4月批准QELBREE用于治疗6至17岁儿童患者的ADHD,并于2022年4月批准用于成人患者。该公司于2021年5月在美国推出用于儿童患者的QELBREE,并于2022年5月在美国推出用于成人患者的QELBREE。
● Gocovri®(金刚烷胺)缓释胶囊是FDA批准的第一种也是唯一一种药物,用于治疗接受左旋多巴治疗的帕金森病患者的运动障碍,可同时使用或不使用多巴胺能药物,也可作为左旋多巴/卡比多巴的辅助治疗,治疗经历“关闭”期(“off” episodes)的帕金森病患者。
● Trokendi XR®(托吡酯)是美国市场上第一个用于治疗6岁及以上癫痫患者的托吡酯每日一次缓释产品。它也适用于预防成人和12岁及以上青少年的偏头痛。
● Oxtellar XR®(奥卡西平)适用于治疗6岁及以上患者的部分性癫痫发作。这也是美国市场上第一个用于治疗癫痫的每日一次的奥卡西平缓释产品。
● Apokyn®(盐酸阿扑吗啡注射液)是一种适用于晚期帕金森病患者的急性间歇性治疗,用于治疗运动功能低下、“关闭”期(“剂量结束时逐渐消失”和不可预测的“开/关”期)。
● Xadago®(沙非酰胺)是一种每日一次的产品,可作为左旋多巴/卡比多巴的辅助治疗,用于经历“关闭”期的PD患者。
● Osmolex ER®(金刚烷胺)缓释片用于治疗成人PD和药物引起的锥体外系反应。
● MYOBLOC®(RimabotulinumtoxinB注射液)是一种适用于治疗成人颈部肌张力障碍和慢性流涎的产品。它是市场上唯一可用的B型肉毒毒素。
研发管线
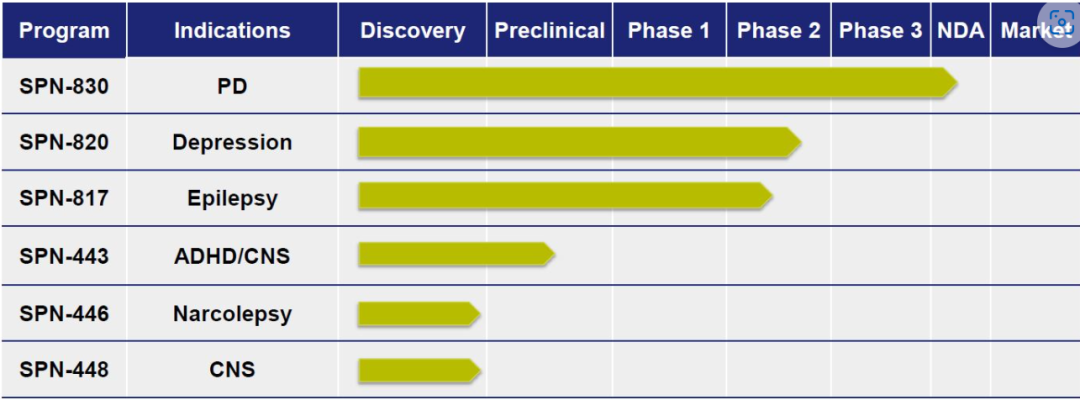
(▲更新截至2023年11月,图源:Supernus官网)
1.SPN-830(阿扑吗啡输液装置组合)治疗帕金森病
SPN-830是一种晚期药物/设备组合产品,用于持续治疗PD患者的运动波动(“关闭”期),这些患者不能充分控制口服左旋多巴和一种或多种辅助PD药物。如果获得批准,这将是美国唯一一种持续输注阿扑吗啡的药物,对于PD患者来说是重要的一步,否则PD患者可能会面临潜在的侵入性外科手术,如脑深部电刺激术。持续缓慢输注也可以限制阿扑吗啡大剂量注射的一些副作用。
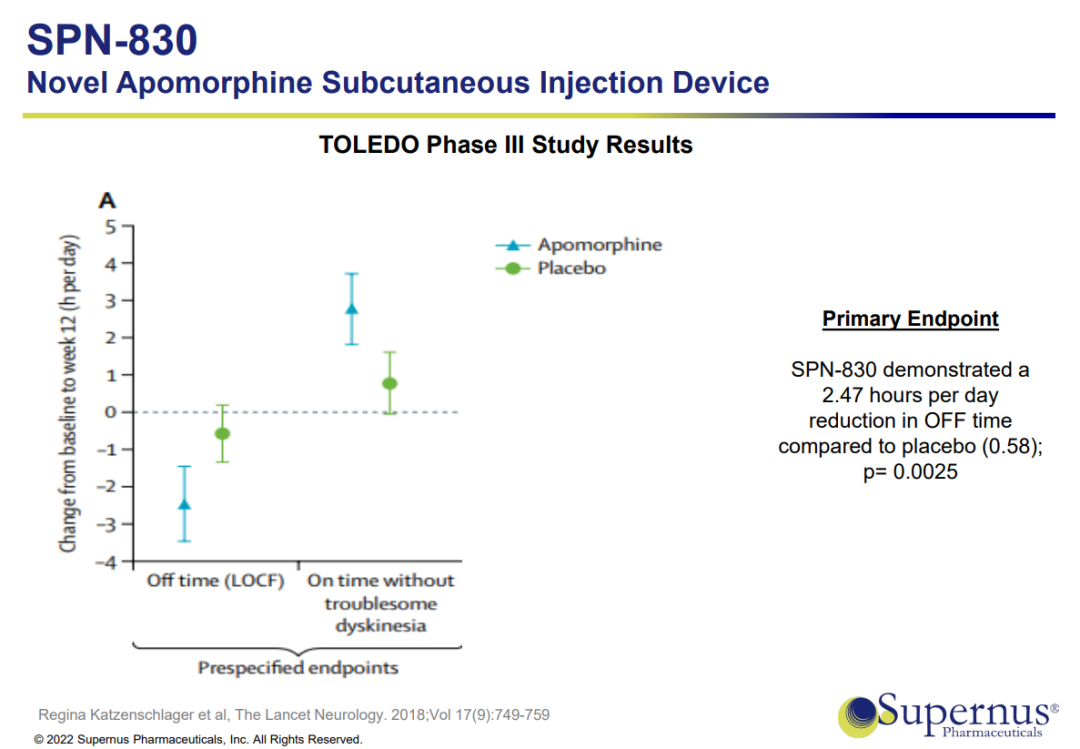
2021年12月,Supernus向FDA重新提交了新药申请(NDA)。2022年2月,Supernus收到FDA的通知,重新提交SPN-830的NDA被认为是标准审查,并被指定为2022年10月初的PDUFA目标行动日期。2022年10月,FDA发布了关于SPN-830 NDA的完整回复函(CRL)。CRL要求提供与输液器和药品相关的额外信息和分析,涉及NDA的多个领域,包括但不限于标签、产品质量和生产、器械性能和风险分析。此外,FDA提到,NDA的批准需要检查,由于旅行限制而无法及时完成。CRL不要求额外的有效性和安全性临床研究。FDA已经做出初步决定,公司对CRL申请的修订将受到2类或6个月的审查时间表的约束。2023年4月,公司与FDA会面讨论CRL。
2023年10月,该公司重新提交了阿扑吗啡输注装置(SPN-830)的新药申请(NDA),用于持续治疗帕金森病的运动波动(“关闭”期)。2023年11月,FDA接受了SPN-830新药申请的重新提交,PDUFA日期为2024年4月5日。
2.SPN-820–增加mTORC1介导的抑郁症突触功能的新型第一类分子
SPN-820是一种一流的口服活性小分子,可增加雷帕霉素复合物1(mTORC1)介导的细胞内突触功能的脑机制靶点。SPN-820不结合或调节任何细胞表面受体,因此不太可能具有滥用的可能性,因为缺乏与药物滥用相关的靶标的结合。此外,与亮氨酸不同的是,它在蛋白质合成过程中不会结合到蛋白质中,因此,它在大脑中的靶位点比亮氨酸更容易被利用。

SPN-820治疗成人难治性抑郁症的IIb期多中心随机双盲安慰剂对照平行设计研究正在进行中。该研究将在多达50个临床地点的约268名患者中,在为期五周的治疗过程中检验SPN-820的疗效和安全性。主要结果指标是从基线到治疗结束时Montgomery-Asberg抑郁评定量表(MADRS)总分的变化。IIb期试验的背线数据预计将于2025年公布。
公司计划在2023年年底之前,在大约40名患有重度抑郁症(MDD)的受试者中启动一项II期开放标签研究。该研究的主要目的是评估MDD的疗效以及起效时间。
3.SPN-817代表了一种新的抗惊厥作用机制(MOA)
SPN-817是石杉碱甲(huperzine A)的一种新的合成形式,石杉碱甲是一种高选择性的乙酰胆碱酯酶(AChE)抑制剂,对局灶性癫痫等中枢神经系统疾病具有药理活性。开发最初将集中在药物的抗惊厥活性,这已在临床前模型中显示出对治疗癫痫有效。SPN-817正处于临床开发阶段,并已获得美国食品和药物管理局(FDA)指定的几种癫痫适应症的孤儿药。
SPN-817治疗难治性癫痫发作的开放性IIa期临床研究正在进行中。该研究正在检验SPN-817作为成人难治性癫痫发作患者辅助治疗的安全性和耐受性,并评估其疗效。该公司预计在2024年上半年获得IIa期研究的结果。
该公司预计在2024年上半年启动一项IIb期随机、双盲、安慰剂对照研究,纳入约436名难治性局灶性癫痫发作患者。主要终点是每28天局灶性癫痫发作频率相对于基线的变化。IIb期研究的结果预计将于2026年公布。
4.SPN-443–治疗ADHD/CNS的新型兴奋剂
该公司计划于2024年在提交研究新药申请后,在大约24名健康成人中启动I期单剂量研究。本研究的主要目的是评估安全性和耐受性。
新药狂潮:多个适应症领域
多动症
多动症是一种中枢神经系统疾病,其特征是注意力不集中、多动和冲动。据估计,美国6%至9%的学龄儿童和3%至5%的成年人患有多动症。据估计,50%患有多动症的儿童在进入青春期后仍符合多动症的标准。ADHD的诊断需要基于识别表现出注意力不集中、多动和冲动等核心症状的患者进行全面的临床评估。尽管许多患者可能注意力不集中、过度活跃或冲动,但功能损害的严重程度和程度,以及对潜在症状背后可能原因的考虑,决定了哪些患者符合诊断,因此应接受ADHD治疗。
Qelbree是一种新型的非兴奋剂,每天服用一次,全天服用。在临床研究中,在治疗早期观察到疗效和症状改善。此外,它的安全性和耐受性已得到证实,在临床研究中没有滥用的可能性。QELBREE是FDA十多年来批准的第一种治疗ADHD的非兴奋剂疗法。近年来,随着多个品牌产品的商业上市,以及Adderall XR、Intuniv、Kapvay和Strattera等品牌药物仿制药的上市,美国ADHD市场的竞争加剧。在美国市场上,ADHD的治疗选择可大致分为兴奋剂或非兴奋剂产品。
2023年12月19日,Supernus称:已授予Knight Therapicals寻求监管部门批准并在加拿大将Qelbree商业化的权利,以治疗注意力缺陷多动障碍,这将为加拿大的ADHD患者提供新的治疗选择。
癫痫
癫痫是一种复杂的神经系统疾病,其特征是无缘无故的癫痫发作的自发复发,这是大脑中电活动的突然激增,损害了人的精神和/或身体能力。坚持药物治疗方案对于实现癫痫患者的有效控制至关重要。不坚持抗癫痫药物(AED)治疗是一个严重的问题,并且仍然是患者突破性癫痫发作的最常见原因。不仅服用所有处方剂量对控制突破性癫痫发作至关重要,而且患者服用处方剂量的时间也至关重要。Supernus相信缓释产品特别是Trokendi XR和Oxtellar XR,可能在治疗癫痫方面具有重要优势。与速释产品相比,缓释产品的释放曲线可以产生更一致和更稳定的血浆浓度,可能导致更少的副作用、更好的耐受性、更少的急诊室就诊、更好的疗效和更少的突破性癫痫发作。此外,Trokendi XR和Oxtellar XR的每日一次给药旨在提高患者的依从性,而目前的速释产品必须每天服用多次。每日一次的给药方案可以提高依从性,使患者更有可能服用药物并在血液中维持足够的药物水平。缓释产品可以帮助患者提高依从性,从而帮助患者享受更好的生活质量。
Trokendi XR与所有速释和缓释托吡酯产品竞争,包括妥泰、Qudexy XR及其相关非专利产品。Oxtellar XR与所有立即释放的奥卡西平产品竞争,包括三奈普妥及其相关仿制药。Oxtellar XR和Trokendi XR都与其他品牌和非专利抗癫痫产品竞争。许多药物用于治疗癫痫,包括托吡酯、奥卡西平、乙酰唑胺、布立西坦、卡马西平、氯巴占、拉科酰胺、苯妥英、丙戊酸、拉莫三嗪、加巴喷丁、左乙拉西坦、苯巴比妥和唑尼沙胺。此外,在考虑癫痫患者的治疗方案时,神经病学家和癫痫病学家会考虑可用的不同AEDs的MOA。通过结合几种不同的MOA,有时可以获得明显更好的癫痫控制。Supernus收购了SPN-817,一种抗癫痫药物,其具有不同于其他产品的MOA,因此可能代表一种独特的额外治疗选择。
偏头痛
药融云数据监测显示:偏头痛是一种复杂的神经疾病,由反复发作的疼痛组成,通常表现为搏动性疼痛,对光线或声音极度敏感,以及潜在的恶心和呕吐。世界卫生组织将偏头痛列为全球最具致残性的医学疾病之一。美国研究基金会(American Research Foundation)将偏头痛列为世界上第三大流行疾病,近四分之一的美国家庭中有偏头痛患者。据估计,美国有超过3900万人患有偏头痛。
与癫痫一样,Supernus相信缓释产品Trokendi XR,可能为偏头痛的治疗提供重要优势。Trokendi XR还与其他用于预防偏头痛的产品竞争。最值得注意的是,这包括抗CGRPs(降钙素基因相关肽),这是2018年首次推出的一类产品;肉毒杆菌;β-受体阻滞剂;丙戊酸;和阿米替林。
帕金森病
帕金森氏病是一种渐进性神经系统疾病,其特征是大脑某些区域产生多巴胺的神经元缺失,导致震颤、运动缓慢、僵硬、失去平衡和缺乏协调等症状。帕金森病是第二种最常见的渐进性神经退行性疾病,影响1-2%的65岁及以上人群。帕金森病患者还会受到心理症状的影响,如焦虑、抑郁、攻击性以及认知和记忆问题。随着疾病的进展,一些患者可能会丧失独立完成日常生活任务的能力。治疗帕金森病最常用的处方药是左旋多巴。
帕金森病患者经常服用左旋多巴,以帮助替代大脑中减少的多巴胺。然而,对于超过一半的帕金森病患者来说,左旋多巴失效导致的运动障碍仍然是一个严重的问题。处于“关闭”状态的患者,包括上一次口服左旋多巴的剂量已经消失,而下一次口服左旋多巴的剂量尚未开始起效的患者,每天可能会有几个小时的协调性或活动能力下降。卡比多巴可与左旋多巴一起使用,以提高其疗效并减少控制PD症状所需的左旋多巴的量。对于帕金森病患者,有许多可供选择的辅助治疗方案(FDA批准的和临床开发中的),包括各种左旋多巴制剂、多巴胺受体激动剂、Mao-B抑制剂等。
对于口服左旋多巴不能充分控制“关闭”期的患者,该公司已将Apokyn商业化,通过注射笔给药。在临床研究中,服用Apokyn的患者95%的“关闭”发作得到逆转,在给药后10分钟就开始改善。随着不动和功能受限的替代,快速可靠地减少“关闭”发作症状对患者至关重要。Apokyn与包括Kynmobi在内的所有盐酸阿朴吗啡产品竞争。它还与其他Pro Re Nata(PRN)疗法(如Inbrija)和其他辅助疗法(包括Nourianz)竞争。Apokyn还与其他治疗帕金森病的产品竞争,包括品牌和非专利产品,包括左旋多巴产品。对于每天经历大量“休息”时间的患者,该公司开发了一种作为连续输注设备(SPN-830)的候选产品,用于皮下输送阿扑吗啡。与急性注射途径相比,输注可以减少帕金森病运动症状的变异性,并提供更好的耐受性。
对于不准备尝试胃肠外治疗的患者,口服Mao-B抑制剂,如Xadago,当与适当的左旋多巴治疗相结合时,可以减少每天多达1小时的“关闭”时间。在Xadago临床试验中,与接受安慰剂的患者相比,患者经历了更有益的“开”时间,即帕金森症状减轻的时间,没有麻烦的不受控制的不自主运动(运动障碍)。与治疗前相比,“开”时间的增加伴随着“关”时间的减少,并且在“开”时间内评估的运动功能测量得分更高。Xadago与其他用于治疗PD “关闭”发作的Mao-B抑制剂竞争,包括雷沙吉兰(Azilect)和司来吉兰(Zelapar和Emsam)。Xadago还与其他治疗PD的产品竞争,包括品牌和非专利产品,包括左旋多巴产品。
Gocovri(金刚烷胺)缓释胶囊是FDA批准的第一种也是唯一一种药物,用于治疗接受左旋多巴治疗的帕金森病患者的运动障碍,可同时使用或不使用多巴胺能药物,也可作为左旋多巴/卡比多巴的辅助治疗,用于治疗帕金森病患者的“关闭”发作。它也是唯一一种经临床证明可以减少运动障碍和“关闭”期的药物。Gocovri,每天睡前服用一次,在夜间提供金刚烷胺浓度的初始滞后和缓慢上升,导致从早晨到整个清醒的一天的高浓度。此外,在临床试验中,辅助使用Gocovri不需要改变多巴胺能治疗。Gocovri已被授予孤儿药专有权,有效期至2024年8月24日,用于治疗接受左旋多巴治疗的帕金森病患者的运动障碍,无论是否同时服用多巴胺能药物。
Osmolex ER是一种缓释片制剂,含有速释和缓释金刚烷胺,每天早晨给药一次。Osmolex ER的每日一次早晨剂量提供了一个更方便的选择,因为它减少了患者每天必须服用的药片数量,这可能会提高患者对治疗方案的依从性。虽然Osmolex ER与速释金刚烷胺具有生物等效性,但该产品可全天持续释放金刚烷胺。当在早晨给药时,血清药物浓度的峰值方便地出现在患者一天的中间部分。根据他们的处方信息,Gocovri和Osmolex ER都不能与其他金刚烷胺速释或缓释产品互换,以用于各自批准的适应症。
财务状况
2023财年三季度报告
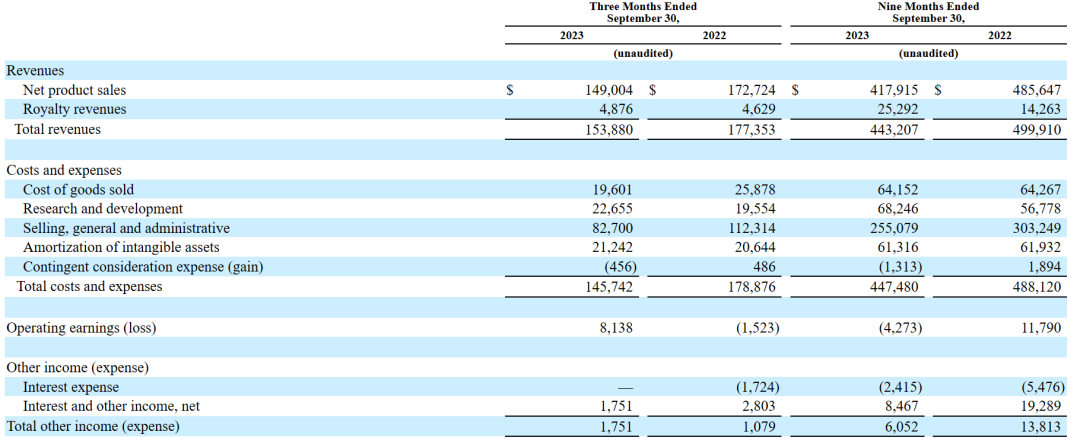
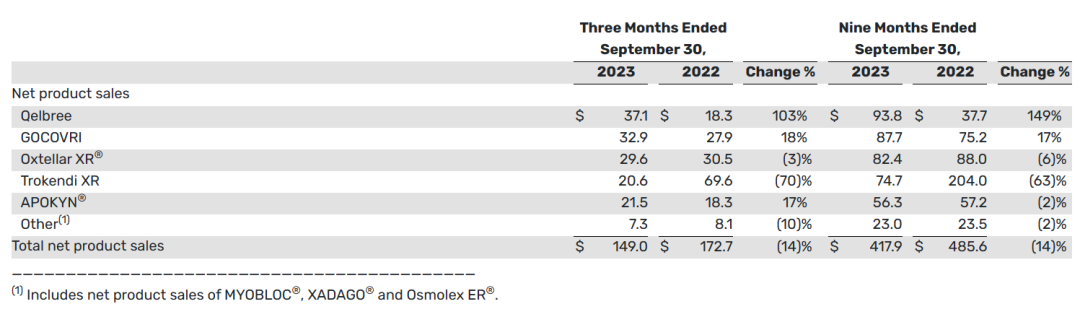
2023年11月9日,Supernus公布2023财年三季度报告。2023财年第三季度,总收入和净产品销售总额(GAAP)分别为1.539亿美元和1.49亿美元,而2022年同期的总收入和净产品销售总额分别为1.774亿美元和1.727亿美元。
2023财年前三季度,总收入和净产品销售总额分别为4.432亿美元和4.179亿美元。与2022年同期的总收入和总产品净销售额4.999亿美元和4.856亿美元相比,这两个时期的产品净销售额下降主要是由于Trokendi XR的产品净销售额下降。
2023财年第三季度,Qelbree、Gocovri和Apokyn的产品净销售额增加,以及2023财年前三季度,Qelbree和Gocovri的产品净销售额增加,部分抵消了Trokendi XR产品净销售额的下降。与2022年同期相比,截至2023年9月30日的三个月和九个月的总收入(不包括Trokendi XR净产品销售额)分别增长了24%和25%。
下表提供了2023财年三季报中的总收入信息(以百万美元计):
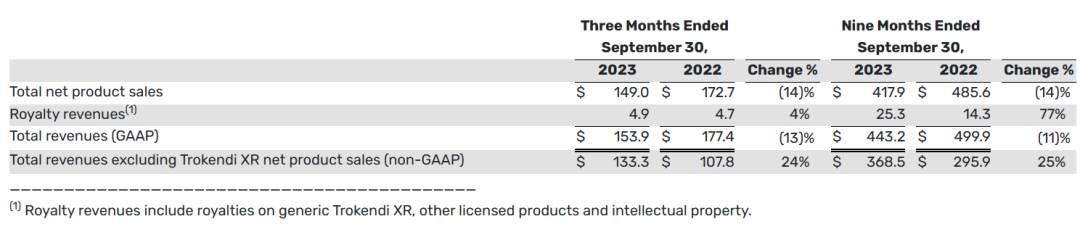
下表提供了2023财年三季报中的净产品销售总额信息(以百万美元计):
2022财年年报
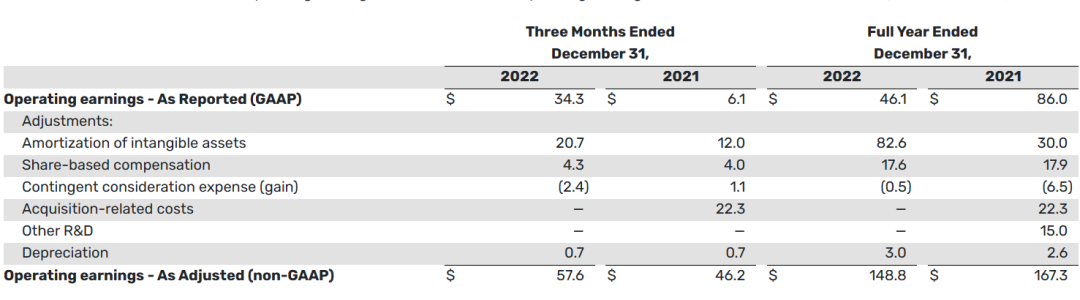
2023年3月10日,Supernus公布2022财年年报。2022财年全年的运营收益(GAAP)为4610万美元,而2021年同期为8600万美元。减少的主要原因是支持向成年人口推出Qelbree的活动以及从Adamas收购中获得的无形资产的摊销。截至2022年12月31日,公司的现金、现金等价物、流动和长期有价证券约为5.552亿美元。
基于GAAP的运营收益和基于非GAAP的运营收益之间的明细对账如下(以百万美元计):
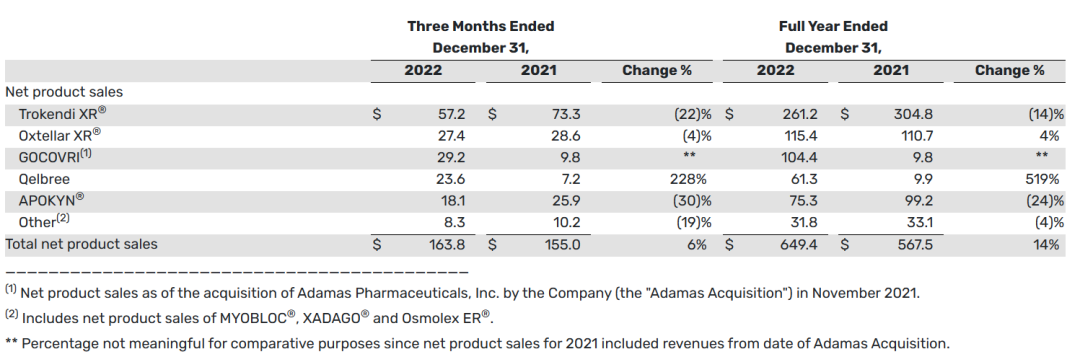
2022财年全年,产品销售净额为6.494亿美元,比2021年同期的净产品销售额5.675亿美元增长了14%。这两个时期的增长主要是由于Gocovri的净产品销售额和Qelbree的净产品销售额的增长。
下表提供了截至2022年12月31日和2021年12月31日的三个月和全年的产品净销售额信息(以百万美元计):
2023财年财务指导数据
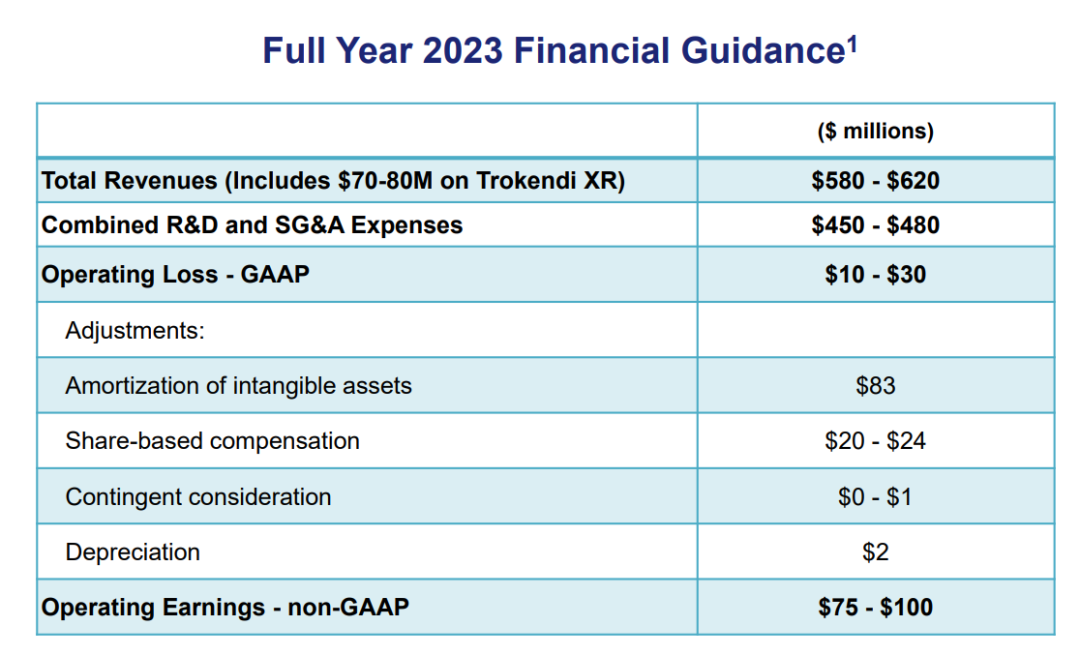
2023年9月,Supernus更新2023财年财务预期,总营收额5.8亿美元~6.2亿美元,研发及行政等支出费用4.5亿美元~4.8亿美元,经营亏损(GAAP)1000万美元~3000万美元。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论