屋漏偏逢连阴雨,有一家上市的biotech公司新药上市申请被FDA两次拒绝,还被投资者索赔。
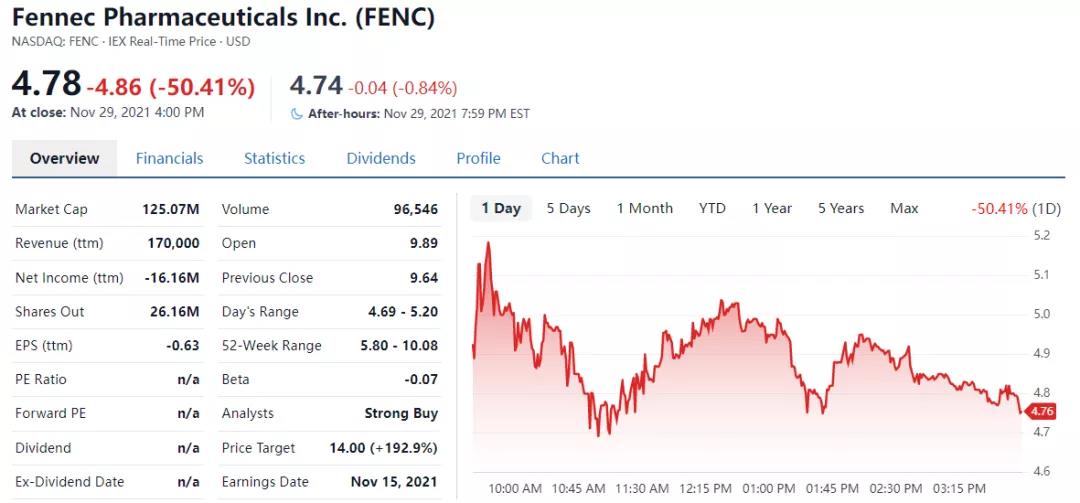
11月29日,路透社报道, Fennec Pharmaceuticals.Inc. (纳斯达克代码:FENC)周一表示,预计美国卫生监管机构将再次拒绝其用于预防儿童化疗引起的听力受损药物PEDMARK的上市销售申请,导致其股价在周一收盘暴跌50%。
图片来源:stockanalysis
该公司表示,FDA在对该药物的生产设施进行检查后发现了缺陷,但没有提供进一步的细节。这是Fennec管道中唯一的临床候选药物Pedmark的第二个潜在挫折。去年,FDA以类似的原因拒绝批准该药物。Fennec收到FDA完整回复函(CRL)后,公司计划要求召开A类会议,讨论重新提交PEDMARK TM的NDA所需的缺陷和步骤。
由于Fennec自身原因,两次提交PEDMARK 上市申请遭拒,一家知名的律师事务所Pomerantz LLP正在代表Fennec的投资者调查索赔,调查涉及Fennec及其某些高级职员和/或董事是否从事证券欺诈或其他非法商业行为。
2021年Fennec三季报披露,公司营收为0,截止到9月30日拥有现金和现金等价物是2430万美元,前三季度研发费用投入445.8万美元,行政管理费用855.8万美元,净亏损1291.9万美元。唯一新药上市遭拒后,对公司未来的现金流是考验。
Fennec Pharmaceuticals,Inc的CEO罗斯蒂·雷科夫曾在三季报中表示,“我们继续与FDA合作审查我们的NDA申请,在待定的PEDMARK™PDUFA目标行动日期为 11月27日。我们专注于必要的活动,准备为接受顺铂化疗的儿童提供这种重要的治疗方法”。
关于PEDMARK™
Pedmark是静脉内给药的药物,主要针对接受过使用顺铂的铂类化疗的1个月至18岁的儿童。虽然这些疗法常用于治疗一系列儿童癌症,但可能导致永久性听力损失。
顺铂和其他铂化合物是许多儿科恶性肿瘤必不可少的化疗药物。不幸的是,铂类疗法会导致耳毒性或听力损失,这是永久性的、不可逆转的,对儿科癌症的幸存者尤其有害。
在美国和欧洲,估计每年有超过10,000名儿童可能接受铂类化疗。耳毒性的发生率取决于化疗的剂量和持续时间,其中许多儿童需要终身佩戴助听器。目前还没有针对此类听力损失的成熟预防剂,只有昂贵、技术上困难且次优的人工耳蜗(内耳)植入物已被证明可以提供一些益处。在发育关键阶段遭受耳毒性的婴幼儿缺乏语言发展和识字能力,年龄较大的儿童和青少年缺乏社会情感发展和教育成就。
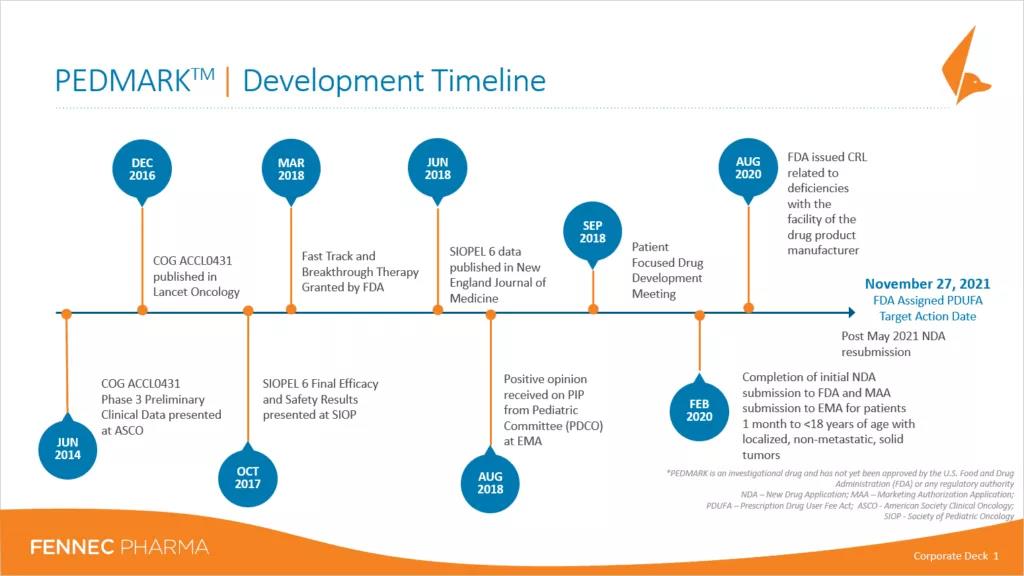
PEDMARK研发时间表
图片来源:FennecPharmaceuticalsInc官网
PEDMARK已由合作小组在两项关于生存和降低耳毒性的3期临床研究、临床肿瘤学小组协议ACCL0431和SIOPEL6中进行了研究。两项研究均已完成。COGACCL0431协议招募了五种儿童癌症中的一种,这些癌症通常用强化顺铂治疗局部和播散性疾病,包括新诊断的肝母细胞瘤、生殖细胞肿瘤、骨肉瘤、神经母细胞瘤和成神经管细胞瘤。SIOPEL6仅招募了具有局部肿瘤的肝母细胞瘤患者。硫代硫酸钠(商品名PEDMARQSI)的上市许可申请(MAA)目前正在接受欧洲药品管理局(EMA)的评估。PEDMARK已于2018年3月获得FDA的突破性疗法和快速通道指定。

Fennec PharmaceuticalsInc.是一家专业制药公司,专注于PEDMARK ™的开发,用于预防儿科患者铂诱导的耳毒性。此外,PEDMARK已在美国获得孤儿药资格认定。Fennec与俄勒冈健康与科学大学签订了许可协议,以获得针对STS及其化学保护用途的全球独家许可权,包括预防铂化疗引起的人类耳毒性。
参考资料:
https://www.reuters.com/business/healthcare-pharmaceuticals/fennec-expects-us-fda-decline-application-hearing-loss-drug-2021-11-29/
https://investors.fennecpharma.com/news-releases/news-release-details/Fennec-pharmaceuticals-expects-receive-complete-response-letter
<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论