
CDMO承载着专业化开发与生产的职能,在制药领域正扮演着越来越重要的角色。在过去,欧美地区凭借先发优势,占据着全球CDMO市场份额的重要部分,但近几年国内制药行业发展迅速,创新氛围渐浓,一大批本土CDMO企业迅速崛起。选择CDMO外包一定程度上可以将风险分散制药企业的风险。

01
2022年9月28日,烟台迈百瑞国际生物医药股份有限公司(以下简称迈百瑞)在深交所创业板上市申请获得受理。迈百瑞成立于2013年6月,注册资本4.04亿元,注册地为山东省烟台开发区,实际控制人为王威东、房健民、林健等10名自然人,合计控制公司32.95%的股权。
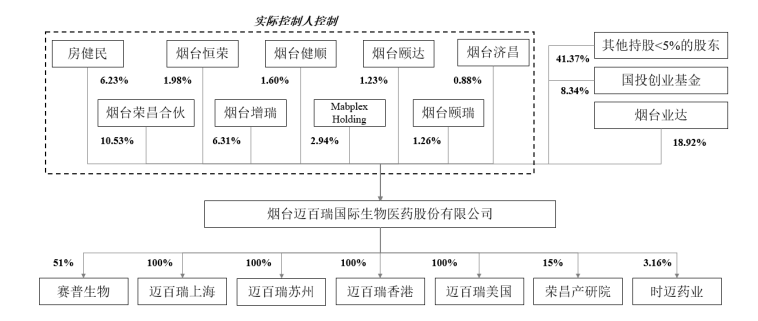
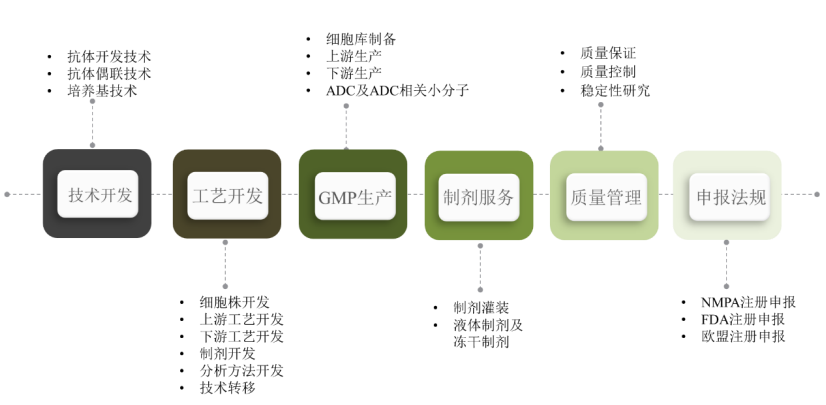
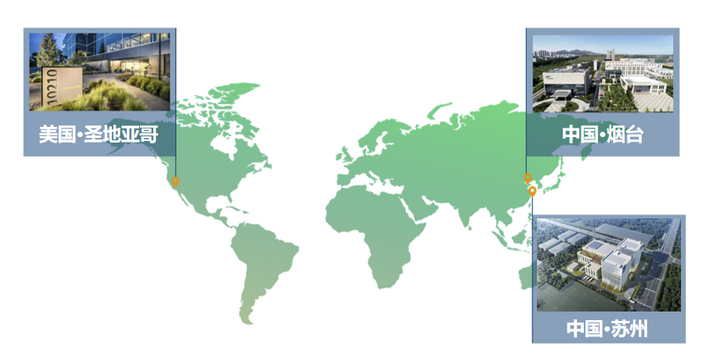
迈百瑞是一家聚焦于生物药领域的CDMO企业,拥有烟台、上海、圣地亚哥三个研发及生产中心,可以为全球客户提供单抗、双抗、多抗、融合蛋白、ADC等创新生物药、生物类似药的早期研发、工艺开发、临床样品生产、商业化生产等全链条、定制化服务。是目前全球少数具备提供抗体偶联药物全链条CDMO服务的公司之一。
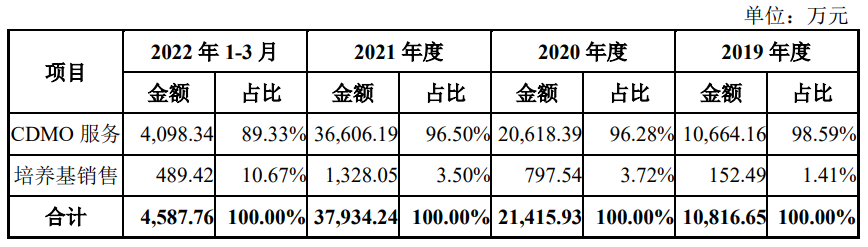
2020和2021财年,迈百瑞营业收入(涵盖CDMO和培养基)分别为2.17亿元、3.88亿元,净利润-409.49万元、5956.14万元。2022年1-3月份,实现营业收入4681.42万元,净利润177.72万元。
本次上市,迈百瑞计划公开发行股票约1.01亿股,计划募集资金16亿元,主要用于生物医药创新中心及运营总部建设项目和补充营运资金。
02
2022年9月22日,迈百瑞位于苏州的“生物医药创新中心暨运营总部项目”在苏州工业园区奠基。该项目总投资16.2亿元,建筑面积约13万平米,规划建设研发检测大楼、GMP生产大楼、培养基生产车间、仓储中心、环保中心等。项目将聚焦生物药的研发创新,开展临床前、临床研究及商业化的生产及分析检测,打造集生物医药新技术开发、新药早期研究与工艺研发、多领域的检测检验等一体化的生物药转化助推器,同时,向培养基研发生产等CDMO产业链上游拓展业务范围。
对CXO感兴趣,可以看药融圈旗下矩阵公众号此前的系列文章:
CXO龙头突发暴跌原因!拜登政府推动30万亿美元生物制造市场美国本土化
......
参考:
NMPA/CDE;
迈百瑞;
药融云数据,vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露;
http://www.mabplex.com/;
开疆拓土:布局CDMO的国内Biotech盘点;等等。
<END>


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论