
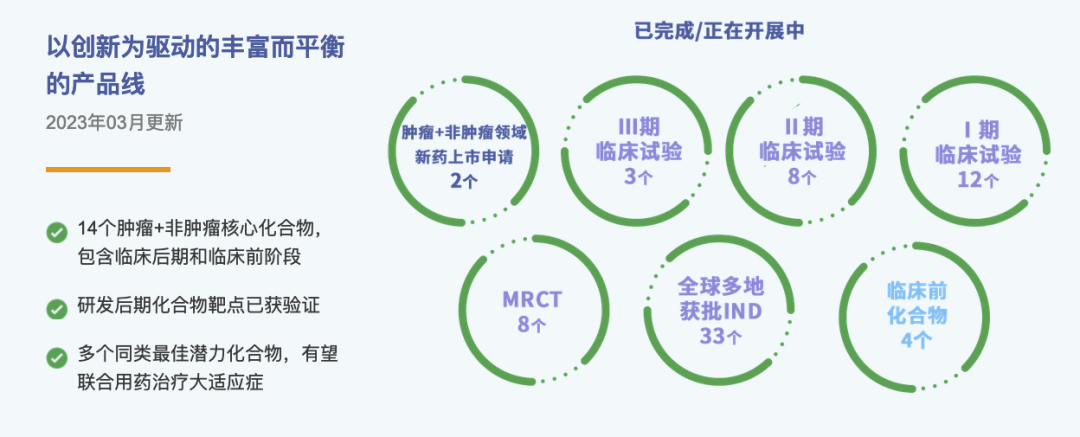
药融圈获悉:近期,上海海和药物研究开发股份有限公司(以下简称“海和药物”)同海通证券签署上市辅导协议。目前海和药物已有1款产品(谷美替尼片,商品名:海益坦®)获批上市,在研管线有12个候选药物。
01.谷美替尼
2023年4月28日,海和药物宣布其拥有的全球自主知识产权、石药集团负责商业化推广的国家1类新药谷美替尼片/Glumetinib Tablets正式商业上市。药融云数据显示:规格50mg*24片/盒的零售价为4980.00元人民币。

谷美替尼作为ATP竞争性的MET抑制剂,可以显著抑制MET及其下游关键信号分子ERK和AKT的磷酸化,阻断HGF/MET通路的激活。谷美替尼分子中差异化的连接基团(-SO2-)使其能维持有效构象而不依赖添加其它基团来提高抑制活性,从而降低了额外基团的引入带来的其它代谢相关风险。全新的化学结构带来更优的药代动力学特性,谷美替尼的半衰期长,适合每日一次给药且不需要根据体重做剂量调整;稳态谷浓度更高,可以持续抑制靶点。不仅如此,谷美替尼与其他药物相互作用少,合并用药不受限制,为伴有基础疾病患者的优选。
谷美替尼药物研发信息(部分,完整内容请登录“药融云数据库www.pharnexcloud.com/?mh”查看)

截图来源:药融云全球药物研发数据库
2022年12月17日,海和药物与石药集团签署了一项授权许可。许可约定:海和药物作为谷美替尼片的上市许可持有人,主要负责谷美替尼片的研发和生产;石药集团负责实现谷美替尼在大中华(包含港澳台)范围内的商业化推广。
02.EZH1/2抑制剂HH2853
2023年6月海和药物EZH1/2抑制剂HH2853首次人体I/II期研究在上皮样肉瘤人群中的初步结果亮相2023年ASCO年会。
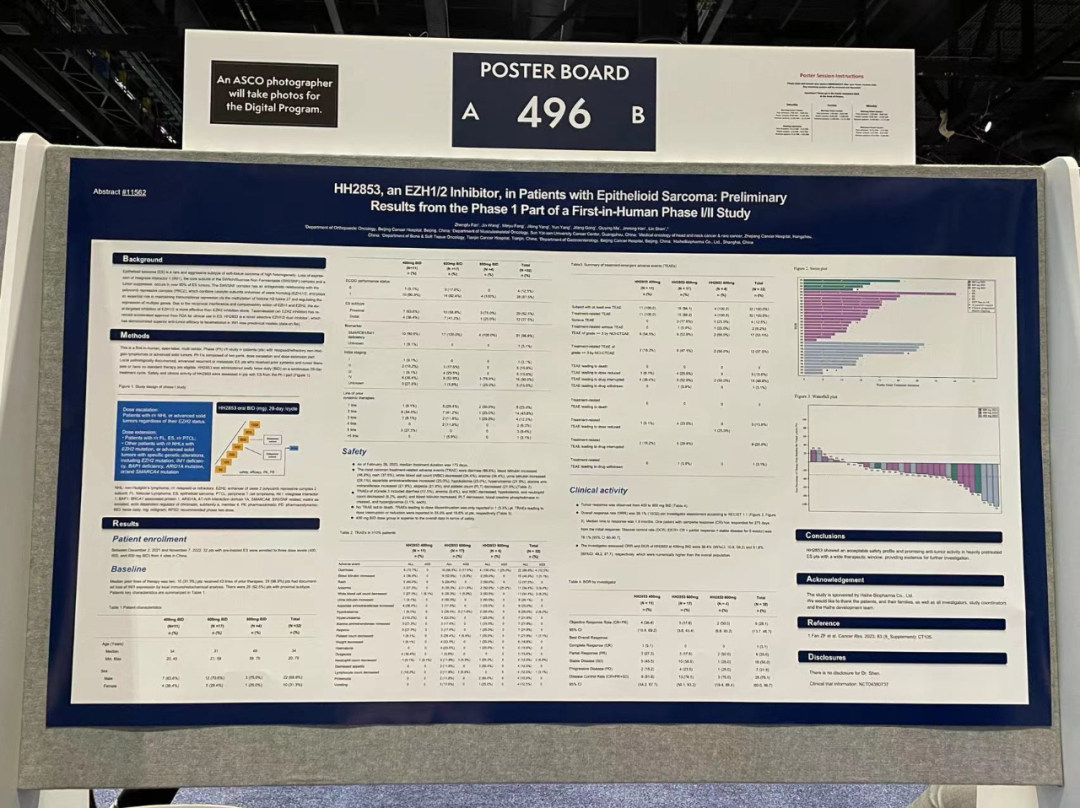
HH2853-G101是一项针对复发/难治性非霍奇金淋巴瘤或晚期实体瘤患者的首次人体、开放标签、多中心、I/II期研究。I期由两部分组成:剂量递增和剂量扩展部分。接受过系统抗肿瘤治疗或没有标准治疗的有当地病理记录的晚期复发或转移性ES患者将予入组。HH2853每天口服两次(BID),28天为一个治疗周期。本研究评估了I期部分的ES患者中HH2853的安全性和临床抗肿瘤活性。
HH2853中国临床开展情况
截图来源:药融云中国临床试验数据库
2021年12月2日至2022年11月7日期间,来自中国4个中心的32名ES患者被纳入三个剂量组(400、600和800mg BID)。前线治疗的中位数为2线。10(31.3%)名患者接受了≥3线的前线治疗。31(96.9%)名患者的当地免疫组织学报告记录了INI1表达缺失。有20名(62.5%)患者为近端型。截至2023年2月28日,中位治疗持续时间为173天,最常见的治疗相关不良事件(TRAE)是腹泻(68.8%)、血胆红素升高(46.9%)、皮疹(37.5%)、白细胞计数(WBC)降低(34.4%)、贫血(34.4%)、尿胆红素升高(28.1%)、谷草转氨酶升高(25.0%)、低钾血症(25.0%)、高尿酸血症(21.9%)、谷丙转氨酶升高(21.9%)、脱发(21.9%)、血小板计数(PLT)降低(21.9%)。≥3级的TRAE包括腹泻(12.5%)、贫血(9.4%)和白细胞减少、低钾血症和中性粒细胞计数减少(各6.2%),以及血胆红素升高、PLT降低、血肌酸磷酸激酶升高和高血糖症(各3.1%)。没有TRAE导致的死亡。导致永久停药的TRAE仅在1(3.3%)例患者中报告。分别有25.0%和15.6%的患者报告了导致剂量中断或减少的TRAE。400mg BID剂量组在安全性方面优于整体数据。
400到800mg BID剂量组都观察到肿瘤应答。根据RECIST 1.1,研究者评估的总体缓解率(ORR)为28.1%。中位至缓解时间为1.9个月。一名完全缓解(CR)的患者从最初的缓解算起已经缓解了273天。疾病控制率(DCR)(DCR=CR+部分反应+疾病稳定6周)为78.1%(95%CI:60-90.7)。研究者评估的HH2853在400mg BID剂量的ORR和DCR分别为36.4%(95%CI:10.9,69.2)和81.8%(95%CI:48.2,97.7),在数值上高于总体人群。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据库vip.pharnexcloud.com/?mh;
FDA/EMA/PMDA;
相关公司公开披露;
海和药物官网;https://english.cas.cn/newsroom/news/202303/t20230309_328020.shtml;等等。
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论