2021年6月22日,无锡药明康德新药开发股份有限公司(以下简称“本公司”)公告:通过其全资子企 业 WuXi AppTec (Hong Kong) Holding Limited 和 WuXi PharmaTech Healthcare Fund I L.P.持有 Ambrx Biopharma, Inc.(以下简称“Ambrx”)29,267,687 股 普通股,占 Ambrx 全球发售完成后总股本的 11.1%(全面摊薄基础上)。以 2020 年 12 月 31 日公司最近一期经审计的资产负债表为基础,Ambrx 账面 金额占本公司最近一期经审计归属于母公司所有者权益(或股东权益)的比 例在公允价值变动前后分别为 0.92%和 1.24%。 上述本公司持有 Ambrx 的股份划分为“以公允价值计量且其变动计入当期 损益的金融资产”,后续随着 Ambrx 二级市场公允价值波动存在的不确定 性,对本公司业绩造成的影响存在较强不确定性。
Ambrx于2021年6月18日在纽约交易所成功上市,股票代码“AMAM”,募资总额1.26亿美元。截止美国时间7月2日收盘,公司市值约7.2亿美元。(上市前,持有公司股份较大的机构有:厚朴投资(18.1%)、药明康德(13.6%)、复星(6.3%)。)

Ambrx 是一家临床阶段生物制药公司,最早成立于2003年,利用扩展的遗传编码技术平台发现并开发生物制剂。其中包括下一代抗体药物结合(ADCs)、双特异性、靶向免疫肿瘤疗法、调节免疫系统的新型细胞因子以及代谢和心血管疾病的长效治疗肽。Ambrx 正在推进一系列强大的临床和临床前计划,旨在优化多种治疗领域的疗效、安全性和易用性,包括其主要产品候选 ARX788(抗HER2单抗-AS269偶联药物,如下图)。Ambrx的核心技术-非天然氨基酸介导的定点偶联ADC技术,源自Scripps研究所Peter G Schultz教授。
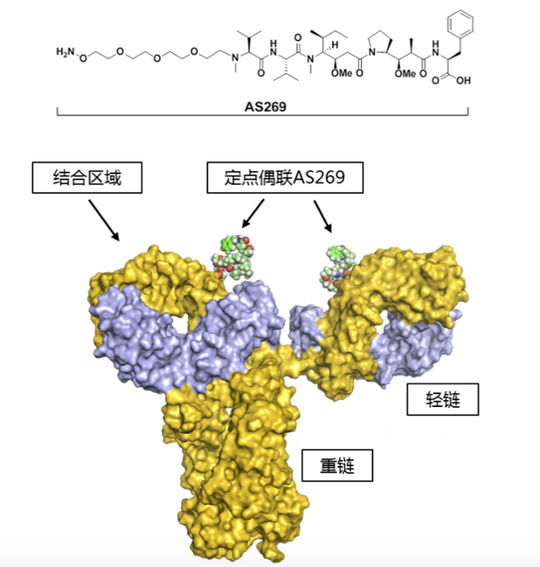
目前主要候选药物产品线
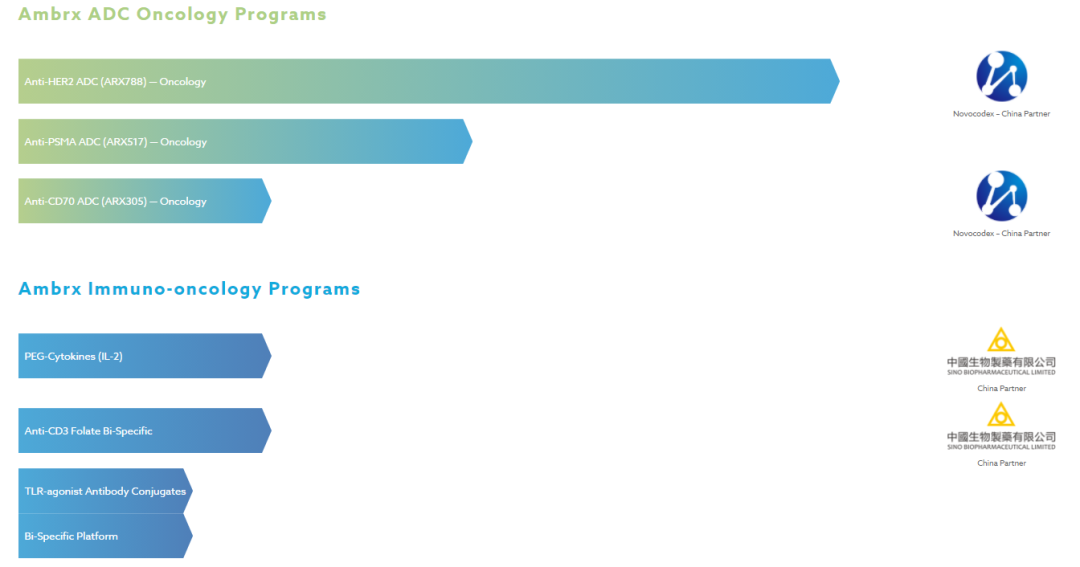
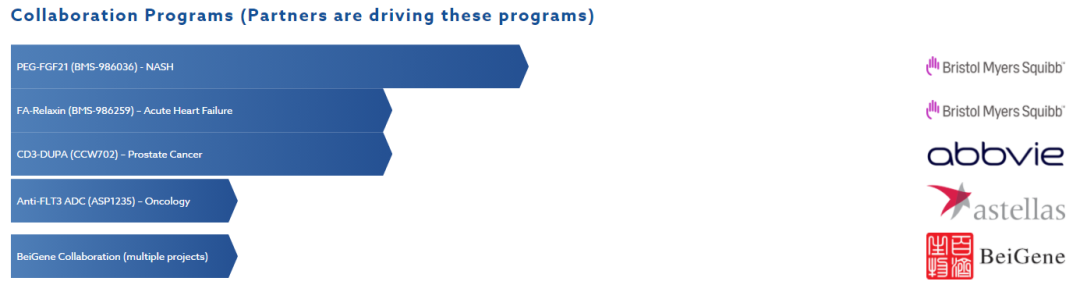
过往新药研发历程/公司进展缓慢:此前在2014 年,Ambrx 曾向纳斯达克首次提交IPO上市申请;后来由于种种原因,Ambrx 撤销了 IPO 程序,;之后,被复星医药、厚朴投资、光大控股医疗健康基金、药明康德组成的中国财团收购。(中文名,安博生物)
2016年8月,Ambrx获得4500万美元的A轮融资,由东北证券旗下医疗基金管理公司东征鼎晟联合杏泽资本领投,国药资本、光谷人福基金,以及老股东复星医药、厚朴投资和光大控股医疗健康基金跟投。
2020年11月,Ambrx完成 2 亿美元 Crossover 融资。新的投资者包括 Fidelity Management & Research Company LLC、Blackrock 旗下基金和账户、Cormorant Asset Management、HBM Healthcare Investments、Invus、Adage Capital Partners 和 Suvretta Capital Management。

新近团队介绍
公司合作伙伴中,除几大外企外,另外有多家中国的生物制药公司:浙江医药(新码生物)、百济神州、中国生物制药等等。

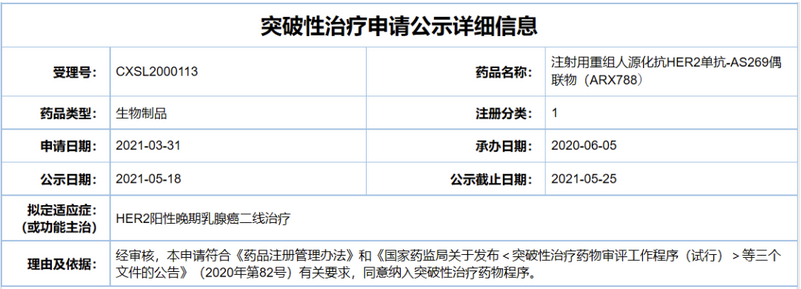
本次主要提及新码生物和在研核心品种:2021年5月18日,中国国家药监局药品审评中心(CDE)公示,由浙江新码生物医药有限公司(以下简称“新码生物”)和其母公司浙江医药股份有限公司联合申报的注射用重组人源化抗HER2单抗-AS269偶联物(ARX788)拟纳入突破性治疗品种,拟定适应症为:HER2阳性晚期乳腺癌二线治疗。
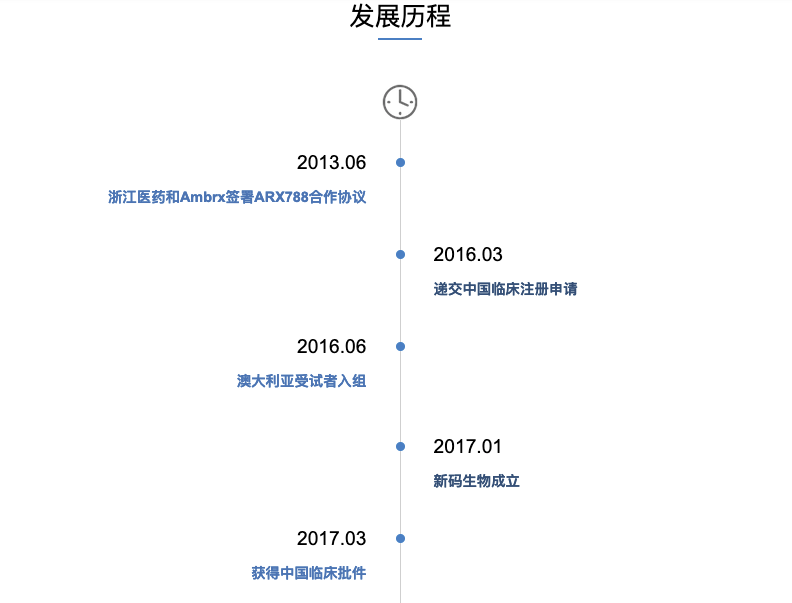
ARX788已在2021年1月获得美国FDA授予快速通道资格,用于治疗已接受过一种或多种抗HER2治疗的晚期或转移性HER2阳性乳腺癌;并于2021年3月获得FDA授予孤儿药资格,用于治疗HER2阳性胃癌和胃食道结合部癌。
ARX788的中国Ⅰ期临床研究在复旦大学附属肿瘤医院进行,胡夕春教授为PI,截止至2021.01.12,ARX788在HER2阳性晚期乳腺癌的临床数据:1)疗效显著,总ORR为47.8%(33/69),其中1.5 mg/kg Q3W(II期推荐剂量)剂量组ORR为65.5%(19/29);仍有41.4%受试者[12/29]在组;2)绝大多数不良反应为轻度到中度,与药物相关的3级以上不良反应发生率为11.6%,具有显著的安全性优势。


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论