1.1.1 总体概况
根据摩熵医药数据库统计,2025.09.29-2025.10.12期间共有86个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号68个,进口药品受理号18个。
本期共计104款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药50款,生物药54款,无中药。其中值得注意的有:
(1)HEP-50768片
9月30日,CDE官网公示:海湃泰克生物的HEP-50768片获得临床试验默示许可,拟用于治疗胆汁淤积性瘙痒。公开资料显示,HEP-50768是一款靶向MRGPRX4受体的小分子拮抗剂,通过独特的作用机制抑制胆汁淤积型的瘙痒。
(2)TLL-041缓释片
10月10日,CDE官网公示:Biohaven的TLL-041缓释片获得临床试验默示许可,拟用于治疗用于预防早期阿尔茨海默病(AD)患者淀粉样蛋白相关成像异常(ARIA)的发生。公开资料显示,TLL-041是具有通过血脑屏障能力的高选择性双靶点TYK2/JAK1抑制剂。
(3)注射用JSKN-022
10月11日,CDE官网公示:康宁杰瑞的注射用JSKN-022获得临床试验默示许可,拟用于治疗晚期实体肿瘤。公开资料显示,JSKN022是康宁杰瑞基于糖基定点偶联平台开发的一种全球首创的双靶点ADC,可同时识别并结合肿瘤细胞表面的 PD-L1与αvβ6整合素。药物与任一靶点结合后通过靶点介导的内吞作用进入到溶酶体中,可切割的连接子在组织蛋白酶B等蛋白水解酶的作用下裂解,定点释放出具有细胞毒性的拓扑异构酶I抑制剂(T01),既可直接诱导抗原阳性细胞凋亡,又可穿透细胞膜在抗原阴性细胞中触发旁观者效应,实现双重抗肿瘤效果。
本期有2款新药获批上市,包括泽卢克布仑钠注射液和莫米司特片。
10月11日,国家药监局发布药品批准证明文件送达信息:优时比申报的1类创新药泽卢克布仑钠注射液获批上市,适用于治疗重症肌无力。公开资料显示,泽卢克布仑钠是一种靶向补体C5的大环肽类新型抑制剂,可特异性结合C5,阻止C5裂解为C5a和C5b,从而防止末端补体复合物C5b-9的生成;同时可阻止C5b和C6的结合。通过双重作用防止末端攻膜复合物(MAC)的形成,有效阻止补体级联反应。
10月11日,赣州和美药业的1类创新药莫米司特片获批上市,适用于治疗斑块状银屑病。公开资料显示,莫米司特片是一款磷酸二酯酶4(PDE4)小分子抑制剂,可通过调节细胞内cAMP和/或cGMP水平控制下游多种炎症因子的产生,在多种炎症相关疾病中均有不错的治疗效果。
1.1.2 本期获批临床创新药/改良型新药信息速览(不含补充申请)
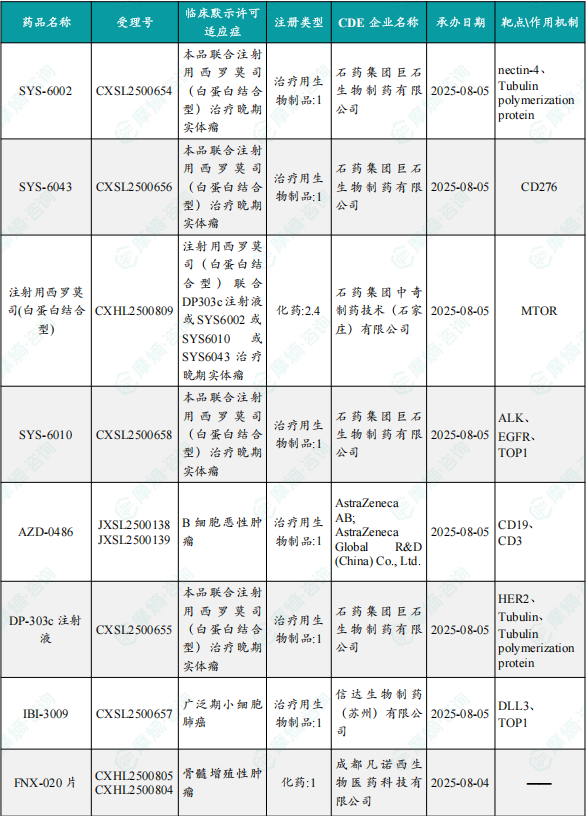
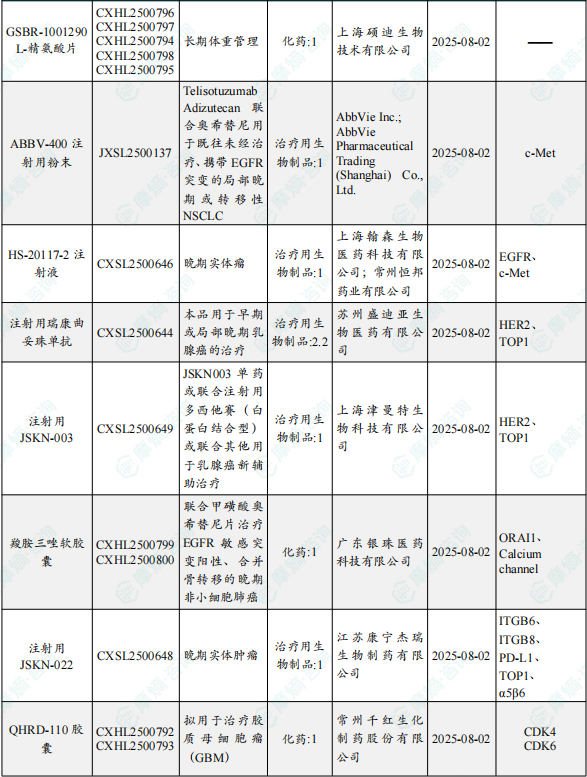
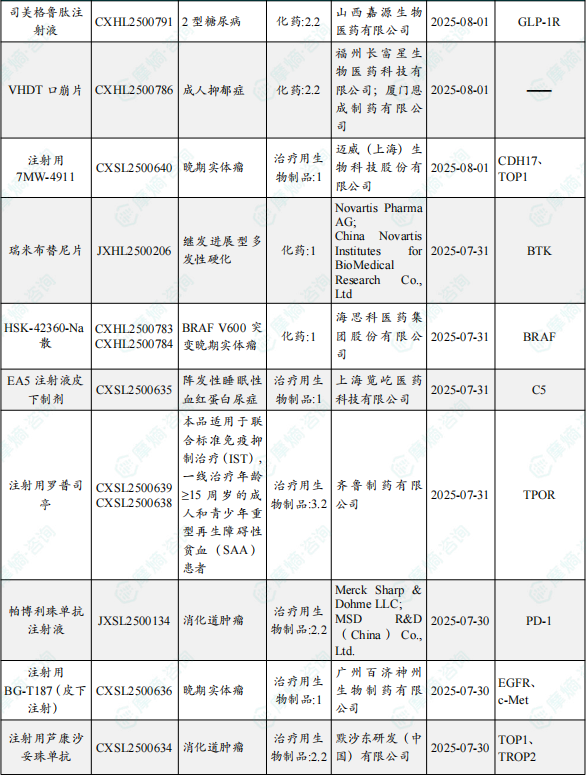
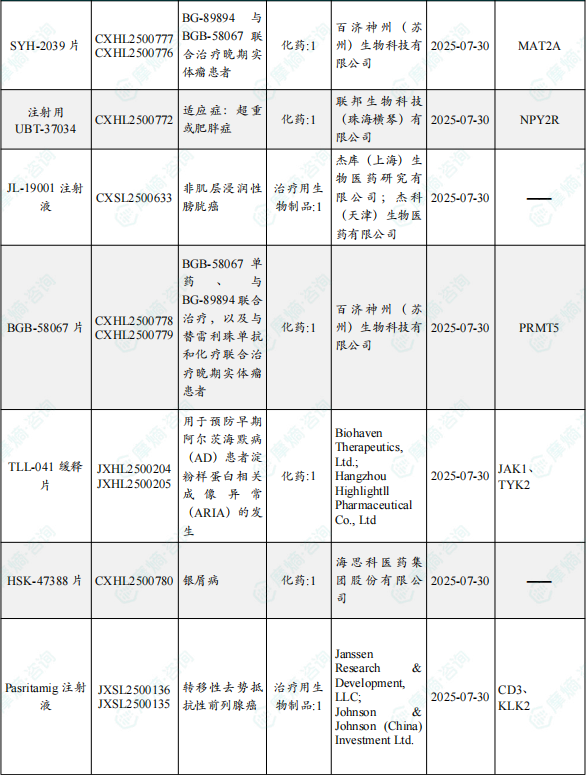
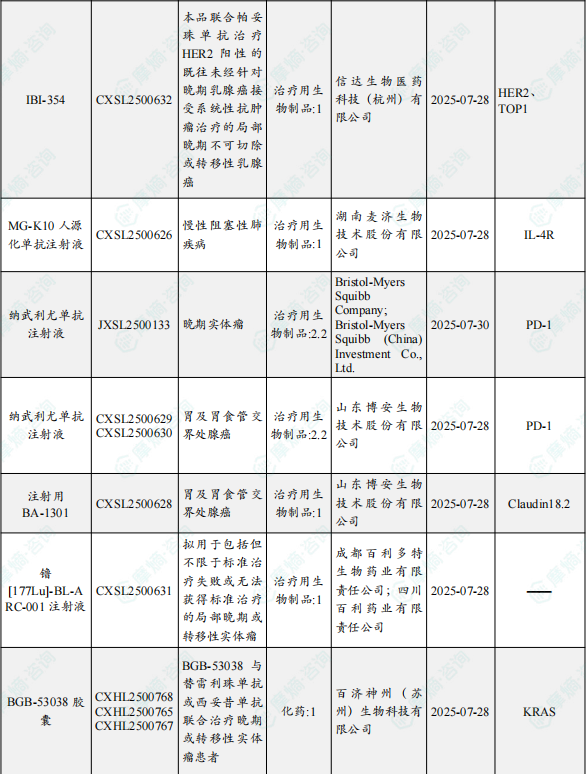
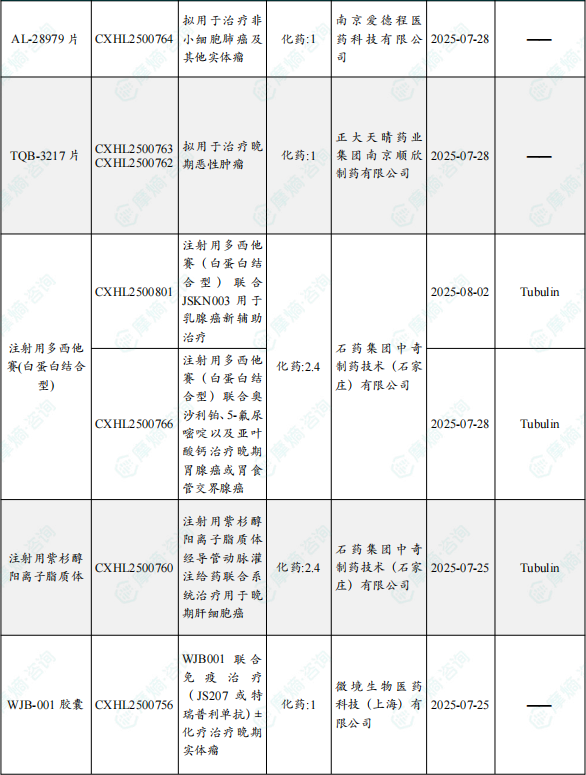
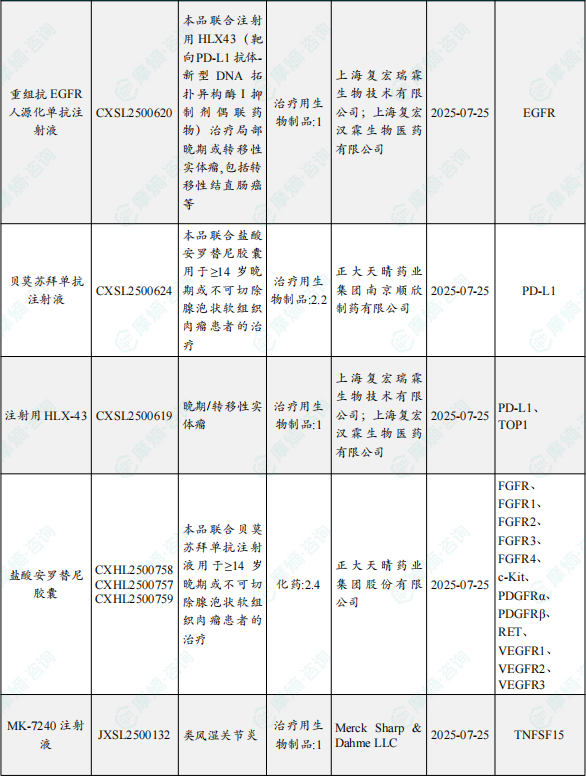
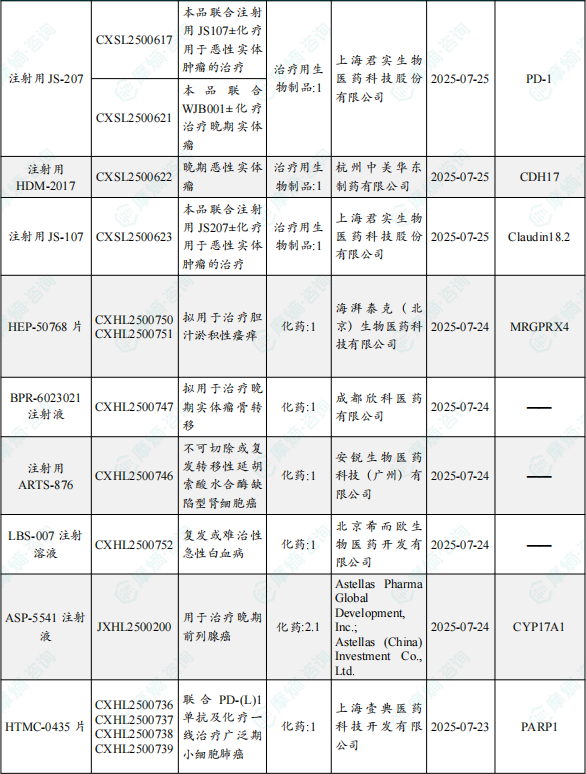
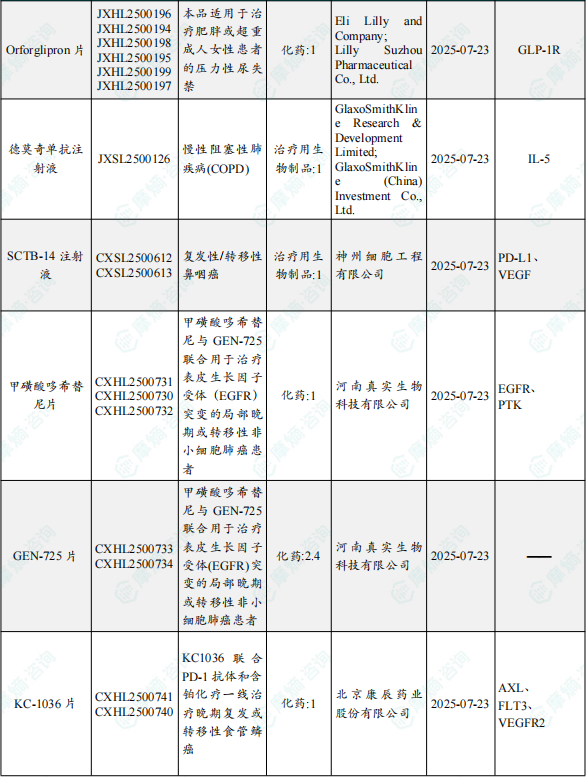
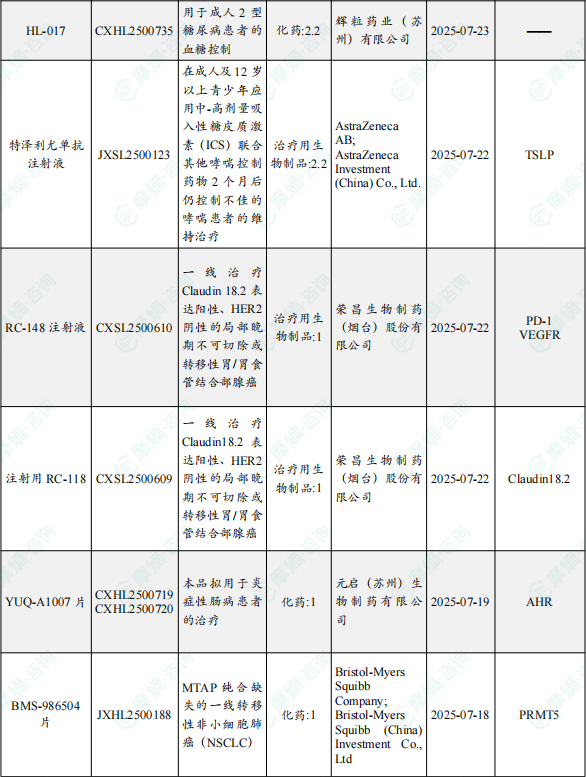
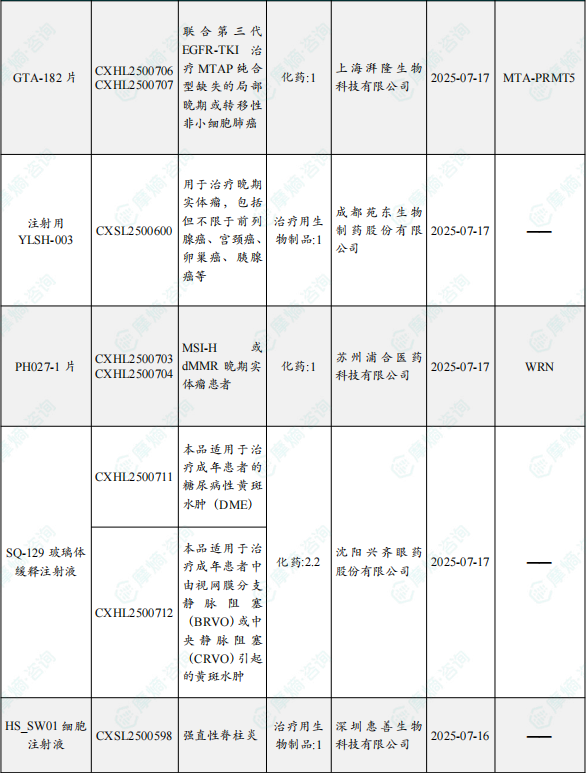
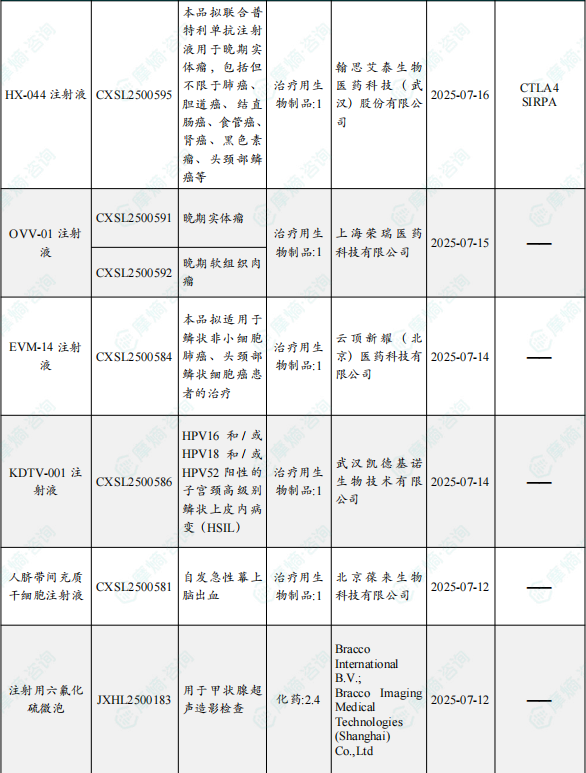
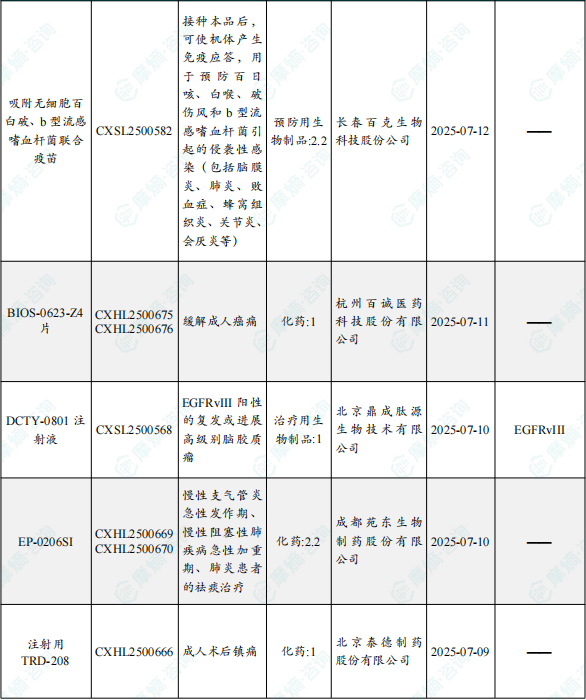
备注:(1)此处未包括补充申请之情形;(2)此处所列创新药/改良型新药,主要是指CDE受理批准的1类、2类、5.1类以及生物制品3.1类和3.2类。(3)更多获批临床信息及研发进展详情及相关靶点全局分析等,可通过摩熵中国药品审评数据库获取并下载EXCEL表格。
1.1.3 本期获批上市创新药信息速览
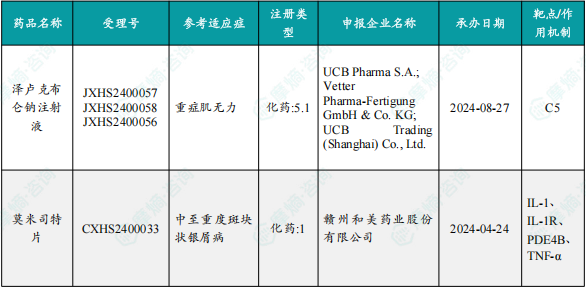
备注:(1)此处所列新药,主要是指国家药品监督管理局(NMPA)首次批准在中国上市的药品,包括新分子实体(以及包含有新分子实体的复方)、生物药、中药和疫苗。其中,新分子实体主要是化药注册分类下的1类(境内外均未上市的创新药)、5.1类(境外上市的原研药申请在国内上市);生物药主要为NMPA首次批准的国产及进口生物药;不包括生物类似物、新适应症、新剂型。(2)更多信息如获批临床品种相关靶点、研发企业、全球上市及研发进展及相关靶点全局分析等,可通过摩熵医药数据库获取并下载EXCEL表格。
同期事件:
1. 2025年第40-41周09.29-10.12国内仿制药/生物类似物申报/审批数据分析
2. 2025年第40-41周09.29-10.12国内医药大健康行业政策法规汇总
3. 2025年第40-41周09.29-10.12全球创新药研发概览
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.09.29-2025.10.12) },如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论