1.3.1本期国内医药大健康行业政策法规速览
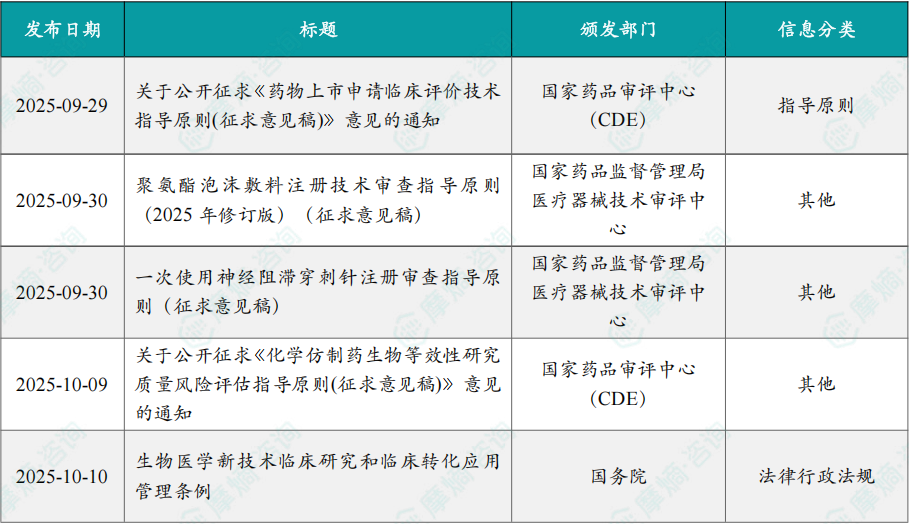
1.3.2本期重点行业政策详细说明
(1)国家药监局发布《药物上市申请临床评价技术指导原则(征求意见稿)》
9月29日,国药监局药品审评中心组织起草了《药物上市申请临床评价技术指导原则(征求意见稿)》,以期促进有临床价值的新药研发上市。
药物上市申请临床评价是创新药全生命周期获益-风险评估的关键内容。为更好地指导评价者对药物上市申请中临床安全性、有效性、获益-风险进行科学、规范、高效的评价,让申请人了解临床评价的关键考虑,指导申请人科学研发以期促进有临床价值的新药研发上市。本指导原则提供了不同疾病领域在探索其未被满足的临床需求时所遵循的共同原则,将药物上市所必须开展的有效性、安全性评价的循证逻辑链加以结构化,并把各个结构单元采集、分析数据和相关信息的要求以及相关的关系加以明确。本指导原则仅代表药品监管部门当前的观点和认知。随着医学科学和临床试验的发展,本指导原则中的相关内容将不断完善与更新。如有未能涵盖的问题,可与监管机构进行沟通。
(2)《生物医学新技术临床研究和临床转化应用管理条例》正式发布
10月10日,据新华社,国务院总理李强日前签署国务院令,公布《生物医学新技术临床研究和临床转化应用管理条例》,自2026年5月1日起施行。该条例是我国首次以国务院行政法规的形式,为生物医学新技术的研发、临床研究与临床转化建立全国统一的法律框架。此外,该条例的出台也标志着中国在细胞治疗、基因编辑、再生医学、组织工程等前沿领域的管理正式从“试点政策”迈入“制度化治理”新阶段,为创新成果安全、合规地进入临床应用提供了明确路径。条例共7章58条,旨在规范生物医学新技术临床研究与转化应用,促进医学进步,保障医疗质量安全,维护人的尊严和生命健康。涵盖了生物医学新技术从临床研究到临床转化应用的全过程管理。
同期事件:
1. 2025年第40-41周09.29-10.12国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第40-41周09.29-10.12国内仿制药/生物类似物申报/审批数据分析
3. 2025年第40-41周09.29-10.12全球创新药研发概览
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.09.29-2025.10.12) },如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论