最近频繁看到关于进口原研药退出的中国内容,比如“大量进口原研药退出中国市场”、“部分罕见病无药可医”、“罕见病唯一药物唯铭赞退出中国”等,但事实是真的如此么?有可能是既得利益者买稿造势吗?而中国每年新增的进口药又是多少呢?
【中国进口药品获得批准情况】
根据摩熵医药数据库统计,在2016年至2019年间,中国每年进口药品批文数量呈增长趋势,在2020至2022年间呈递减趋势,而到了2023年至2024年,中国每年进口药品批文数量基本维持在740个左右。可以看出,在进口药引进的数量上近5年相较于前5年有一定数量的下降,但波动值正常。

图源:摩熵医药-中国药品批文数据库
【中国进口药品退市情况】
还是根据摩熵医药数据库的统计,1994年3月13日至2025年5月7日中国进口药品批文数量为21894个,正在使用的有3168个,已过期18726个,首次注册19578个,再注册2316个。可以看出,仅有10%的进口药品到期后进行了再注册,所以大家会感觉到陆陆续续有很多进口原研药退出中国市场,注意,这里都是注册有效期时间到了,药企被动退出,而非主动退市,毕竟谁这么大的蛋糕,好不容易挤进来,谁又会愿意吃两口就走了呢?
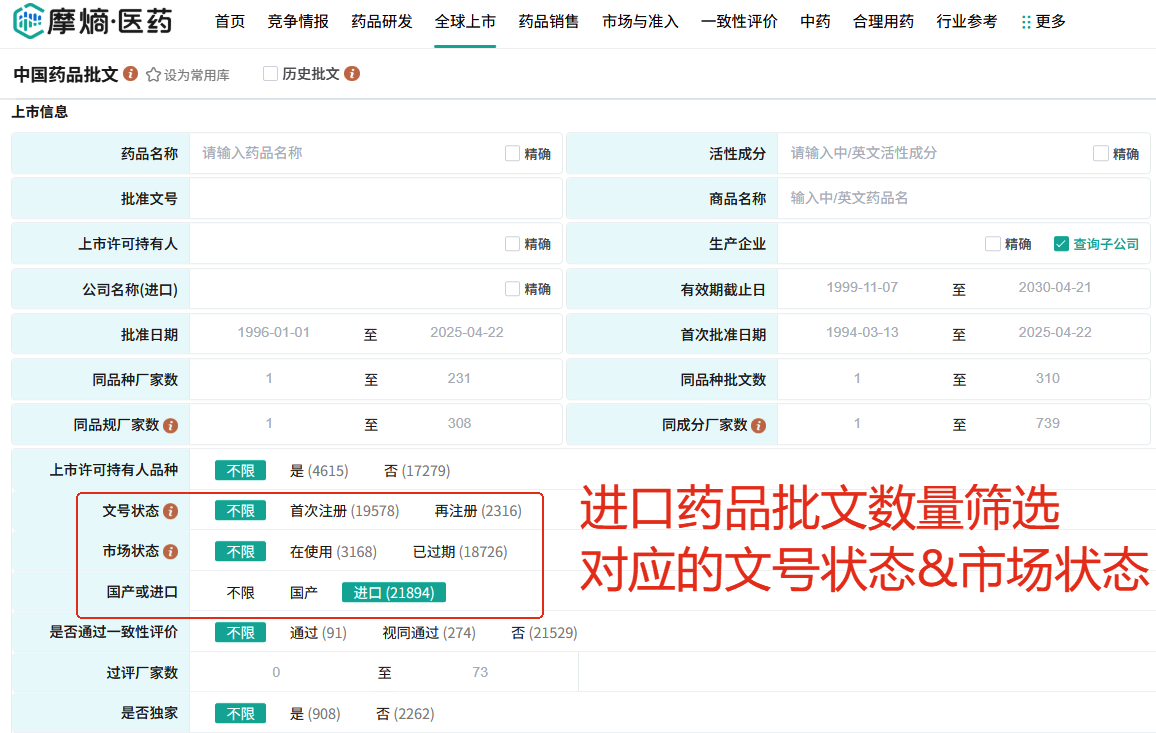
【为什么进口药品企业不对其药品再注册?】
对于进口药注册证到期未续的原因无非两点,一是利益与风险考量,二是进口药品再注册问题望而却步。
成本效益分析 :一些进口原研药的生产企业在药品注册证到期后,基于成本效益分析,认为续签注册的成本过高、仿制药价格竞争激烈、市场份额被挤压、集采政策或者续签后的市场收益难以覆盖成本,从而选择不再对其选择再注册,以优化产品结构,导致其退出中国市场。
再注册准入问题 :我国的药品监管政策较为严格,对于进口药品再注册不符合标准情况下,难以通过再注册。如药品经上市后评价不好、注册证过期、药品质量标准、生产工艺等要求发生变化,如无法满足这些新的技术要求,进而无法通过再注册。特别是境外申请人办理进口药品再注册,应当由其驻中国境内的办事机构或由其委托的中国境内代理机构办理,即进口药品的注册代理机构只能是境外制药厂商(即持证商)在中国境内的直属办事机构,或是受持证商委托的具有法人资格的代理机构,其他机构不得作为注册代理机构进行进口药品再注册申请工作。
【正在销售的3000+个进口药品,都在哪里去了?‘消失’了么?】
根据摩熵医药数据库的统计,正在使用的进口药品批文数量达3168个,为什么我们平时依然很难遇见,这些进口药真的都消失了么?
这些进口药,并非物理意义上的消失了,它们只是被驱赶到“另一个世界”。想要在医院里开进口药比较难,但绝大部分进口药在大一点的药房或电商平台都能买得到的,甚至是中国未引进药物通过海外代购也是能搞到的,只不过这些需要自费而已。
其实很好理解,因为站在医院的角度,它在国内充当什么样的角色?需要承担的社会什么责任?仔细一下就能明白。要知道卖药基本是没有利润的,反而需要承担药品采购、存储等成本。多开进口药医院只会造成医院亏损更多,医院生存困难,医护技术人员的收入都得不到基本保障,自然树倒猴孙散。而通过开集采药品节约的医保资金可以比例返还给医院作结余留用资金,这可是“真金白银”的吸引力,你来运作医院你会怎么选?
【罕见病神药“唯铭赞”在中国获批上市不到四年,为何要退市?】
上面这句话可谓耸人听闻,别有用心!“唯铭赞”是一款治疗黏多糖贮积症IVA型的孤儿药,根据凤凰网报道,该病患人群在国内100人左右,而上市近四年使用患者不足30人,究其退市原因无非就是收入没有达到预期。要知道唯铭赞于 2019 年 5 月在中国获批上市,《进口药品注册证》的有效期为5年,已于 2024 年 5 月正常到期退市了,当时药方是眼看进医保集采无望,所以才提前1年宣布不再为其续期,并非提前退市,本是正常商业止损现象(也算是走之前恶心一下医保),被谣言传为了4年不到就要提前退市,这样“别有用心”的拿来频繁炒作,无非是想挑起舆论,达到某种目的而已(向财政支持机构施压?又或者挑燃政府与民众的敌对情绪?)。
相似的内容还有“近多少年,已有数多少款进口原研药物宣布退出国内市场”、“部分罕见病唯一用药的退出,让部分患者出现无药可用的困境”等,这些煽动性内容导致患者、制药厂商和第三方财政支持机构之间矛盾加剧,虽然患者是最弱势方,但不要轻易被其它人当枪使。





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论