偏差、OOS、异常 像雾像雨又像风
分析过程中涉及环节较多,人为操作环节也多,所以在实验室发生的偏差、OOS/OOT、异常机率也随之增加。实际工作中,很多人员对于实验室内的偏差、OOS/OOT、异常不能有效识别和区分,发生后是该走OOS调查呢?还是要走偏差调查?还有一些异常状况,不属于OOS、也没有偏离文件要求,该走什么流程调查或者怎么样才能把这些情况记录下来,确保实验室数据可靠性符合要求,确保这些“事情”、“现象”、“数据”可追溯呢?有没有傻傻分不清楚的感觉呢?老王在此分享一下实验室常见的偏差、OOS/OOT、异常的有效识别和区分以及这三者的关系及其应用。
药事纵横
临床应用和临床试验中的脂质体纳米粒(四):基因治疗
脂质体纳米粒在临床应用方面取得了极大的成功。无论是小分子药物领域已经上市了二十余款制剂,还是近期的RNA疫苗研制中发挥的关键作用,都显示出脂质体在药物应用领域的巨大潜力。该篇综述聚焦于脂质体纳米粒在临床中的应用。本文为第四部分,概述了脂质体纳米粒在基因治疗方面的应用。
药事纵横
临床应用和临床试验中的脂质体纳米粒(三):药物递送
脂质体纳米粒在临床应用方面取得了极大的成功。无论是小分子药物领域已经上市了二十余款制剂,还是近期的RNA疫苗研制中发挥的关键作用,都显示出脂质体在药物应用领域的巨大潜力。该篇综述聚焦于脂质体纳米粒在临床中的应用。本文为第三部分,详述了已上市或处于临床试验中的递送药物脂质体。
药事纵横
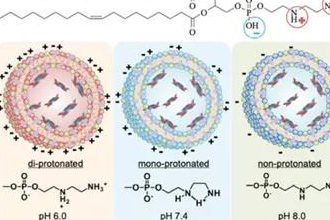
临床应用和临床试验中的脂质体纳米粒(二):结构性质
脂质体纳米粒在临床应用方面取得了极大的成功。无论是已经上市了二十余款小分子给药系统制剂,还是近期RNA疫苗研制中发挥的关键作用,都显示出脂质体在药物应用领域的巨大潜力。该篇综述我们首先对脂质纳米粒及其结构性质关系进行概述,然后聚焦于脂质体纳米粒在临床中的应用。本文为第二部分,概述了影响脂质体性质的结构因素。
药事纵横
辉瑞:“立普妥”的成功之路
截至2011年11月阿伐他汀仿制药在美国上市,“立普妥”创造了14.5年共1250亿美元销售记录,阿伐他汀成为医药史上第1个“超级重磅炸弹”,即年销售额过百亿美元的药物,并连续7年维持百亿美元水平。完成了同靶点第五个上市的后来者到医药史上最畅销药物的飞跃,看看Pfizer是如何淋漓尽致的发挥从而创造医药史上的奇迹。
药事纵横
前列腺癌大市场:恩扎卢胺,首款仿制药中国开卖
恩扎卢胺由安斯泰来和美国Medivation 联合开发,2012年8月获美国FDA批准上市,用于治疗晚期去势抵抗前列腺癌。2016 年 8 月辉瑞收购 Medivation 将该品种收入囊中。2021年8 月 ,NMPA批准豪森药业的恩扎卢胺软胶囊的首家仿制药上市。目前,本品仿制药还有齐鲁制药、科伦药业、沈阳红旗制药以仿制4类提交上市申请在CDE审评审批中。
药融圈
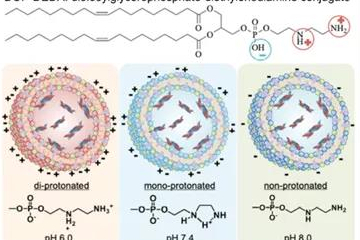
临床应用和临床试验中的脂质体纳米粒(一):脂质体概述
脂质体纳米粒在临床应用方面取得了极大的成功。无论是已经上市了二十余款小分子给药系统制剂,还是近期RNA疫苗研制中发挥的关键作用,都显示出脂质体在药物应用领域的巨大潜力。该篇综述首先对脂质纳米粒及其结构性质关系进行概述,然后聚焦于脂质体纳米粒在临床中的应用。
药事纵横
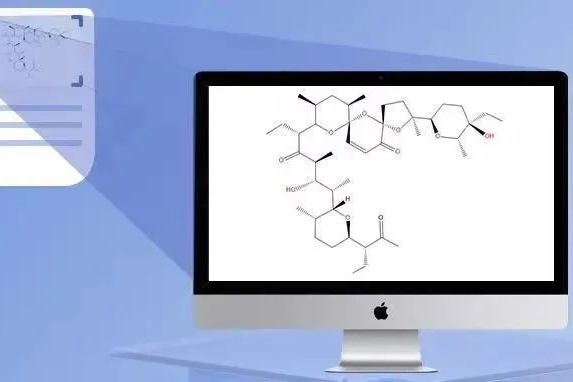
为什么同样复杂的化学结构,我画2分钟,别人1秒就画完了?
StoneMIND Collector,简称Collector,由国内AI制药企业北京望石智慧科技有限公司开发,于2021年9月正式推出Windows & MacOS版本;Collector基于OCSR(化学结构识别)和IUPAC(标准化学名称识别)技术,能从专利、文献及各类图片中截屏提取或批量上传文件提取化学结构,并将提取的结果导出为计算机可读的格式(sdf/mol/smiles/xls),节省科研工作者绘制化学结构时间并快速搭建自己的化学信息数据库,所有用户均可下载免费使用该产品。
药融圈














































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息