今日,CDE公布显示,腾盛博药联合治疗乙肝(HBV)新药BRII-179 (VBI-2601) 注射液、BRII-835 (VIR-2218) 注射液II期临床申请获受理。目前尚无有效的HBV感染治愈疗法,而腾盛博药,联合使用HBV特异性B细胞及T细胞治疗性免疫蛋白(BRII-179)以及靶向HBV的siRNA(BRII-835),该疗法为一种高度创新的新型疗法,是一项重大进步,有望带来治愈的可能。
腾盛博药—主攻乙肝功能性治愈
腾盛博药腾盛博药成立于2018年5月。专注于传染病、肝脏和肺部疾病、COVID-19和HIV等疾病领域的创新药物研发及商业化。4月8日向港交所主板递交上市申请。截止目前共进行过3次融资:
2018年6月,A轮融资2.59亿美元;
2020年8月,完成B轮融资,共计1.72亿美元;
2021年3月23日,完成1.55亿美元的C轮融资。
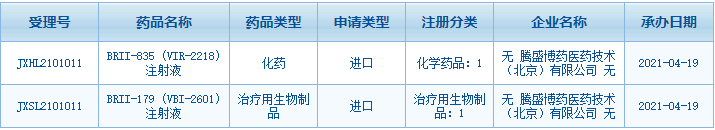
腾盛博药已建立一条针对传染病及CNS疾病的由10多个创新候选产品组成的管线,涵盖临床前到临床阶段项目。核心候选药物为治疗乙型肝炎病毒、人类免疫缺陷病毒HIV等传染病药物。
- 乙型肝炎(HBV): BRII-835(VIR-2218)和BRII-179(VBI-2601)在慢性乙肝患者中联合疗法的2期研究进行中。
- 新冠肺炎(COVID-19)抗体疗法:BRII-196和BRII-198为非竞争性新型冠状病毒(SARS-CoV-2)中和抗体,该疗法是ACTIV-2主研究方案下一项2/3期研究的一部分,由美国国立卫生研究院(NIH)下属的国家过敏和传染病研究所(NIAID)主导。
- 多重耐药革兰氏阴性细菌感染:BRII-636(OMNIvanceTM)、BRII-672(ORAvanceTM)和BRII-693(QPX-9003)是针对WHO认定的重要病原体有效的抗生素,用于治疗产生碳青霉烯酶的肠杆菌,铜绿假单胞菌和鲍氏不动杆菌。
- 艾滋病(HIV)新治疗选项 — 每周口服单片方案(QW STR):BRII-778的1期临床试验已经开始,BRII-732的美国临床试验申请已经在今年三月递交。公司将探索为艾滋病感染者提供延长给药间隔的治疗方案。
- 中枢神经系统疾病(CNS)的新疗法:BRII-296在美国的1期临床试验已获美国临床批件,即将开始。
BRII-179 (VBI-2601)—基于
重组蛋白质的免疫疗法
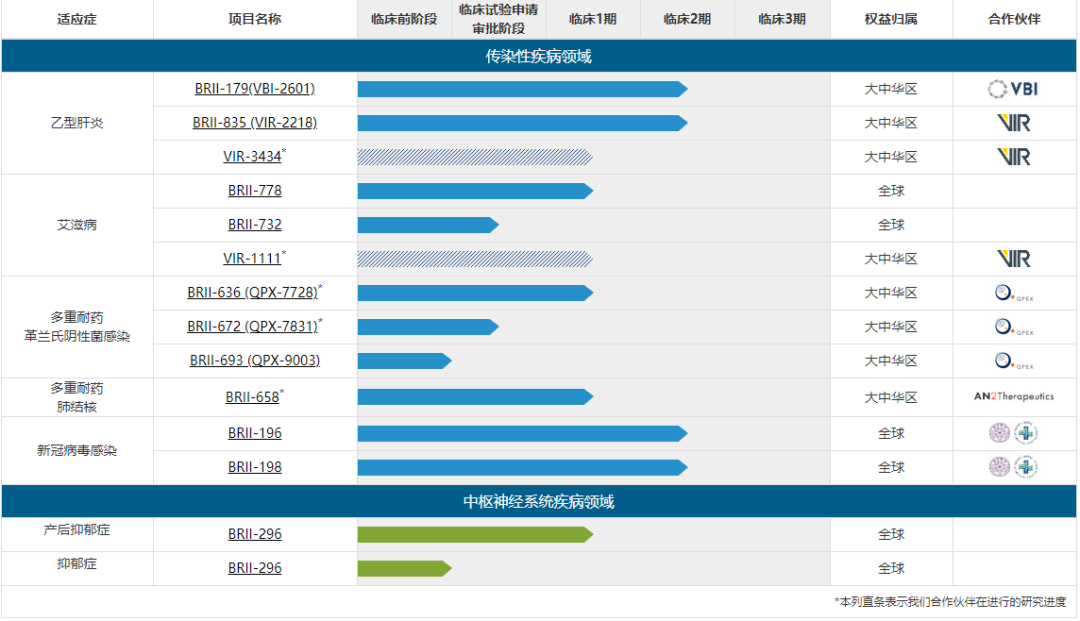
BRII-179(VBI-2601)拥有独特配方,可以通过多种作用机制同时靶向B细胞与T细胞,包括中和循环中的乙肝病毒,阻断肝细胞遭受由Pre-S1介导的乙肝感染,促进针对被乙肝病毒感染的肝细胞进行免疫介导清除。目前,许多其他在研药物主要在受感染的肝细胞内部针对病毒转录下游环节起作用,而BRII-179(VBI-2601)影响乙肝病毒生命周期中关键的细胞外步骤,从而恢复人体对感染的免疫控制能力。
BRII-179 (VBI-2601)是VBI Vaccines公司开发的一款处于临床研究阶段的新型重组蛋白免疫治疗候选药物,腾盛博药在2018年获得了该药物的大中华地区授权目前,腾盛博药已在中国、新西兰、澳大利亚、泰国和韩国完成BRII-179的1b/2a期临床研究
BRII-835(VIR-2218)
—小干扰RNA(siRNA)
BRII-835(VIR-2218)是一种全新探索性的RNA干扰疗法(RNAi疗法),用于抑制所有HBV蛋白的表达水平,包括乙型肝炎表面抗原(HBsAg)的表达水平。病毒蛋白水平下降可能有助于恢复患者自身针对乙型肝炎病毒感染的免疫应答,从而有可能对慢性乙肝病毒携带者实现功能性治愈。研究显示,BRII-835能够抑制所有HBV蛋白的表达,包括乙型肝炎表面抗原(HBsAg)最初这款新药源自Alnylam Pharmaceuticals,后授权给Vir Biotechnology公司进行临床开发,腾盛博药于2018年底引进该疗法,并将负责其在中国的临床开发。
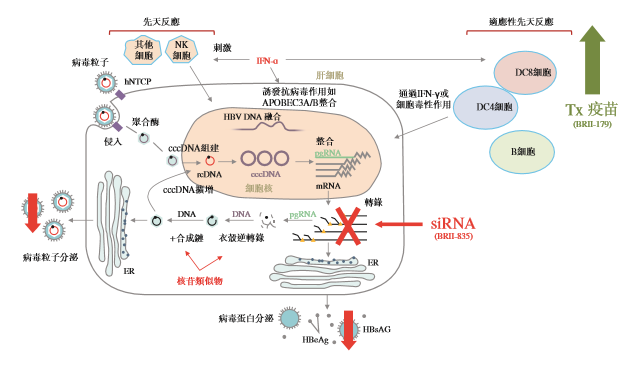
BRII-179及BRII-835拥有不同的作用机理,从而最大程度地发挥抗病毒与宿主保护性免疫应答的协同作用。这两款产品通过具有科学差异性的联合疗法有望成为治疗慢性HBV感染的功能性治愈疗法,可能为中国HBV患者带来更高的治愈率。腾盛博药已于2021年3月在新西兰就BRII-179/BRII-835的2期多区域临床试验(MRCT)联合研究启动患者筛选,并预计于2021年第二、第三季度在中国、澳大利亚、新加坡、泰国、韩国等地进行MRCT研究。
BRII-179及BRII-835联合疗法的作用机制
中国乙型肝炎(HBV)市场现状
乙肝是由乙型肝炎病毒(hepatitis B virus, HBV)引起的以肝脏炎症和坏死病变为主的一种感染性疾病,是法定乙类传染病,具有传染性较强、传播途径复杂、流行面广泛、发病率高等特点;部分乙型肝炎患者可演变成慢性,并可发展为肝硬化和原发性肝细胞癌。根据国际权威医学杂志《柳叶刀》发布的论文,在2017年中国人十大死亡原因中,肝癌排到第五名。科学研究证明,我国80%的肝癌和乙肝相关,乙型肝炎仍是威胁人们健康的“重要杀手”。
截至目前,在中国或世界上任何其他地方尚无治疗HBV的高度有效的疗法,感染者很少能得到功能性治愈,因此多数患者需要终身服用药物。一旦感染,慢性HBV感染可导致严重的健康问题,如肝硬化、肝功能衰竭和肝癌。
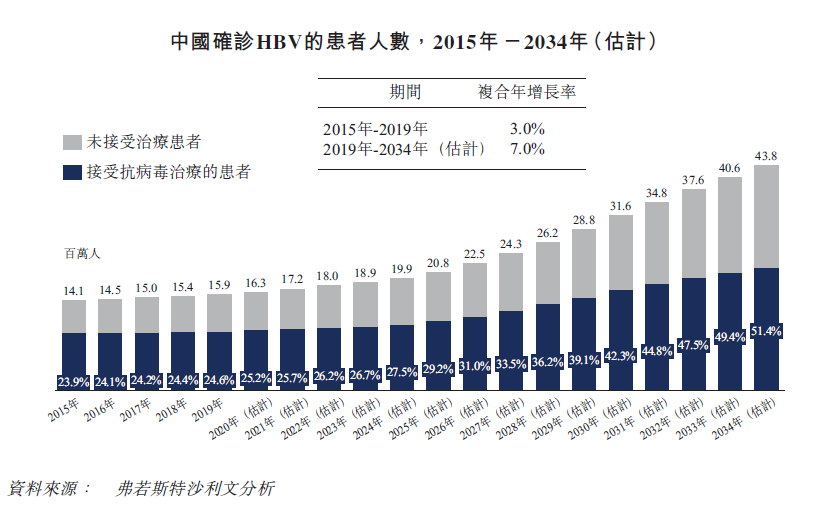
中国庞大的患者群体HBV具有需求未得到满足的庞大的患者群体。2019年,中国感染HBV的总人数达到7260万。2019年,中国HBV相关的肝癌和肝硬化死亡人数分别约为11.7万人及4.22万人。
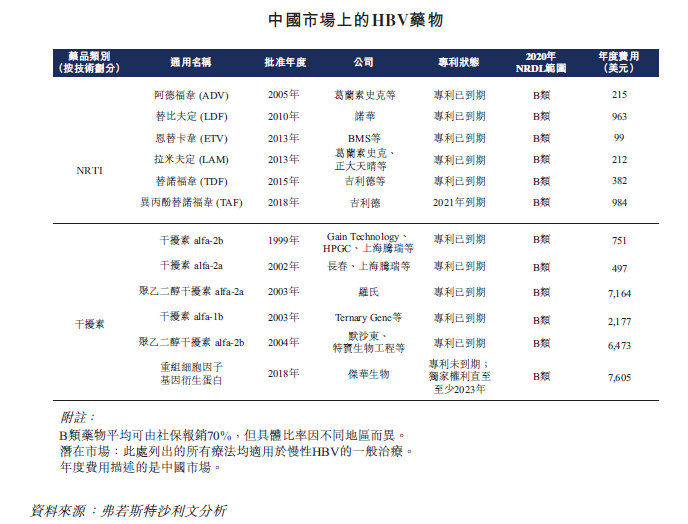
已上市乙肝核心药物
HBV抗病毒药物分为口服核苷类(NRTI)和干扰素。在我国,由于这两类药物的原研药就已经有很多家生产。目前国内有六款NRTI产品上市,除了异丙酚替诺福韦2021年专利期到期以外,其他的全部专利到期;国内也有六款干扰素产品上市,其中五款专利期也已经到期。
现有药物长效干扰素、核苷类药物均无法实现彻底治愈。干扰素包括普通干扰素Intron (IFN-α-2b)和两款长效聚乙二醇干扰素Pegintron (Peg IFN-α-2b)、Pegasys (PegIFN-α-2a)。普通IFN-α治疗慢性乙型肝炎患者具有一定疗效, 而PegIFN-α能取得相对较高的HBeAg血清转换率、HBV DNA抑制及生化学应答率。
核苷类似物主要包括拉米夫定、阿德福韦、恩替卡韦、替比夫定、替诺福韦二吡呋酯以及富马酸丙酚替诺福韦等,富马酸替诺福韦酯(TDF)和丙酚替诺福韦(TAF)的上市,有效提高了乙型肝炎的病毒抑制率,大幅改善了治疗耐药的问题。TDF和TAF分别是吉利德于2008年和2016年获批的乙型肝炎治疗药物,TAF是TDF的改良版,改善了长期服用TDF可能对肾脏和骨密度造成损伤的问题。
现有乙型肝炎治疗药物中,TAF的疗效最优,副作用最小,可以达到60%以上的HBV DNA转阴率。






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论