注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及)。因水平有限,错误不可避免,或有些信息非最及时,欢迎留言指出。
PD-1/LAG-3双抗,肝癌
2021年7月2日,罗氏(F. Hoffmann-La Roche Ltd.)开发的RO7247669注射液在中国首次申请IND(临床试验申请),获得我国CDE受理(JXSL2101059)。本品是一款新型PD-1/LAG-3双特异性抗体,全球范围内正在开展1/2期临床试验,涵盖的拟开发适应症有:晚期肝细胞癌、转移性黑色素瘤、非小细胞肺癌、食管鳞状细胞癌、转移性食管癌等。
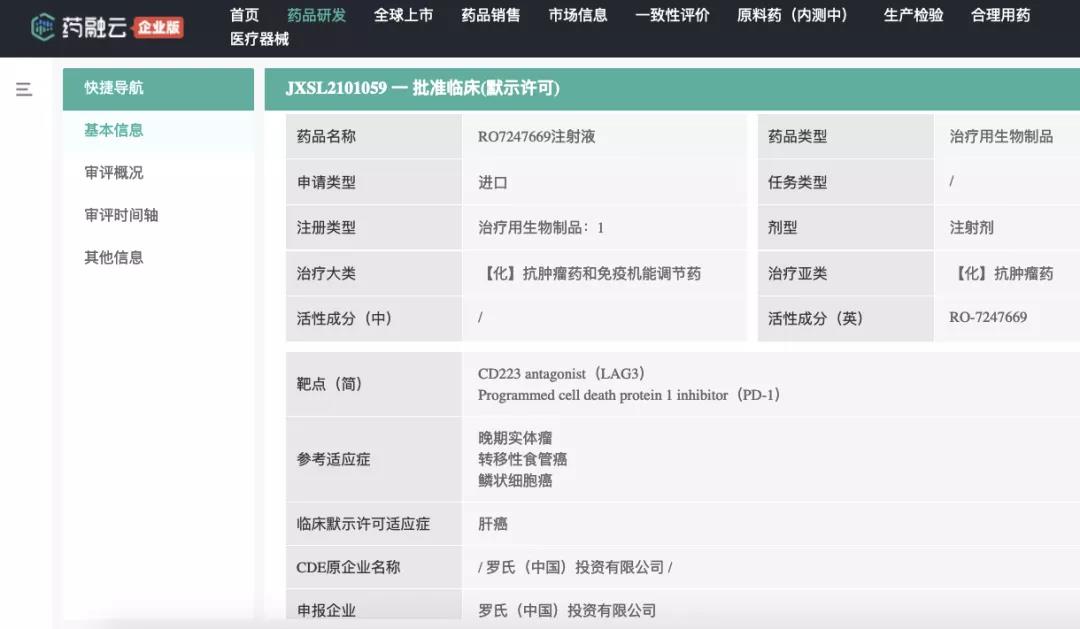
药融云数据(www.pharnexcloud.com)显示,近期RO7247669注射液肝癌适应症率先在中国获批开展临床。
LAG-3布局
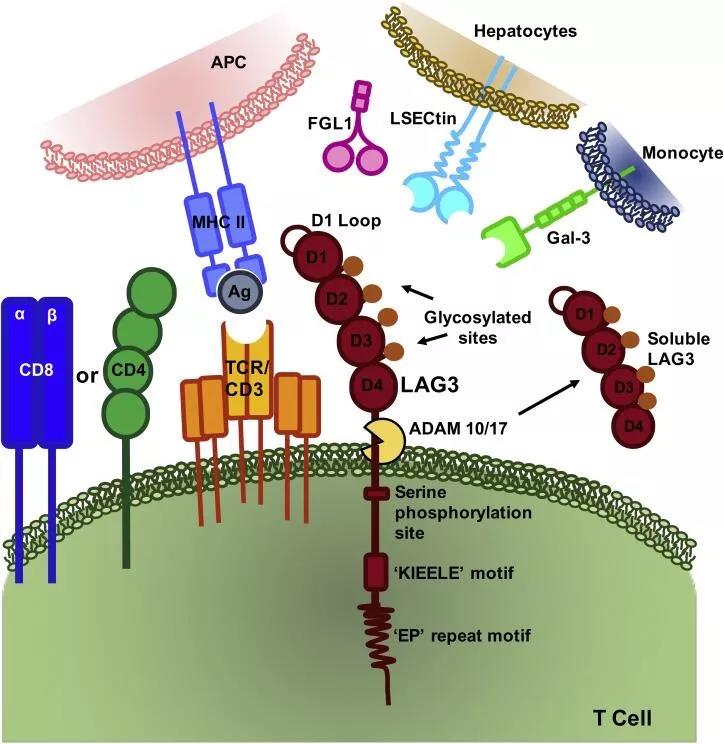
LAG-3(lymphocyte activation gene 3)全称为淋巴细胞激活基因-3(又称为CD223)。LAG-3在T细胞活化、增殖和体内稳态的调节中发挥重要作用。抑制LAG-3能让T细胞重新获得细胞毒性活性,降低调节T细胞抑制免疫反应的功能,从而增强对肿瘤的杀伤效果。在衰竭的T细胞中,研究者们初步发现,LAG-3常常与PD-1共表达,这对PD-1抗体耐药的肿瘤侵润T细胞表达LAG-3,显著地高于不耐药的肿瘤侵润T细胞。因此,在研的肿瘤疗法包括LAG-3抗体与PD-1抑制剂的联合用药,也有靶向PD-1和LAG-3的双特异性抗体等等。
LAG-3与PD-1联合用药疗法目前积极临床数据有:BMS的Relatlimab联合纳武利尤单抗(O药,Nivolumab)对照纳武利尤单抗单药一线治疗晚期黑色素瘤的RELATIVITY-047 2/3期临床研究中,中位随访时间为13个月,中位无进展生存期(mPFS)在联合用药组(10.1个月[95% CI: 6.4-15.7])显著优于对照组(4.6个月[95% CI: 3.4-5.6];风险比为0.75 [95% CI: 0.6-0.9]; p=0.0055)。不过,本次小规模临床试验,严重不良事件在联合用药组比单药组更常见(19% vs 10%),治疗相关毒性导致的停药也是如此(15% vs 7%)。治疗相关性死亡分别为3和2例。
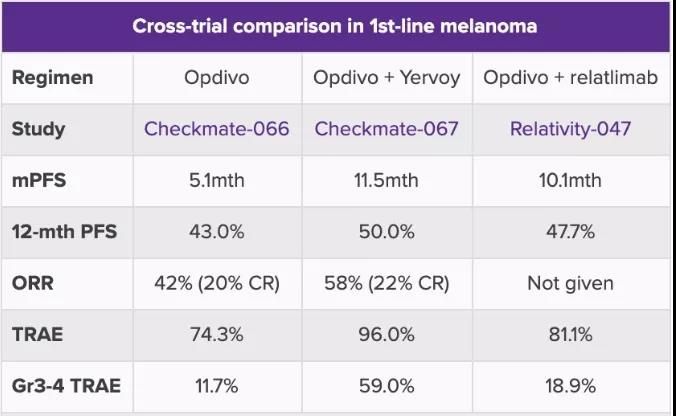
▲ASCO2021,黑色素瘤一线治疗比对
药融云数据,www.pharnexcloud.com显示:国际上来看,目前有罗氏、Immutep、BMS、默沙东(MK-4280,Favezelimab单抗)、再生元、葛兰素史克、诺华、BI、F-star、Xencor、Symphogen等在开发;
国内布局LAG-3免疫检查点新药的有:信达生物(单抗以及PD-L1/LAG-3双抗IBI323)、岸迈生物(EMB-02,PD-1/LAG-3双抗)、康方生物(AK-129,PD-1/LAG-3双抗)、再鼎医药(MacroGenics合作的MGD013,PD-1/LAG-3双抗)、迈博斯、维立志博(单抗)、时迈药业(DNV-3单抗)、恒瑞医药(SHR1802单抗)、科伦博泰/安源医药、博际生物、天广实、天境生物、亿腾EOC、复宏汉霖、凡恩世(LAG-3/TIM-3双抗)、誉衡生物等等;
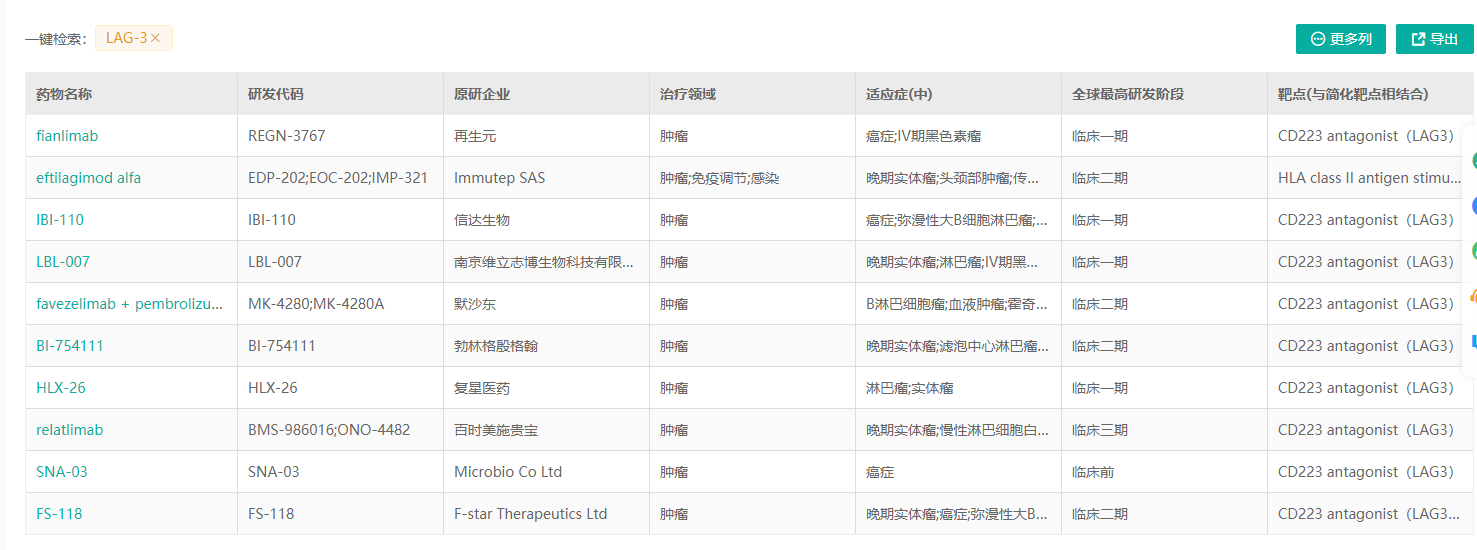
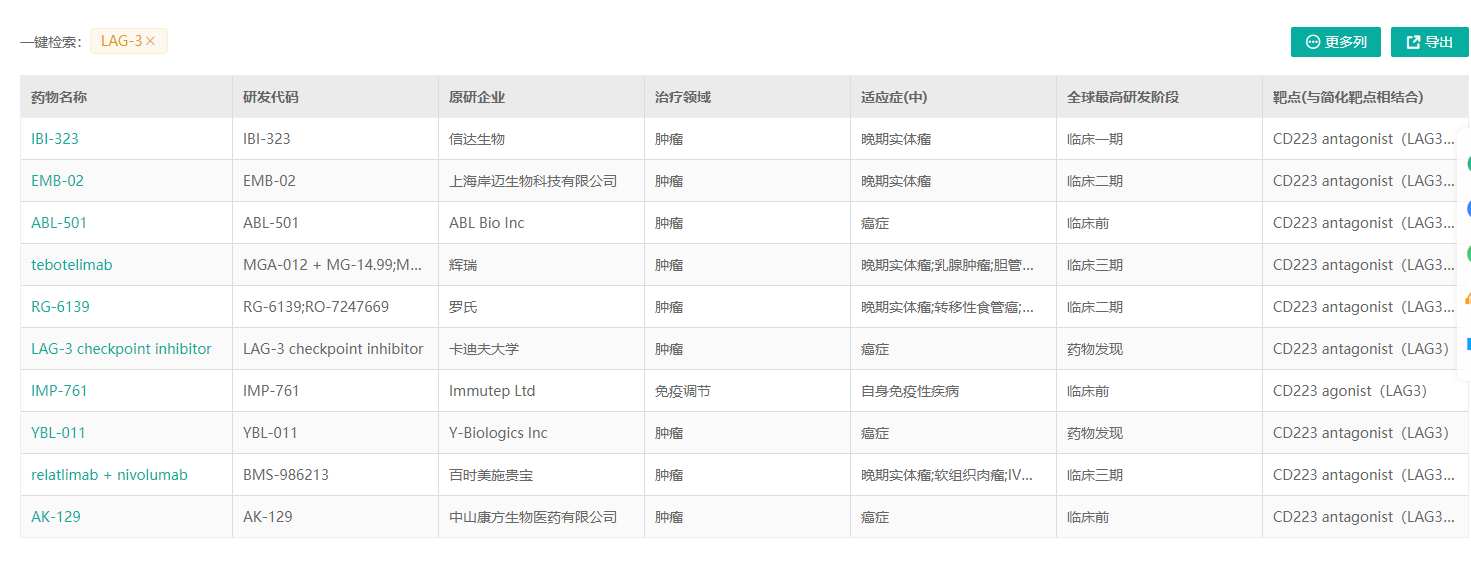
数据来源:药融云
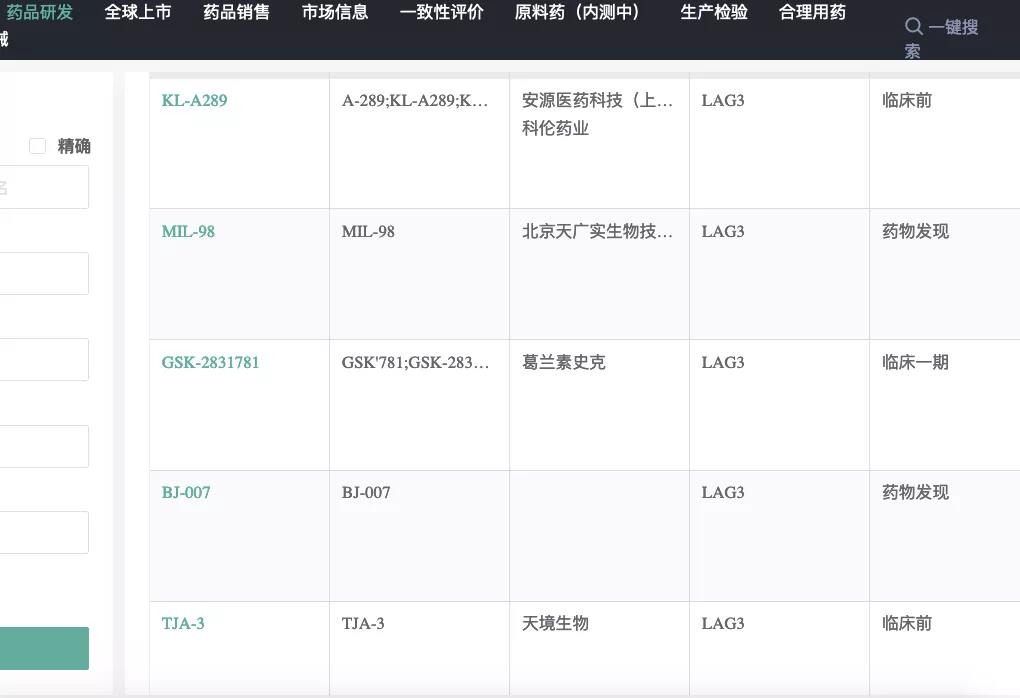
▲详细信息,登陆药融云数据企业版,db.pharnexcloud.com
目前暂无LAG-3靶点ADC药物挺进临床试验阶段。
参考:
NMPA/CDE;
药融云数据,www.pharnexcloud.com;
FDA/EMA;
相关公司公开披露;
clinical trials;
https://clinicaltrials.gov/ct2/results?cond=&term=RO7247669&cntry=&state=&city=&dist=;
LAG-3: from molecular functions to clinical applications,Takumi Maruhashi , Daisuke Sugiura , Il-mi Okazaki , Taku Okazaki, doi:10.1136/ jitc-2020-001014;
Bristol Myers Squibb Announces LAG-3-Blocking Antibody Relatlimab and Nivolumab Fixed-Dose Combination Significantly Improves Progression-Free Survival vs. Opdivo (nivolumab) in Patients with Previously Untreated Metastatic or Unresectable Melanoma. https://www.businesswire.com/news/home/20210519005852/en;
Bristol Myers Squibb outraces the pack to a late-stage trial win for its LAG-3/PD-1 antibody combo in melanoma;
BMS第三款检查点抑制剂来了!抗LAG-3抗体Relatlimab联合欧狄沃为黑色素瘤患者带来获益;等等。
<END>




















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论