
1. 概述
《已上市化学药品药学变更研究技术指导原则(试行)》(下文简称为变更指导原则)中的新增规格是指原研药品增加的新规格或仿制药增加目前原研药品/参比制剂已有的规格,同时不得改变药品原批准的适应症、用法用量或者适用人群等。增加规格均属于重大变更。变更指导原则中明确指出新增规格应为目前原研药品/参比制剂已有的规格,但实际注册申请过程中确实存在新增规格产品不在仿制药参比制剂目录里面的情况,即新增规格产品无参比制剂。同时也有无参比制剂产品按照注册分类3类申报生产,且已通过审批。
产品规格应遵循方便临床用药的原则,应有合理、科学的依据。总体上,申报规格一般应在其临床使用的用法用量范围内,不得大于单次用药的最高剂量,或对成人用药来说不得小于成人单次用药的最低剂量。1.4%浓度规格(即100ml:1.4g)的碳酸氢钠注射液就属于这种情况,下文对其注册申报情况进行汇总分析,并对注射剂注册申报过程中的共性问题的进行探讨,以期对业界有一定的启示作用。
2. 品种介绍
2.1 参比制剂
国家局发布的《化学仿制药参比制剂目录》中,碳酸氢钠注射液的参比制剂信息如下:
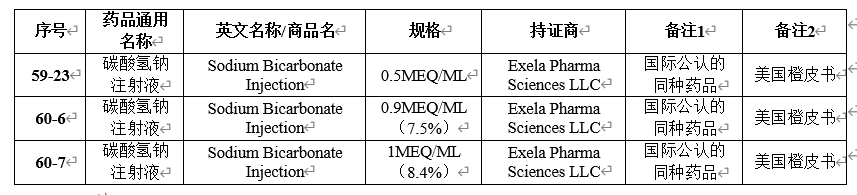
参比制剂浓度分别为4.2%、7.5%和8.4%,参比制剂均未进口中国,故目前一般按照新3类进行申报生产或按照增加规格的方式申报补充申请,目前本品已有100多个批准文号。
参比制剂目录中无1.4%浓度规格(即100ml:1.4g)的碳酸氢钠注射液,但是国家卫健委 2016年5月发布的《关于印发首批鼓励研发申报儿童药品清单的通知》中有该规格的碳酸氢钠注射液,被列为首批鼓励开发的儿童用药。故1.4%浓度规格(即100ml:1.4g)的碳酸氢钠注射液可以按照3类进报生产,也可以按照增加规格的方式申报补充申请。
2.2 规格合理性讨论
100ml:1.4g规格的碳酸氢钠注射液与国家局已发布的碳酸氢钠注射液参比制剂规格不一致,其规格合理性讨论如下:
(1)为满足儿科临床用药需求,保障儿童用药,促进儿童适宜品种、剂型、规格的研发创制和申报审评,国家卫健委2016年5月发布的《关于印发首批鼓励研发申报儿童药品清单的通知》(国卫办药政函〔2016〕573号)文件中,100ml:1.4g的碳酸氢钠注射液被列为首批鼓励开发的儿童用药,以满足已有5%碳酸氢钠注射液不适用于儿童患者临床需求的目的。本品新增100ml:1.4g浓度规格临床使用方便,无需稀释,避免浪费。
(2)经查,目前国内已有多家生产企业获批该浓度规格的碳酸氢钠注射液,故有一定的临床价值。按照现行《化学药品注册分类及申报资料要求》中关于化学药品3类规格的要求,有充分研究数据证明合理性的情况下,规格可以与参比制剂不一致。结合临床价值,对本品规格合理性探讨如下:已发布碳酸氢钠注射液参比制剂的浓度均不能直接静脉输注,输液使用时需要稀释为等渗或其他溶液。1.4%浓度的碳酸氢钠注射液为等渗液,具有临床使用方便,相对安全等特点。1.4%的碳酸氢钠注射液已列入世界卫生组织基本药物目录和儿童基本药物目录,国内“首批鼓励研发申报儿童药品清单”中也将1.4%(100ml)碳酸氢钠注射液列入其中。
2.3 药学研究关注点
处方:公开资料显示本品处方为碳酸氢钠、二氧化碳和注射用水,早期(约2000年前后)获批的碳酸氢钠注射液处方中一般使用活性炭,有的处方中还包括依地酸二钠,已不符合现行的技术要求。故增加规格的补充申请及按照3类申报生产的碳酸氢钠注射液,其处方中一般是不允加活性炭和依地酸二钠的。
同时,原辅料内控标准一般需要增加微生物限度和细菌内毒素考察项,以满足注射用辅料的相关要求。
工艺:采用常规注射液的制备工艺,灭菌工艺选择过度杀灭法。碳酸氢钠不稳定,故工艺中可能需要充二氧化碳作为pH调节剂,以调节所配溶液的pH值在合适的范围内。此外,拉唑类注射剂也有类似的操作,拉唑类原料药在酸性条件下易降解,故一般需将溶液pH值调节为碱性环境。
关于过量灌装需根据《化学仿制药注射剂过量灌装研究技术指导原则》的相关要求提供过量灌装的依据。同时需进行生产工艺验证、灭菌工艺验证、包装密封性验证、滤芯相容性验证等,包装密封性检测方法需关注方法学转移问题及阳性样品打孔的确证研究资料。如产品采用无菌工艺制备,其滤芯相容性验证需包括细菌截留研究验证资料。
碳酸氢钠注射液为中性偏碱的pH值,与玻璃包材的相容性稍差,存在玻璃脱片、脱屑等安全性风险。因此,其更偏爱软袋类内包材。包材相容性研究需符合现行的技术要求,同时需进行稳定性末期样品的包材迁移试验,以确保所选包材符合要求。
质量标准及质量研究:
质量标准为常规注射剂的考察项目,如:性状、鉴别、溶液澄清度与颜色、渗透压摩尔浓度、可见异物、不溶性微粒、细菌内毒素、含量等,同时100ml:1.4g规格碳酸氢钠注射液的适应症包括儿童,可能需要将铝盐定入内控标准,限度为25μg/L。
元素杂质:需满足ICH Q3D的相关要求。
质量对比研究:需要与稀释至1.4%浓度的参比制剂(参比制剂应为国家局公布的)进行质量对比研究,确保产品质量不低于参比制剂。
稳定性考察:
常规注射剂的稳定性考察内容,一般需包括低温循环试验、冻融循环试验、加速稳定性、长期稳定性考察等,如所用包材为半透性包材,需设计低湿条件下的稳定性考察方案。
3. 小结
无参比制剂不代表产品就无法通过仿制药途径申报生产或以增规的方式申报补充申请,100ml:1.4g规格碳酸氢钠注射液就是这种情况,此外还有仁合益康的葡萄糖酸钙锌口服溶液(受理号:CYHS1700608)。
本文主要以100ml:1.4g规格碳酸氢钠注射液为例,讨论了其处方工艺、质量研究及稳定性研究等相关要求,同时包括了注射剂注册申报过程中的共性问题,可供其它注射剂注册申报时参考,以期对大家有一定的启示作用。
参考来源:
[1] FDA审评报告
[2] 欧盟审评报告
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论